肝细胞肝癌(hepatocellular carcinoma,HCC)是全球最常见的恶性肿瘤之一,其发病率在全球恶性肿瘤中占第5位,病死率占第3位[1-2],每年死于HCC者约有50万[3]。目前,在中国,HCC也是常见的恶性肿瘤之一,发病人数占全世界HCC患者总数的55%[4-5]。HCC的病因与很多因素有关,其中包括乙型肝炎病毒(hepatitis B virus,HBV)感染、丙型肝炎病毒(hepatitis C virus,HCV)感染、酒精滥用、黄曲霉毒素等[6-7]。HBV感染严重威胁着人类的健康,在我国,大约有9 300万HBV携带者,约3 000万慢性乙型肝炎患者[8]。目前酒精滥用率在逐年上升,我国约有6.6%男性和0.1%女性被诊断为酒精滥用[9]。HBV感染、酒精滥用导致HCC的机制以及乙型肝炎相关性HCC和酒精相关性HCC的临床特征不同,且这2种HCC的生物学行为也不相同,故深入研究并阐明这些不同对防治不同类型HCC具有重要意义。
1 资料与方法
1.1 一般资料 收集2011年1月1日—2016年12月31日在河北医科大学第四医院住院的HCC患者271例,其中乙型肝炎相关性HCC患者215例(乙型肝炎组),酒精相关性HCC患者56例(酒精组)。
1.2 病例纳入标准和排除标准 纳入标准:①均符合原发性肝癌诊断标准[10]的HCC患者;②病历、检验及检查资料完整的患者;③无其他脏器原发肿瘤或严重基础疾病(心脑血管、呼吸系统疾病)的患者;④既往存在乙型肝炎病史,且入院后查HBV表面抗原(hepatitis B surface antigen,HBsAg)阳性的患者;⑤酒精摄入量男性≥40 g/d,女性≥20 g/d,持续5年以上的患者。排除标准:①并发HCV感染的患者及其他类型的慢性肝病患者;②病历资料不完整的患者及未行影像学检查的患者;③既往存在乙型病毒性肝炎病史和(或)丙型肝炎病史,入院后查HBsAg阳性和(或)抗-HCV阳性且同时酒精摄入量男性≥40 g/d,女性≥20 g/d,持续5年以上的患者。
1.3 肝功能Child-Pugh分级 肝功能Child-Pugh分级标准:将HCC患者的凝血酶原延长时间、血清总胆红素、血清白蛋白、腹水、肝性脑病按照不同程度进行评分,见表1。
各指标评分相加,根据评分总和将肝功能分为A、B、C三级:5~6分为A级;7~9分为B级;10~15分为C级。
表1 肝功能Child-Pugh分级标准
Table 1 Child-Pugh grading criteria for liver function
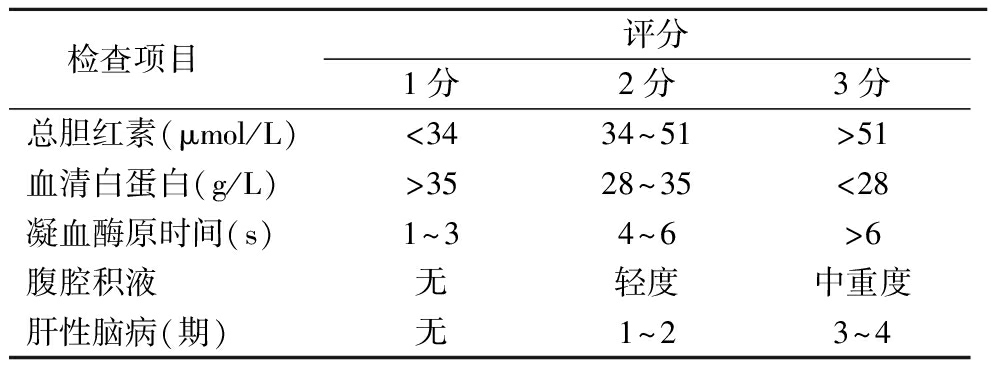
检查项目 评分1分2分3分总胆红素(μmol/L)<3434~51>51血清白蛋白(g/L)>3528~35<28凝血酶原时间(s)1~34~6>6腹腔积液无轻度中重度肝性脑病(期)无1~23~4
1.4 HCC的影像学分型 目前,在国际上,HCC的大体分型无统一标准,我国肝癌病理研究协作组于1979年制定,1991年列入中华人民共和国卫生部医政司颁布的《中国常见恶性肿瘤诊治规范》的中国分型中将肝癌分为5个大型:①弥漫型,癌结节呈弥漫性分布于全肝;②小癌型,单个癌结节直径≤3 cm,或相邻2个癌结节直径之和≤3 cm;③结节型,癌结节直径在3~5 cm之间;④块状型,瘤体直径在5~10 cm之间;⑤巨块型,瘤体直径>10 cm。而在影像学上又可归为4种类型:①弥漫型,癌结节呈弥漫性分布于全肝;②小癌型,单个癌结节直径≤3 cm,或相邻2个癌结节直径之和≤3 cm;③结节型,肿瘤最大径在3~5 cm之间;④块状型,肿瘤最大径≥5 cm,相当于病理上的块状型和巨块型(图1)。
本研究采用实体瘤疗效评价标准RECIST 1.1中的测量标准对肿瘤大小进行测量[11]。影像学上肿瘤大小分别由2名高年资影像科主治医师测量所得平均值。
1.5 统计学方法 应用SPSS 21.0统计软件分析数据。正态分布计量资料比较采用t检验,非正态分布计量资料比较采用秩和检验;计数资料比较采用χ2检验;等级资料比较采用秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 2组一般特征比较 酒精组男性比例高于乙型肝炎组,差异有统计学意义(P<0.05);2组年龄比例差异无统计学意义(P>0.05)。见表2。
表2 乙型肝炎组与酒精组性别、年龄比较
Table 2 Comparison of gender and age between HBV-HCC and alcohol-HCC (例数)
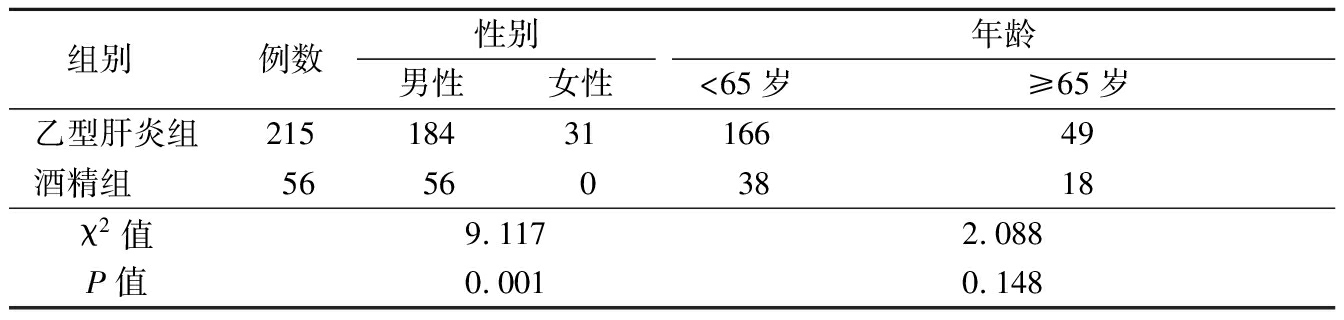
组别 例数性别男性女性年龄<65岁≥65岁乙型肝炎组2151843116649酒精组 565603818χ2值9.1172.088P值0.0010.148
2.2 2组检验指标比较 酒精组γ-谷氨酰转移酶(γ-glutamyl-transferase,GGT)和血清白蛋白(albumin,ALB)水平显著高于乙型肝炎组,甲胎蛋白(alpha-fetoprotein,AFP)水平、丙氨酸转氨酶(alanine aminotransferase,ALT)水平、天冬氨酸转氨酶(aspartate aminotransferase,AST)水平低于乙型肝炎组,差异有统计学意义(P<0.05);2组总胆红素(total bilirubin,TBIL)、肝功能Child-Pugh分级差异无统计学意义(P>0.05),见表3。
表3 乙型肝炎组与酒精组检验指标比较
Table 3 Comparison of clinical characteristics of HBV-HCC and Alcohol-HCC
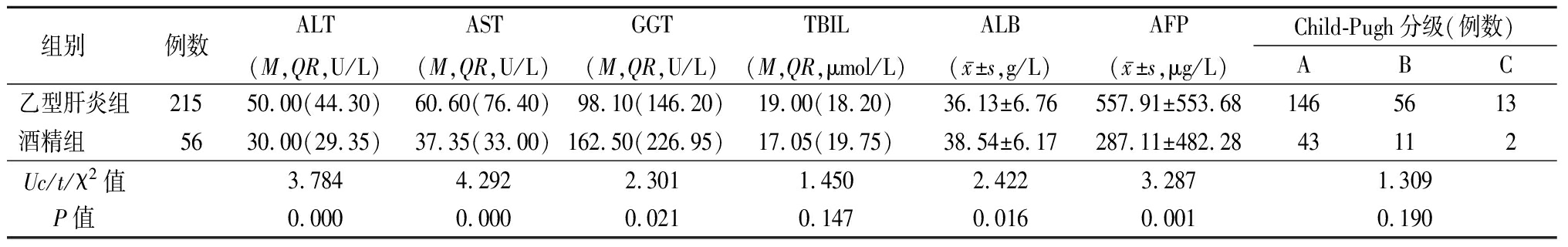
组别 例数ALT(M,QR,U/L)AST(M,QR,U/L)GGT(M,QR,U/L)TBIL(M,QR,μmol/L)ALB(x-±s,g/L)AFP(x-±s,μg/L)Child-Pugh分级(例数)ABC乙型肝炎组21550.00(44.30)60.60(76.40)98.10(146.20)19.00(18.20)36.13±6.76557.91±553.681465613酒精组 5630.00(29.35)37.35(33.00)162.50(226.95)17.05(19.75)38.54±6.17287.11±482.2843112Uc/t/χ2值3.7844.2922.3011.4502.4223.2871.309P值0.0000.0000.0210.1470.0160.0010.190
2.3 2组影像学特征比较 选出部分影像学资料完整的病例进行比较,其中乙型肝炎组104例,酒精组29例,根据中国分型,分为弥漫型、小癌型、结节型、块状型(图1);2组影像学分型、肿瘤数量及门静脉瘤栓差异无统计学意义(P>0.05),见表4。
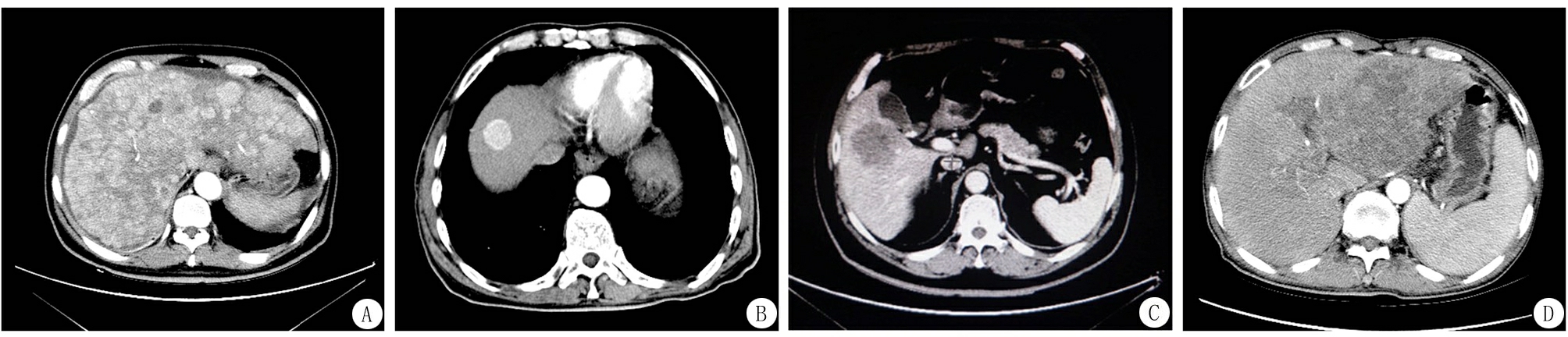
图1 HCC在影像学上的分型
A.弥漫型:癌结节呈弥漫性分布于全肝;B.小癌型:单个癌结节直径≤3 cm,或相邻2个癌结节直径之和≤3 cm;C.结节型:癌结节最大径3~5 cm;D.块状型:癌结节最大径≥5 cm
Figure 1 The image classification of hepatocellular carcinoma
表4 乙型肝炎组与酒精组影像学特征的比较
Table 4 Comparison of imaging features of HBV-HCC and alcohol-HCC (例数)
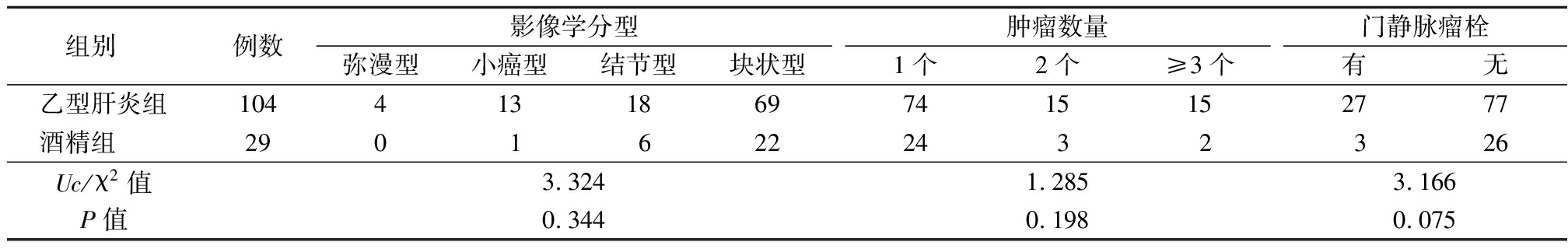
组别 例数影像学分型弥漫型小癌型结节型块状型肿瘤数量1个2个≥3个门静脉瘤栓有无乙型肝炎组10441318697415152777酒精组 29016222432326Uc/χ2值3.3241.2853.166P值0.3440.1980.075
3 讨 论
肝癌是全世界范围内最常见的实体恶性肿瘤之一,其发病率和病死率呈逐年上升的趋势[4-5]。尽管既往研究尚未完全阐明肝癌的发病原因及发病机制,但HBV感染、HCV感染、酒精滥用、黄曲霉毒素、饮用水污染、遗传因素等均与肝癌的发生有关[12-13]。不同病因引起肝癌的致病机制不同,可能使肝癌的临床特点有所不同。本研究主要探讨乙型肝炎相关性HCC及酒精相关性HCC在临床特点上的区别。
本研究酒精组男性比例高于乙型肝炎组,可能与男性酒精滥用的比例更高有关[9]。酒精组GGT和ALB水平显著高于乙型肝炎组,AFP水平、ALT水平、AST水平低于乙型肝炎组。酒精组GGT水平较高可能与酒精是肝细胞线粒体酶诱导剂,可促进线粒体中GGT的合成和释放有关;乙型肝炎组ALB水平较低提示病毒可能比酒精更容易影响肝脏合成功能。乙型肝炎组ALT、AST均较高,提示肝功能损害较重。乙型肝炎组AFP较高提示2种肝癌可能是由不同信号蛋白介导癌变的。
AFP是目前最常用的检测肝癌的肿瘤标记物[14],是一种糖蛋白,主要由胎儿肝细胞及卵黄囊合成。AFP在胎儿血液循环中具有较高的浓度,但在出生后下降,生后2~3个月基本被ALB替代,故在成人血清中AFP含量极低,通常<20 μg/L。AFP在部分急慢性肝炎、肝硬化等良性患者中也有升高,但与肝癌患者血清中AFP升高的幅度有显著差异。
不同病因所致的肝癌中,AFP升高的幅度也不相同,Amaddeo 等[15]通过对86例乙型肝炎相关性HCC和90例非乙型肝炎相关性HCC进行比较发现,血清中AFP水平在乙型肝炎相关性HCC患者中更高。Yao等[16]研究发现HBsAg阳性HCC患者的AFP水平较HBsAg阴性HCC患者升高的更明显,将796例HCC患者(其中616例HBsAg阳性患者,180例HBsAg阴性患者)的AFP水平确定一个分界值(11.62 μg/L),大于分界值为阳性,结果证明AFP的阳性率在HBsAg阳性患者中更高。
乙型肝炎相关性HCC患者中AFP水平高于酒精相关性HCC,可能与HBV感染有关。Li等[17]研究表明,HBV中X蛋白(hepatitis B virus X protein,HBx)是诱导肝细胞恶性转化的关键因素,HBx与P53相互作用,能够刺激AFP的表达。Zhang等[18]推测HBx蛋白通过作用于2个HBx敏感区域,包括Luc-1的启动子和增强子,触发AFP转录。而AFP水平与HCC患者的预后直接相关,刘永炜等[19]研究表明,肝癌术后复发组AFP水平显著高于肝癌术后未复发组,表明血清AFP对原发性肝癌有较好的预后评估价值。HCC在影像学上表现出肿瘤的数量可能与病因有关系,Lee等[20]研究发现,与乙型肝炎相关性HCC、HCV相关性HCC和酒精相关性HCC相比,隐源性肝癌表现出孤立性肿瘤的频率更高;另外,与乙型肝炎相关性HCC和丙型肝炎病毒相关性HCC相比,隐源性肝癌的门静脉瘤栓形成率更低。
在影像学上,本研究选择了影像资料完整的133例患者进行了影像学比较。乙型肝炎相关性HCC和酒精相关性HCC在影像学分型、肿瘤数量及门静脉瘤栓差异无统计学意义。因此,认为临床上不能以影像学区分这2个肝癌亚型。
不同危险因素导致的HCC可能表现出不同的生物学行为,肿瘤的生物学行为不同决定了患者的预后不同,而HCC在影像学上的表现包括肿瘤分型、肿瘤数量及门静脉瘤栓情况也可以间接反映其生长、侵袭及转移的方式[21]。但是目前关于不同病因的HCC的影像学特征研究较少,本研究仅涉及乙型肝炎相关性HCC和酒精相关性HCC,且两者在影像学表现上无明显差异,需要进一步寻找其在病理学、治疗方式等方面与预后的关系,从而为区分不同亚型HCC及治疗提供新思路。
[1] Torre LA,Bray F,Siegel RL,et al. Global cancer statistics,2012[J]. CA Cancer J Clin,2015,65(2):87-108.
[2] 耿蕴峰,李晓娜,杨红,等.DNAJC6异常过表达促进肝细胞肝癌的进展[J].河北医科大学学报,2017,38(5):548-551.
[3] Ferlay J,Soerjomataram I,Dikshit R,et al. Cancer incidence and mortality worldwide: sources,methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer,2015,136(5):E359-386.
[4] McGuire S. World Cancer Report 2014. Geneva,Switzerland: World Health Organization,International Agency for Research on Cancer,WHO Press,2015[J]. Adv Nutr,2016,7(2):418-419.
[5] Bosetti C,Turati F,La Vecchia C. Hepatocellular carcinoma epidemiology[J]. Best Pract Res Clin Gastroenterol,2014,28(5):753-770.
[6] Balogh J,Victor D,Asham EH,et al. Hepatocellular carcinoma: a review[J]. J Hepatocellular Carcinoma,2016,3:41-53.
[7] Wallace MC,Preen D,Jeffrey GP,et al. The evolving epidemiology of hepatocellular carcinoma: a global perspective[J]. Expert Rev Gastroenterol Hepatol,2015,9(6):765-779.
[8] Cui Y,Jia J. Update on epidemiology of hepatitis B and C in China[J]. J Gastroenterol Hepatol,2013,28(Suppl 1):7-10.
[9] Wei S,Yin P,Newman IM,et al. Comparison of patterns of use of unrecorded and recorded spirits: survey of adult drinkers in rural central china[J]. Int J Environ Res Public Health,2017,14(10):E1099.
[10] 陈晓,蔡建强.《原发性肝癌诊疗规范(2017年版)》解读[J/CD].肝癌电子杂志,2017,4(3):1-5.
[11] Ronot M,Bouattour M,Wassermann J,et al. Alternative Response Criteria(Choi,European association for the study of the liver,and modified Response Evaluation Criteria in Solid Tumors[RECIST]) Versus RECIST 1.1 in patients with advanced hepatocellular carcinoma treated with sorafenib[J]. Oncologist,2014,19(4):394-402.
[12] Su L,Zhou T,Zhang Z,et al. Optimal staging system for predicting the prognosis of patients withhepatocellular carcinoma in China: a retrospective study[J]. BMC Cancer,2016,16:424.
[13] Güthle M,Dollinger MM. Epidemiology and risk factors of hepatocellular carcinoma[J]. Radiologe,2014,54(7):654-659.
[14] 林炳柱,刘小燕.甲胎蛋白联合异常凝血酶原检测在肝癌早期诊断及疗效评估中的价值分析[J].河北医科大学学报,2017,38(10):1193-1196.
[15] Amaddeo G,Cao Q,Ladeiro Y,et al. Integration of tumour and viral genomic characterisations in HBV-related hepatocellular carcinomas[J]. Gut,2015,64(5):820-829.
[16] Yao M,Zhao J,Lu F. Alpha-fetoprotein still is a valuable diagnostic and prognosis predicting biomarker in hepatitis B virus infection-related hepatocellular carcinoma[J]. Oncotarget,2016,7(4):3702-3708.
[17] Li M,Zhu M,Li W,et al. Alpha-fetoprotein receptor as an early indicator of HBx-driven hepatocarcinogenesis and its applications in tracing cancer cell metastasis[J]. Cancer Lett,2013,330(2):170-180.
[18] Zhang C,Chen X,Liu H,et al. Alpha fetoprotein mediates HBx induced carcinogenesis in the hepatocyte cytoplasm[J]. Int J Cancer,2015,137(8):1818-1829.
[19] 刘永炜,吴向民.血清AFP、CA199和CEA水平在肝癌诊断和预后中的作用[J].检验医学,2017,32(5):406-409.
[20] Lee SS,Jeong SH,Byoun YS,et al. Clinical features and outcome of cryptogenic hepatocellular carcinoma compared to those of viral and alcoholic hepatocellular carcinoma[J]. BMC Cancer,2013,13:335.
[21] He J,Shi J,Fu X,et al. The clinicopathologic and prognostic significance of gross classification on solitary hepatocellular carcinoma after hepatectomy[J]. Medicine(Baltimore),2015,94(32):e1331.