小细胞肺癌(small cell lung cancer,SCLC)作为一种神经内分泌肿瘤,其发病率约占肺癌发病的15%~20%,具有恶性程度高、侵袭性强、倍增时间短、病情进展快、早期易发生广泛转移的特点,大多数患者确诊时已是晚期[1]。SCLC对放化疗敏感,但易复发转移,5年生存率低于5%,预后差。然而随着诊疗技术的不断发展与提高,SCLC患者的5年生存率并未得到明显改善,故寻找能够预测SCLC预后的指标对于指导临床具有极其重要的意义。大量研究表明,肿瘤微环境中的相关炎性因子参与肿瘤细胞的增殖、侵袭和转移,与肿瘤的发生发展密切相关[2]。机体内许多炎性指标如C反应蛋白、中性粒细胞与淋巴细胞比值(neutrophil/lymphocyte ratio,NLR)、血小板与淋巴细胞比值、预后营养指数、格拉斯哥预后评分均能够预测肿瘤患者的预后。而NLR已被证实与非SCLC、胃癌、头颈部鳞癌、卵巢癌及乳腺癌等多种实体瘤患者的预后有关[3-6]。但是目前关于治疗前NLR与SCLC患者预后的研究甚少。本研究回顾性分析75例SCLC患者治疗前的NLR水平,旨在探索其对患者预后的影响,报告如下。
1 资料与方法
1.1 一般资料 收集2011年6月—2016年6月在河北省人民医院初治的75例SCLC患者临床资料。年龄43~75岁,中位年龄59岁,其中<60岁40例,≥60岁35例;男性46例,女性29例;吸烟者38例,不吸烟者37例;美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG) 评分0~1分48例,≥2分27例;接受同步化放疗43例,序贯化放疗32例;根据美国退伍军人协会的分期标准进行分期,局限期32例,广泛期43例。
所有患者及家属知情同意并签署知情同意书。
1.2 纳入与排除标准 纳入标准:经病理诊断明确的初治的SCLC患者;无远处转移;未行手术治疗;无放化疗相关禁忌证;预计生存期>3个月;实验室检测结果及随访资料完整。排除标准:未经病理证实;有严重心、脑、肾等疾病或放化疗绝对禁忌证;合并急/慢性感染;合并其他恶性肿瘤者或免疫系统疾病者;伴远处转移;无完整的临床资料或失访者。
1.3 方法 患者均行序贯化放疗或同步化放疗。胸部放疗总剂量为50~60 Gy,1.8~2.0 Gy/次,5次/周。主要化疗方案为顺铂+依托泊苷、卡铂+依托泊苷,化疗周期为4~6个周期。采集所有患者治疗前1周内清晨空腹静脉血用于检测临床指标。应用全自动血细胞分析仪进行血常规测定。根据血常规结果计算NLR。选择中位NLR 3.18作为界值[7],将患者分为高NLR(≥3.18)组,低NLR(<3.18)组。
1.4 随访 治疗结束后通过门诊复查、电话或短信等形式进行随访。随访内容包括患者的一般情况及复发进展状况等。随访截至2017年12月31日。无进展生存期(progression-free survival,PFS)定义为从患者接受治疗至肿瘤进展的时间;总生存时间(overall survival,OS)定义为患者开始治疗至患者死亡或随诊截止时间。
1.5 统计学方法 应用SPSS 21.0软件分析数据。计数资料比较采用χ2检验;采用Kaplan-Meier生存分析法绘制生存曲线,Log-rank检验进行组间生存曲线的比较;采用Cox比例风险回归模型分析影响预后的危险因素。P<0.05为差异有统计学意义。
2 结 果
2.1 NLR与临床特征的关系 对于不同NLR组性别、年龄、临床分期、吸烟与否、治疗方式、ECOG评分等方面进行比较。结果显示高NLR组临床分期中广泛期比例多于低NLR组,差异有统计学意义(P<0.05);而2组间性别、年龄、吸烟比例、治疗方式差异均无统计学意义(P>0.05)。见表1。
表1 2组SCLC患者临床特征比较
Table 1 Comparison of clinical characteristics between two groups of SCLC patients (例数,%)
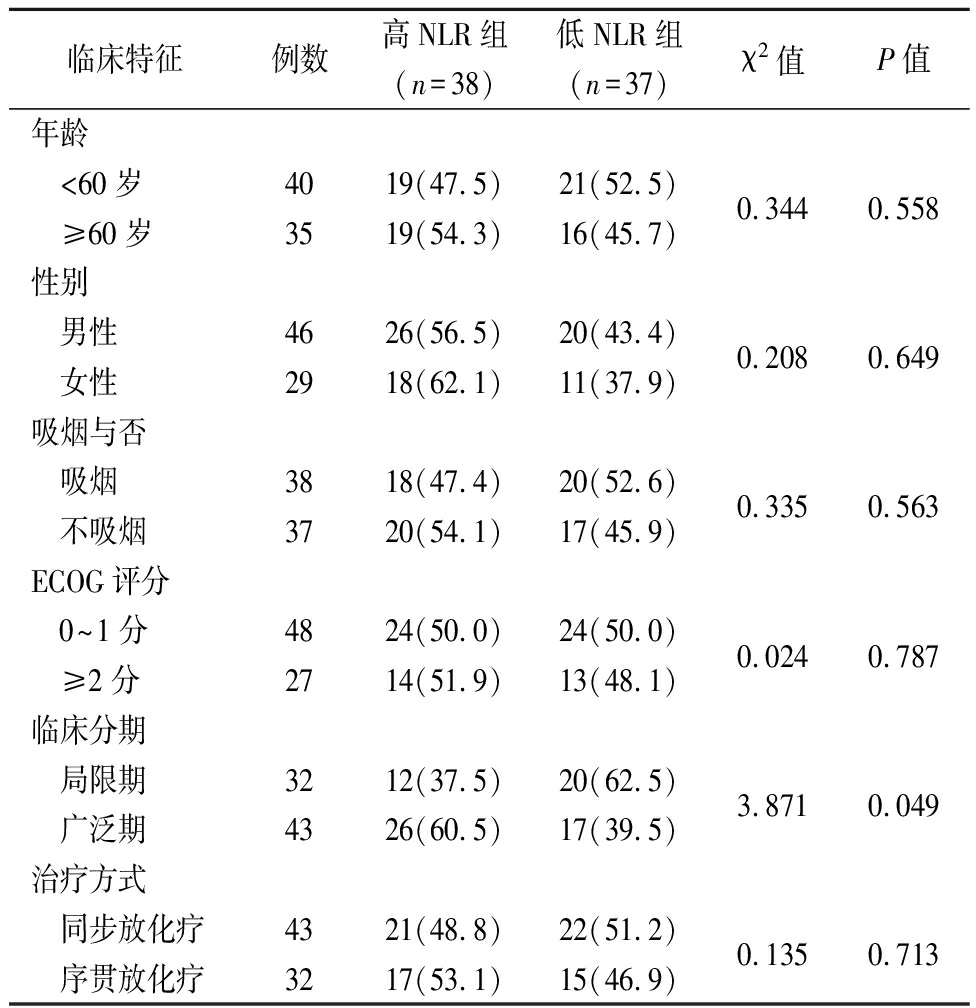
临床特征例数高NLR组(n=38)低NLR组(n=37)χ2值P值年龄 <60岁 ≥60岁403519(47.5)19(54.3)21(52.5)16(45.7)0.3440.558性别 男性 女性462926(56.5)18(62.1)20(43.4)11(37.9)0.2080.649吸烟与否 吸烟 不吸烟383718(47.4)20(54.1)20(52.6)17(45.9)0.3350.563ECOG评分 0~1分 ≥2分482724(50.0)14(51.9)24(50.0)13(48.1)0.0240.787临床分期 局限期 广泛期324312(37.5)26(60.5)20(62.5)17(39.5)3.8710.049治疗方式 同步放化疗 序贯放化疗433221(48.8)17(53.1)22(51.2)15(46.9)0.1350.713
2.2 NLR与预后的关系 高NLR组与低NLR组中位PFS分别为5.73个月和8.50个月, 差异有统计学意义(χ2=6.979, P<0.05);高NLR组与低NLR组中位OS分别10.57个月和15.10个月,差异有统计学意义(χ2=8.930,P<0.05)。
2.3 SCLC患者临床特征与PFS和OS的关系 在SCLC患者中,≥60岁者中位PFS短于<60岁者,ECOG评分≥2分者中位PFS短于<0~1分者,临床分期广泛期者中位PFS短于局限期者,序贯放化疗者中位PFS短于同步放化疗者,NLR水平≥3.18者中位PFS短于NLR<3.18者,差异均有统计学意义(P<0.05)。ECOG评分≥2分者中位OS短于0~1分者,临床分期中广泛期者中位OS短于局限期者,序贯放化疗者中位OS短于同步放化疗者,NLR水平≥3.18者中位OS短于NLR<3.18者,差异均有统计学意义(P<0.05)。见表2。
2.4 Cox比例风险回归模型分析 以PFS和OS为因变量,以年龄(<60岁=0,≥60岁=1)、性别(女=0,男=1)、吸烟(不吸烟=0,吸烟=1)、ECOG评分(0~1分=0,≥2分=1)、临床分期(局限期=0,广泛期=1)、治疗方式(序贯治疗=0,同步治疗=1)、NLR水平(<3.18=0,≥3.18=1)为自变量,评价PFS和OS的影响因素,结果显示临床分期、NLR水平均是SCLC患者PFS和OS的影响因素(P<0.05),见表 3,4。
表2 SCLC患者临床特征与PFS和OS关系
Table 2 The relationship between clinical characteristics of SCLC patients and PFS and OS
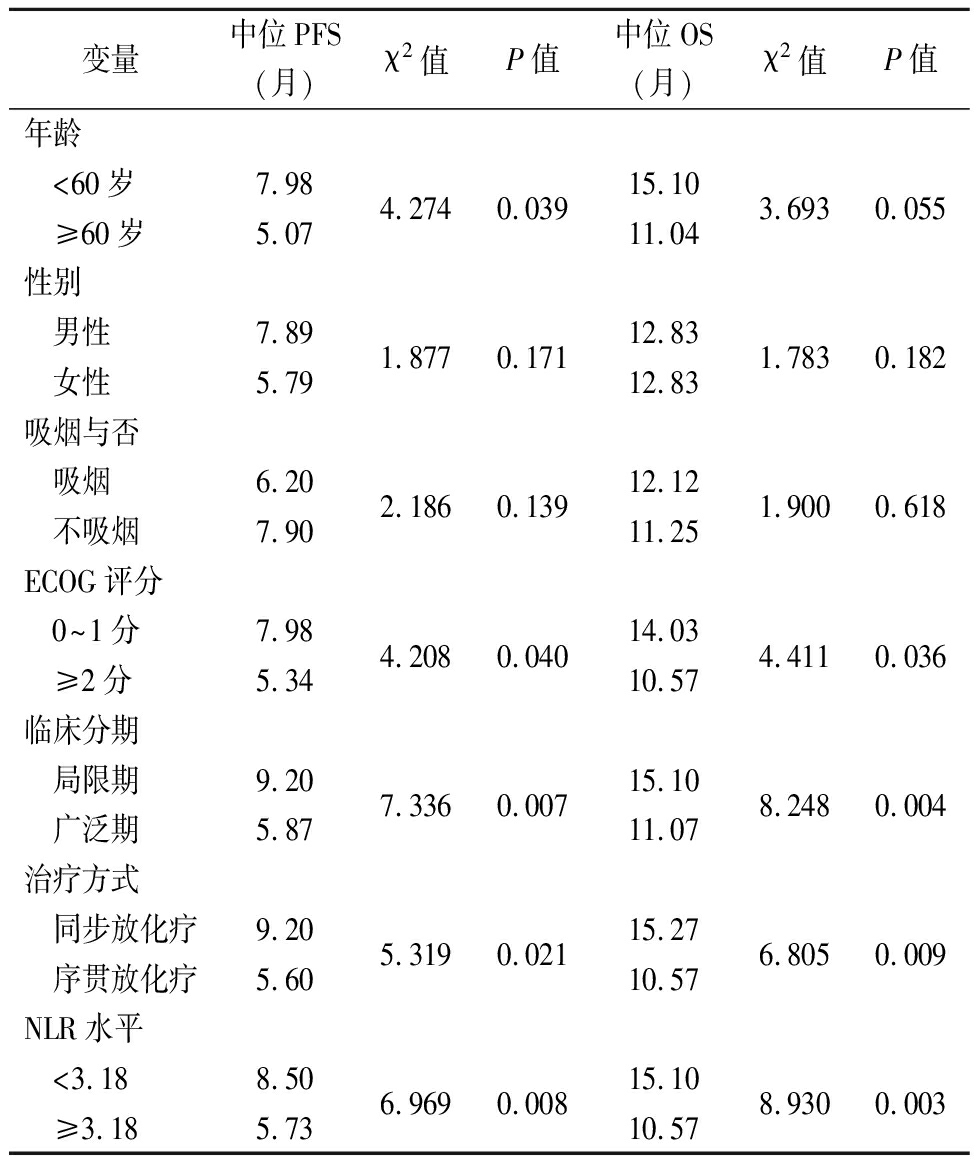
变量中位PFS(月)χ2值P值中位OS(月)χ2值P值年龄 <60岁 ≥60岁7.985.074.2740.03915.1011.043.6930.055性别 男性 女性7.895.791.8770.17112.8312.831.7830.182吸烟与否 吸烟 不吸烟6.207.902.1860.13912.1211.251.9000.618ECOG评分 0~1分 ≥2分7.985.344.2080.04014.0310.574.4110.036临床分期 局限期 广泛期9.205.877.3360.00715.1011.078.2480.004治疗方式 同步放化疗 序贯放化疗9.205.605.3190.02115.2710.576.8050.009NLR水平 <3.18 ≥3.188.505.736.9690.00815.1010.578.9300.003
表3 影响SCLC患者PFS 的Cox回归分析
Table 3 Cox regression analysis of PFS in patients with small cell lung cancer

变量回归系数标准误Wald χ2值P值RR值95.0%CI临床分期 -0.7300.4825.8430.0160.4820.267~0.871治疗前NLR水平-0.6370.0404.2390.0400.5290.289~0.970
表4 影响SCLC患者OS 的Cox回归分析
Table 4 Cox regression analysis of OS in patients with small cell lung cancer

变量回归系数标准误Wald χ2值P值RR值95.0%CI临床分期 -0.7370.4796.0070.0140.4790.265~0.863治疗前NLR水平-0.8770.4168.0620.0050.4160.227~0.762
3 讨 论
早在19世纪Rudolf Virchow首次提出肿瘤的发展与慢性炎症存在一定相关性[8]。近年来,随着对肿瘤微环境更加深入的探索与研究,人们对肿瘤与炎症的关系有了更深层的了解,发现机体的炎性反应在促进肿瘤的发生发展过程中起重要的调节作用,机制在于大量的炎性介质能够造成细胞的氧化损伤,改变肿瘤微环境,从而导致肿瘤细胞的增殖、侵袭、免疫逃逸及远处转移的发生[9]。由此可见,炎性因子可以作为预测恶性肿瘤患者预后的生物学指标,而NLR作为系统免疫炎性指标之一,在20世纪90年代就有学者发现其外周血中性粒细胞比例随恶性肿瘤患者病情进展而增加的现象,因而提出NLR与肿瘤患者的预后有关[10]。此外,大量文献也证实NLR能够预测多种实体肿瘤患者的预后。
NLR作为免疫炎性指标,代表机体炎性反应与免疫反应之间的平衡状态[11]。NLR水平升高反映了机体中性粒细胞数相对增加和(或)淋巴细胞数相对减少,二者在肿瘤进展中发挥不同作用。具体机制在于:中性粒细胞增多,代表机体炎性反应增强,一方面它能促进炎性介质如白细胞介素1、白细胞介素6等的大量释放,并同时刺激血管内皮细胞生长因子的大量分泌,促进肿瘤新生血管的形成;另一方面中性粒细胞可抑制淋巴细胞和自然杀伤细胞的活性,降低机体的抗肿瘤免疫反应,促进肿瘤远处转移。Ocana等[12]研究也证实中性粒细胞增多有利于肿瘤细胞增殖与生长,促进预后不良的发生。而淋巴细胞作为机体免疫应答功能的重要组分,具有识别并清除体内瘤细胞的能力,在抗肿瘤免疫中起着重要的作用。它不仅能够抑制肿瘤细胞的增殖和转移,而且能够直接杀伤肿瘤细胞[13]。淋巴细胞数量减少,使机体的抗肿瘤免疫功能减弱,对于肿瘤缺乏有效的免疫反应,导致肿瘤的侵袭和发展。总之,NLR升高提示机体抗肿瘤免疫炎性反应失衡,是预后不良的标志。这与Choi等[14]研究结果一致。
本研究回顾性分析了75例SCLC患者治疗前NLR水平与临床特征及生存期之间的相关性。结果显示高NLR组与低NLR组患者临床分期差异有统计学意义(P<0.05)。单因素分析显示,临床分期、治疗方式、ECOG评分、治疗前NLR水平均是SCLC患者预后的影响因素;多因素分析显示临床分期、治疗前NLR水平均是预后的影响因素。表明临床分期越晚、治疗前NLR水平越高,患者的预后越差。因此,治疗前NLR对于评估预后及指导临床治疗具有一定的价值。本研究结果与王洪玲等[15]研究结果一致。此外,其他实体肿瘤的研究结果也与其相似。Shao等[16]的研究结果显示在112例混合型SCLC中,低NRL组(<4.15)中位生存时明显长于高NRL组(≥4.15),且多因素结果显示高NLR是患者预后不良的影响因素。Pinato等[17]的前瞻性临床研究也证实,高NLR能够降低非SCLC患者的总生存时间和无复发生存时间。此外,Yodying等[18]采用荟萃分析探讨NLR与食管癌患者预后的关系,共纳入7个回顾性观察,队列涉及1 540例食管癌患者,结果显示高NLR患者的预后差、生存期短。以上研究结果均提示高NLR与预后不良密切相关。
综上所述,NLR与SCLC患者预后有关,治疗前高NLR患者的预后差,多因素结果也证实NLR为预后的影响因素,故NLR可以作为评估预后的有效生物学指标,为SCLC的治疗提供新的思路。本研究为样本量少的单中心回顾性研究,尚需进一步行多中心大样本的前瞻性研究证实治疗前NLR水平对预测恶性肿瘤患者预后的可靠性。
[1] Tartarone A,Giordano P,Lerose R,et al. Progress and challenges in the treatment of small cell lung cancer[J]. Med Oncol,2017,34(6):110.
[2] 葛婷雯,崔久嵬.肿瘤与肿瘤炎症微环境相互促进机制研究进展[J].临床检验杂志,2017,35(11):832-835.
[3] Diem S,Schmid S,Krapf M,et al.Neutrophil-to-Lymphocyte ratio (NLR) and Platelet-to-Lymphocyte ratio(PLR) as prognostic markers in patients with non-small cell lung cancer(NSCLC) treated with nivolumab[J]. Lung Cancer,2017,111:176-181.
[4] 李书梅,徐小莉,梁迪,等.外周血中性粒细胞与淋巴细胞比值以及血小板与淋巴细胞比值评估胃癌患者预后的价值[J].中华肿瘤杂志,2014,36(12):910-915.
[5] Yang Z,Gu JH,Guo CS,et al. Preoperative neutrophil-to-lymphocyte ratio is a predictor of survival of epithelial ovarian cancer:a systematic review and meta-analysis of observational studies[J]. Oncotarget,2017,8(28):46414-46424.
[6] Koh CH,Bhoo-Pathy N,Ng KL,et al. Utility of pre-treatment neutrophil-lymphocyte ratio and platelet-lymphocyte ratio as prognostic factors in breast cancer[J]. Br J Cancer,2015,113(1):150-158.
[7] 周昳欣,郝吉庆.外周血中性粒细胞与淋巴细胞比值评估小细胞肺癌患者预后的价值[J].中华疾病控制杂志,2017,21(8):827-829,834.
[8] Balkwill F,Mantovani A. Inflammation and cancer:back to Virchow[J]. Lancet,2001,357(9255):539-545.
[9] Li G,Wang Z,Ye J,et al. Uncontrolled inflammation induced by AEG-1 promotes gastric cancer and poor prognosis[J]. Cancer Res,2014,74(19):5541-5552.
[10] Ietomi K. A study on the role of granulocytes in carcinoma-bearing hosts--G/L ratio as a new host indicator[J]. Nihon Gan Chiryo Gakkai Shi,1990,25(3):662-671.
[11] Salciccioli JD,Marshall DC,Pimentel MA,et al. The association between the neutrophil-to-lymphocyte ratio and mortality in critical illness:an observational cohort study[J]. Crit Care,2015,19:13.
[12] Ocana A,Nieto-Jiménez C,Pandiella A,et al. Neutrophils in cancer:prognostic role and therapeutic strategies[J]. Mol Cancer, 2017,16(1):137.
[13] Bastid J,Bonnefoy N,Eliaou JF,et al. Lymphocyte-derived interleukin-17A adds another brick in the wall of inflammation-induced breast carcinogenesis[J]. Oncoimmunology,2014,3:e28273.
[14] Choi Y,Kim JW,Nam KH,et al. Systemic inflammation is associated with the density of immune cells in the tumor microenvironment of gastric cancer[J]. Gastric Cancer,2017,20(4):602-611.
[15] 王洪玲,李琳,王键玮,等.中性粒细胞淋巴细胞比值与小细胞肺癌预后关系的分析[J].河北医科大学学报,2018,39(4):391-395.
[16] Shao N,Cai Q. High pretreatment neutrophil-lymphocyte ratio predicts recurrence and poor prognosis for combined small cell lung cancer[J]. Clin Transl Oncol,2015,17(10):772-778.
[17] Pinato DJ,Shiner RJ,Seckl MJ,et al. Prognostic performance of inflammation-based prognostic indices in primary operable non-small cell lung cancer[J]. Br J Cancer,2014,110(8):1930-1935.
[18] Yodying H,Matsuda A,Miyashita M,et al. Prognostic significance of neutrophil-to-lymphocyte ratio and platelet-to-lymphocyte ratio in oncologic outcomes of esophageal cancer:a systematic review and meta-analysis[J]. Ann Surg Oncol,2016,23(2):646-654.