过去10年,甲状腺癌已成为我国发病增长速度最快的恶性肿瘤之一[1],对人类健康造成的危害不容忽视。其中最常见的类型为甲状腺乳头状癌(papillary thyroid carcinoma,PTC),女性发病率是男性的3倍,绝经后发病率显著下降,提示性激素在发病过程可能发生重要作用,有研究发现甲状腺癌组织中存在着性激素受体,也有研究报道促甲状腺激素受体(thyroid-stimulating hormone receptor,TSHR)水平与PTC关系密切[2]。而对雄激素受体(androgen receptor,AR)、雌激素受体(estrogen receptor,ER)及TSHR在PTC中的表达及它们之间的相互关系,鲜见文献报道。因此,探讨并深入研究性激素受体在PTC的表达及其与TSHR的关系,将有助于了解三者在致癌过程中的作用,从而进一步揭示PTC发病的分子机制,为临床诊断提供实验室及分子学方面的依据。本研究应用免疫组织化学技术对PTC组织中AR、ER及TSHR的表达进行检测,并结合临床病理特征探讨其与PTC侵袭转移的关系。
1 资料与方法
1.1 一般资料 选取2007年—2014年我院临床资料完整的197例PTC患者手术标本,术后均经过病理证实。患者无颈部放射史或甲状腺癌家族史,首诊和治疗均在我院,均为初次手术,无术前放化疗、内分泌治疗。患者性别、年龄、肿瘤大小、淋巴结转移、肿瘤TNM分期(依据美国癌症联合委员会(AJCC癌症分期标准)等相关临床资料如下:女性145例,男性52例;年龄17~85岁,平均(42.3±4.5)岁;肿瘤包膜浸润131例,无包膜浸润66例;肿瘤直径≥4 cm 92例,肿瘤直径<4 cm 105例;淋巴结有转移110例,淋巴结无转移87例;Ⅰ期48例,Ⅱ期86例,Ⅲ期42例,Ⅳ期21例。另选取PTC旁组织标本50例和同时期良性疾病(结节性甲状腺肿)手术切除的标本50例作为对照组。癌旁组织标本来自距离甲状腺癌灶旁2 cm以上或者对侧正常组织。
1.2 方法
1.2.1 免疫组织化学方法 采用免疫组织化学链霉菌抗生物素蛋白-过氧化酶(Streptavidin-Peroxidase,SP)法检测AR、ER与TSHR蛋白,严格按说明书实验步骤进行操作。石蜡组织块制作4 μm厚连续切片。每份标本常规HE染色,进行组织形态学观察和细胞分化程度判断。SP法简述如下:石蜡切片经脱蜡、水化、抗原修复;滴加过氧化酶阻断液室温10 min,PBS冲洗后滴非免疫性动物血清室温10 min,滴加第一抗体即AR抗体、抗ER抗体、抗TSHR抗体,4℃冰箱孵育过夜;PBS冲洗后滴加生物素标记的第二抗体室温10 min;PBS冲洗后滴加链霉素亲和素-过氧化物酶溶液室温10 min,PBS冲洗后DAB显色,冲冼,苏木精复染,封片,显微镜观察。每次实验用已知阳性切片作阳性对照,用PBS代替一抗作阴性对照。
1.2.2 结果判定 AR、ER与TSHR的阳性信号定位于细胞浆或者细胞核,显微镜下每张切片随机观察5个不同视野,每个视野阳性细胞数在10%上者记为阳性。
1.3 统计学方法 应用SPSS 22.0统计软件包分析数据。计数资料比较采用χ2检验;相关性采用Spearman等级相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 3组ER、TSHR和AR阳性表达比较 PTC组织和PTC癌旁组织ER、TSHR阳性表达均高于良性对照组,差异有统计学意义(P<0.05);PTC组织和PTC癌旁组织AR阳性表达均低于良性对照组,差异有统计学意义(P<0.05);PTC组织与PTC癌旁组织之间ER、TSHR和AR阳性表达差异均无统计学意义(P>0.05)。见表1。
2.2 PTC患者不同病理条件下ER、TSHR和AR阳性表达比较 女性ER、TSHR和AR阳性表达高于男性,年龄<45岁者ER阳性表达高于≥45岁者,有包膜浸润者ER、TSHR和AR阳性表达高于无包膜浸润者,肿瘤直径≥4 cm 者ER、TSHR阳性表达高于肿瘤直径 <4 cm者,有淋巴结转移者ER、TSHR阳性表达高于无淋巴结转移者,肿瘤分期Ⅲ~Ⅳ者ER、TSHR和AR阳性表达高于肿瘤分期Ⅰ~Ⅱ者,差异均有统计学意义(P<0.05);年龄≥45岁与<45岁者之间TSHR阳性表达和AR阳性表达差异无统计学意义(P>0.05);有无包膜浸润者之间、肿瘤直径≥4 cm与<4 cm者之间、有无淋巴结转移者之间AR阳性表达差异均无统计学意义(P>0.05)。见表2。
表1 3组ER、TSHR和AR阳性表达比较
Table 1 Comparison of ER, TSHR and AR expression rates among three groups (例数,%)
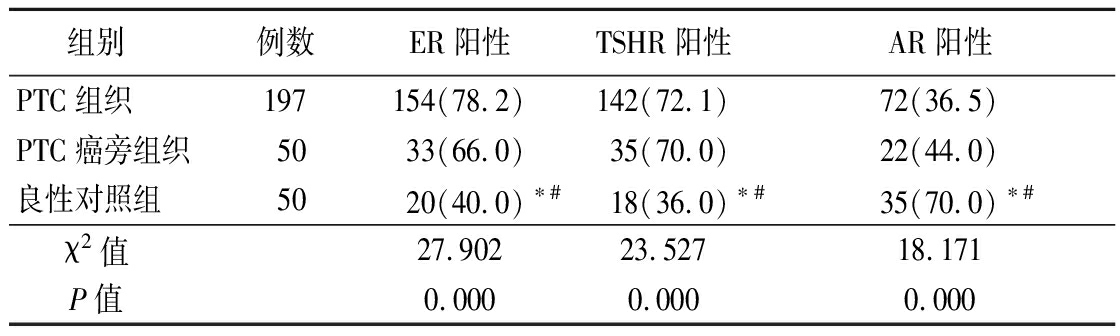
组别 例数ER阳性TSHR阳性AR阳性PTC组织197154(78.2)142(72.1)72(36.5)PTC癌旁组织5033(66.0)35(70.0)22(44.0)良性对照组5020(40.0)∗#18(36.0)∗#35(70.0)∗#χ2值 27.90223.52718.171P值 0.0000.0000.000
*P值<0.05与PTC组织比较 #P值<0.05与PTC癌旁组织比较(χ2检验)
表2 PTC组织中ER、TSHR和AR阳性表达及其与临床病理特征间的关系
Table 2 Expression of ER,TSHR and AR in PTC tissues and their relationship with clinicopathological features (例数,%)
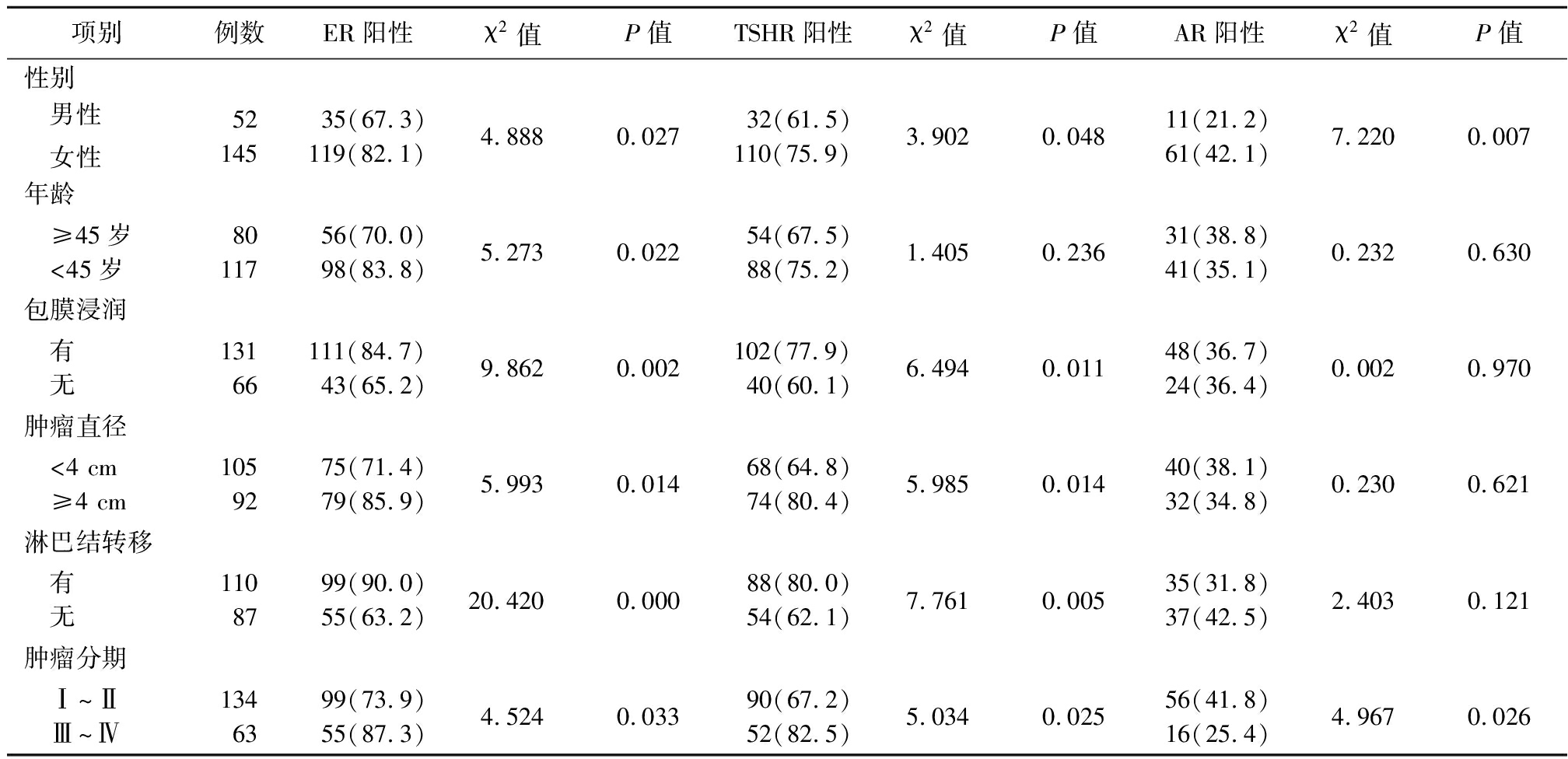
项别例数ER阳性χ2值P值TSHR阳性χ2值P值AR阳性χ2值P值性别 男性 女性5214535(67.3)119(82.1)4.8880.02732(61.5)110(75.9)3.9020.04811(21.2)61(42.1)7.2200.007年龄 ≥45岁 <45岁8011756(70.0)98(83.8)5.2730.02254(67.5)88(75.2)1.4050.23631(38.8)41(35.1)0.2320.630包膜浸润 有 无13166111(84.7)43(65.2)9.8620.002102(77.9)40(60.1)6.4940.01148(36.7)24(36.4)0.0020.970肿瘤直径 <4 cm ≥4 cm1059275(71.4)79(85.9)5.9930.01468(64.8)74(80.4)5.9850.01440(38.1)32(34.8)0.2300.621淋巴结转移 有 无1108799(90.0)55(63.2)20.4200.00088(80.0)54(62.1)7.7610.005 35(31.8)37(42.5)2.4030.121肿瘤分期 Ⅰ~Ⅱ Ⅲ~Ⅳ1346399(73.9)55(87.3)4.5240.03390(67.2)52(82.5)5.0340.025 56(41.8)16(25.4)4.9670.026
2.3 PTC组织中TSHR、ER和AR表达相关性分析 Spearman相关分析结果显示,ER与TSHR在PTC组织中的蛋白表达水平呈正相关(rs=0.575,P<0.05);ER与AR、AR与TSHR在PTC组织中的蛋白表达水平呈负相关(rs=-0.160,P<0.05;rs=-0.186,P<0.05),但相关性较弱。见表3。
表3 PTC组织中ER与TSHR、ER与AR、AR与TSHR表达的相关分析
Table 3 Correlation analysis between ER and TSHR,ER and AR,AR and TSHR expression in PTC tissues (n=197,例数,%)
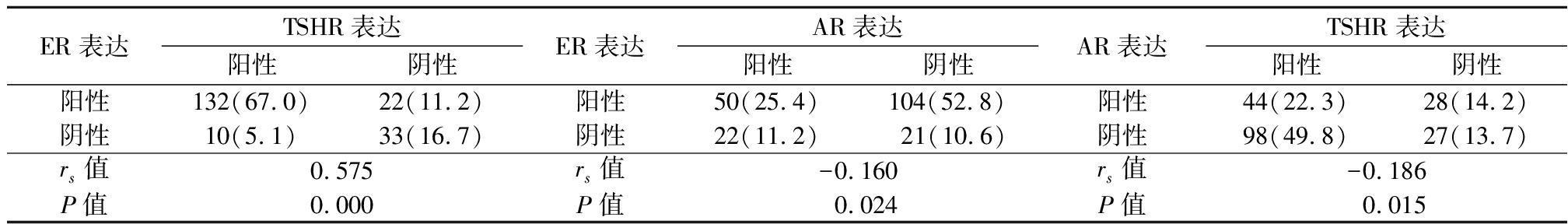
ER表达TSHR表达阳性阴性ER表达AR表达阳性阴性AR表达TSHR表达阳性阴性阳性132(67.0)22(11.2)阳性50(25.4)104(52.8)阳性44(22.3)28(14.2)阴性10(5.1)33(16.7)阴性22(11.2)21(10.6)阴性98(49.8)27(13.7)rs值0.575rs值-0.160rs值-0.186P值0.000P值0.024P值 0.015
3 讨 论
流行病学研究发现,PTC患者中女性甲状腺癌发病高于男性,约是男性的3倍[3]。本研究PTC患者中女性145例,男性52例,女性是男性的2.8倍。10岁以后女性的发生率明显增加,提示性激素可能在PTC的发病机制中扮演着重要的角色。促甲状腺激素是脑垂体分泌的与甲状腺相关的激素,其靶器官是甲状腺,雌激素作用于垂体,促使垂体释放促甲状腺激素[4]。本研究结果显示,AR在PTC和癌旁正常组织的表达低于甲状腺良性肿瘤组织中的表达,其中AR在PTC中的表达率仅为36.5%,而在良性甲状腺肿瘤组织中表达率高达70.0%,表明AR在PTC的致病机制中可能是一种保护因素,与AR在乳腺癌中的研究结论相一致[5];而ER和TSHR在PTC和癌旁正常组织的表达高于甲状腺良性肿瘤组织中的表达,其中ER在PTC中的表达率高达78.2%,表明二者均参与了PTC的发病机制。并且可以进一步推测,ER和TSHR是参与PTC多灶发病的分子基础之一,否则,PTC癌旁组织不应当与PTC一样,出现ER和TSHR二者的高表达,这同时也可以为临床上PTC需要行甲状腺全切除的患者提供依据。
ER的研究结果并不完全一致。Mak等[6]研究发现HIF-1通过与ER作用,上调ER的表达,抑制肿瘤凋亡,使甲状腺细胞转化为肿瘤细胞,促进肿瘤进展。体外动物和细胞实验也证实,雌激素及其代谢物可促进甲状腺癌细胞的增殖和生长,与甲状腺癌的发生发展有密切关系[7-8]。而一项在89例女性PTC患者中进行的研究,发现 ERβ具有肿瘤的抑制效应[9]。本研究提示:一方面,在肿瘤比较大、淋巴结有转移、晚期PTC中,ER与这些预后不良因素相关,出现高表达(P<0.05);另外一方面,ER在PTC的表达与性别、年龄均有关系,育龄期女性甲状腺癌的发病率较青春期明显增加,绝经后开始下降,这与体内雌激素分泌的年龄分布曲线一致[10]。年龄<45岁以及女性PTC患者ER高表达,ER又表现出与预后良好的因素相关,说明雌激素及其受体在甲状腺癌的发病机制和病程进展中的作用较为复杂,可能与同一种受体的不同亚型在体内发挥不同甚至是相反的作用有关系,有待于研究的进一步深入和细化。
Nieto 等[11]认为TSHR蛋白高表达与PTC发生有关,与肿瘤恶性发展程度、是否有淋巴结转移无关,可能是甲状腺癌发生的一个早期标志,且PTC组织中TSHR表达明显高于结节性甲状腺肿和正常甲状腺组织。但也有研究认为,在PTC早期已存在TSHR基因甲基化,且存在于整个甲状腺癌的演进进程中。在PTC中晚期TSHR表达高于早期,其表达的程度也与是否有淋巴结转移相关[12]。本研究结果显示,有淋巴结转移及Ⅲ~Ⅳ期的PTC,其TSHR蛋白表达高于无淋巴结转移及Ⅰ~Ⅱ期者。与后者研究结果一致。另外,雌激素与促甲状腺激素同属于下丘脑-腺垂体的不同轴系统。本研究结果显示,ER与TSHR的表达具有相关性(rs=0.575,P<0.05)。说明PTC的致病机制可能存在着不同的分子途径,而这些分子途径之间可以相互协同、互相促进。
AR可通过MAPK-ER/PR信号通路参与乳腺的发育,并调节乳腺癌细胞的增殖。但AR在PTC中的作用,并没有确定性的报道。有研究发现,在PTC中可能存在着与乳腺癌类似的AR途径,即对乳腺癌ER阳性的MCF-7和ER阴性的MDA-MB453乳腺癌细胞均有抑制作用[13]。本研究中AR在PTC与癌旁组织的表达低于甲状腺良性组织(P<0.05),说明AR可能是一个保护性的因素;临床分期Ⅰ、Ⅱ期患者AR表达明显高于Ⅲ、Ⅳ期患者(P<0.05),也可以认为AR高表达的PCT预后相对比较良好。本研究AR在男性PTC患者中表达率为21.2%,低于女性的42.1%(P<0.05),说明男性PTC的预后较差;但AR表达与淋巴结转移、肿瘤的大小及包膜浸润等单一因素没有明显的关系(P>0.05),同时AR与ER及TSHR的相关性并不大(rs=-0.160、-0.186,P<0.05),说明AR在PTC的致癌保护机制中,可能对致癌的信号通路中处于上游的激活机制产生抑制作用,最终引起一系列综合性的细胞应答。
[1] 高明,郑向前.甲状腺癌过去与未来十年[J].中国肿瘤临床,2018,45(1):1-6.
[2] 茹晓婷,刘勤江,杨荣.NIS和TSHR在分化型甲状腺癌中的表达及其与BRAF V600E突变的关系研究[J].临床肿瘤学杂志,2017,22(2):128-132.
[3] 杨雷,王宁.甲状腺癌流行病学研究进展[J].中华预防医学杂志,2014,48(8):744-748.
[4] 张焕西.ER、PR与甲状腺癌关系的研究进展[J].河北医科大学学报,2013,34(7):862-864.
[5] 雷雨,马钰.雄激素受体在三阴性乳腺癌患者中的表达及其对临床结局的影响[J].中国综合临床,2016,32(5):440-443.
[6] Mak P,Li J,Samanta S,et al. ERβ regulation of NF-kB activation in prostate cancer is mediated by HIF-1[J]. Oncotarget,2015,6(37):40247-40254.
[7] Jalali-Nadoushan MR,Amirtouri R,Davati A,et al. Expression of estrogen and progesterone receptors in papillary thyroid carcinoma[J]. Caspian J Intern Med,2016,7(3):183-187.
[8] 李兴佳,徐书杭,刘超.雌激素及其受体与甲状腺癌的关系[J].国际内分泌代谢杂志,2016,36(4):273-276.
[9] Huang Y,Dong W,Li J,et al. Differential expression patterns and clinical significance of estrogen receptor-α and β in papillary thyroid carcinoma[J]. BMC Cancer,2014,14:383.
[10] 王畏,钱军.雌激素与甲状腺癌[J].现代肿瘤医学,2016,24(21):3499-3501.
[11] Nieto H,Boelaert K.WOMEN IN CANCER THEMATIC REVIEW:thyroid-stimulating hormone in thyroid cancer: does it matter?[J]. Endocr Relat Cancer,2016,23(11):T109-121.
[12] Zheng H,Wang M,Jiang L,et al. BRAF-activated long noncoding rna modulates papillary thyroid carcinoma cell proliferation through regulating thyroid stimulating hormone receptor[J]. Cancer Res Treat,2016,48(2):698-707.
[13] Malinen M,Toropainen S,Jääskeläinen T,et al. Androgen receptor-and PIAS1-regulated gene programs in molecular apocrine breast cancer cells[J]. Mol Cell Endocrinol, 2015,414:91-98.