体外受精-胚胎移植(in vitro fertilization-embryo transfer,IVF-ET)目前已广泛用于不孕不育治疗,同时临床用药及体外受精(in vitro fertilization,IVF)、培养技术的不断改进和发展也最终使临床妊娠率得到逐步提升。但目前使用最为普遍的常规IVF受精方式,仍可能发生受精障碍,特别当患者无受精卵可用时,不仅精神上不能接受,还伴随很大的经济损失。一般认为,与受精失败或受精率低有关的因素有精子、卵子的质量,精卵结合过程及体外培养的环境等。精卵结合的分子机制异常复杂,影响受精过程的因素很多,但预测受精失败较明确的、简单的方法目前尚未发现。本研究收集首次行常规IVF后发生受精障碍患者的临床资料,分析可能与精卵结合障碍或受精率低有关的患者因素,旨在进一步提高IVF时的受精率、卵子利用率、胚胎利用率等。
1 资料与方法
1.1 一般资料 选择2015年5月—12月在河北医科大学第二医院生殖医学科行首次IVF-ET治疗的2 046个周期进行回顾性分析,且授精方式为常规IVF。其中完全受精失败组(A组)共56周期,受精率为0;低受精组(B组)共91周期,受精率<30%;对照组(C组)共1 899周期,受精率≥30%。同期行短时IVF受精+早补救卵胞浆内单精子显微注射(intracytoplasmic sperm injection,ICSI)周期,及部分ICSI周期,常规IVF授精后根据其卵母细胞受精率情况,分别纳入A组、B组和C组。
1.2 卵巢刺激方法长方案 卵巢刺激前的黄体中期,开始使用促性腺激素释放激素激动剂(gonadotropin-releasing hormone agonist,GnRHa)0.05~0.1 mg,每日皮下注射,降调达标后注射促性腺激素(gonadotropin,Gn)150~300 U/d,对于月经不规则者采用双压方案。短方案:月经周期第2天使用GnRHa 0.05~0.1 mg/d,月经周期第3~4天注射Gn 150~300 U/d。拮抗剂方案:月经周期第2~3天开始注射Gn 150~300 U/d,加用促性腺激素释放激素拮抗剂的标准为最大卵泡直径在14 mm以上,或者平均直径达到11~13 mm卵泡数目在6个以上,或血清激素雌二醇(estradiol,E2)水平达到400 ng/L。卵巢刺激过程中需定期监测卵泡大小、数目及生长情况,并定期检测血清激素水平,包括促黄体生成素(luteinizing hormone,LH)、E2、孕酮(progesterone,P)。根据卵泡发育情况及血清激素水平达到扳机条件时,注射人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)5 000~10 000 U,或依据不同方案选择扳机药物,阴道超声引导下取卵术在扳机后34~36 h进行。显微镜下从抽吸出的卵泡液中捡出卵冠丘复合体,并尽快放入6%CO2培养箱进行预培养。记录患者的一般资料,如女方年龄、不孕年限、不孕因素、基础激素水平、促排方案、使用Gn的天数和总量,以及HCG注射日LH、E2、P、每卵子E2水平等。
1.3 精液处理及常规IVF授精方法 常规处理取出后的精液,根据精液质量选择精液处理方式,并记录处理前后精子浓度、活动率、前向运动精子比例等。取卵后卵母细胞经预培养3~4 h后行授精,授精精子浓度为1×106个/ mL,精卵共孵育5 h,将卵母细胞直接移入新的培养液中过夜。对于怀疑有受精障碍患者,卵子脱颗粒后移入新的培养液中,观察卵子有无第二极体的排出,当两个极体的卵子占成熟卵子比例<1/3时,延后1 h观察,若两个极体的卵子占成熟卵子比例仍<1/3时,则认为可能存在受精障碍。在患者知情同意后,可以行早期补救ICSI。部分ICSI指将卵母细胞分为两部分,一部分行常规IVF授精,另一部分卵母细胞脱颗粒,培养1 h后行常规ICSI。
1.4 原核的评估 授精后次日晨,于倒置显微镜下观察卵子受精情况,即是否出现原核及原核数目,见到原核判断为受精,观察卵子成熟程度、卵子形态是否正常,并记录获卵数目、成熟卵所占比例,不正常卵子所占比例。成熟卵比例=成熟卵母细胞数目/获卵数目×100%,不正常卵子比例=不正常卵子数目/获卵数目×100%。
1.5 统计学方法 应用SPSS 13.0统计软件分析数据。计量资料比较分别采用F检验、SNK-q检验和配对t检验;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 3组年龄、不孕年限和激素水平比较 A组、B组不孕年限均大于C组,差异有统计学意义(P<0.05);3组间年龄、基础激素FSH、LH、E2水平差异均无统计学意义(P>0.05)。见表 1。
表1 3组年龄、不孕年限和激素水平比较
Table 1 Comparison of age infertility duration and hormone level among three groups ![]()
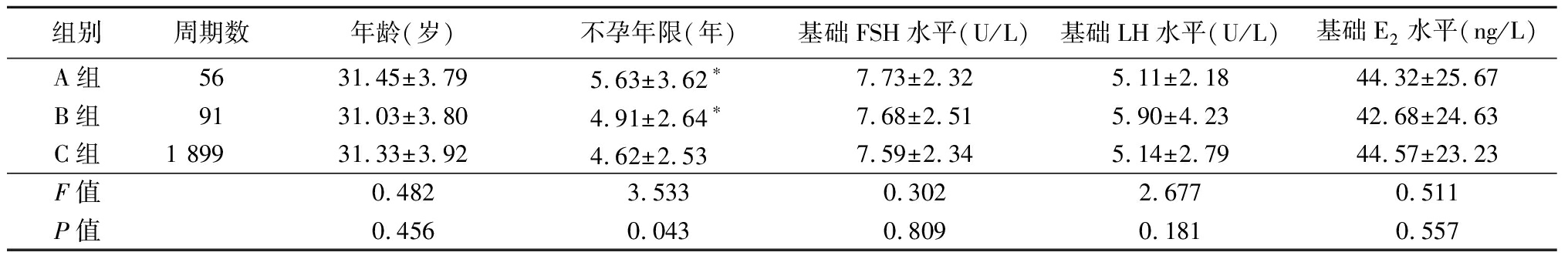
组别周期数年龄(岁)不孕年限(年)基础FSH水平(U/L)基础LH水平(U/L)基础E2水平(ng/L)A组5631.45±3.795.63±3.62∗7.73±2.325.11±2.1844.32±25.67B组9131.03±3.804.91±2.64∗7.68±2.515.90±4.2342.68±24.63C组1 89931.33±3.924.62±2.53 7.59±2.345.14±2.7944.57±23.23F值0.4823.5330.3022.6770.511P值0.4560.0430.8090.1810.557
*P值<0.05与C组比较(SNK-q检验)
2.2 3组不孕原因比较 A组、B组原发不孕比例、男方因素、不明原因不孕比例均高于C组,差异有统计学意义(P<0.05);A组、B组输卵管因素比例均低于C组,差异有统计学意义(P<0.05);3组间子宫内膜异位症、排卵障碍、其他原因不孕差异均无统计学意义(P>0.05)。见表2。
表2 各组不孕原因比较
Table 2 Comparison of the reasons for infertility among groups (周期数,%)
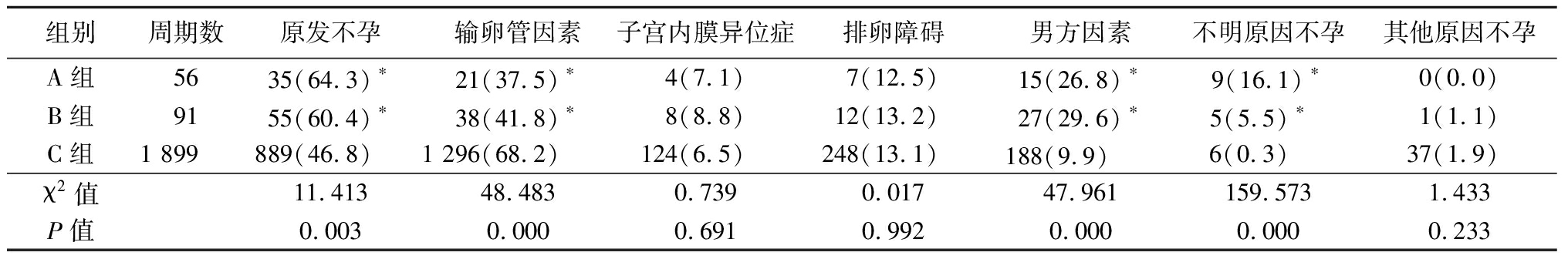
组别周期数原发不孕输卵管因素子宫内膜异位症排卵障碍男方因素不明原因不孕其他原因不孕A组5635(64.3)∗21(37.5)∗4(7.1)7(12.5)15(26.8)∗9(16.1)∗0(0.0)B组9155(60.4)∗38(41.8)∗8(8.8)12(13.2)27(29.6)∗5(5.5)∗ 1(1.1)C组1 899889(46.8)1 296(68.2)124(6.5)248(13.1)188(9.9) 6(0.3) 37(1.9)χ2值11.41348.4830.7390.01747.961159.5731.433P值0.0030.0000.6910.9920.0000.0000.233
*P值<0.05与C组比较(χ2检验)
2.3 各组应用Gn 天数、Gn 用量和HCG注射日激素水平及获卵数目比较 A组、B组、C 组应用Gn 天数、Gn 用量以及HCG注射日LH、E2、P和每卵E2水平差异均无统计学意义(P>0.05);A组、B组和C组获卵数目比较,差异有统计学意义(P<0.05),A组获卵数少于C和B组,差异均有统计学意义(P<0.05)。见表3。
表3 3组注射HCG日激素水平及获卵数比较
Table 3 Comparison of hormone levels in HCG injection day and the number of eggs among three groups ![]()
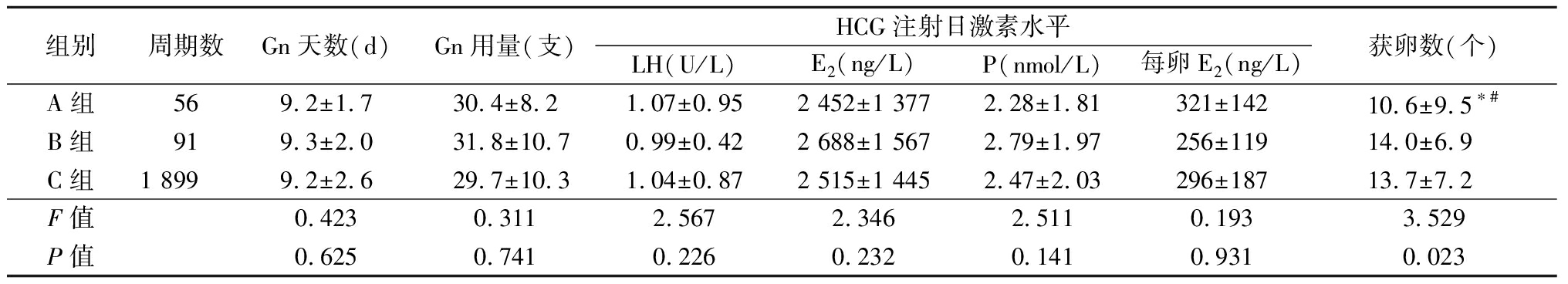
组别周期数Gn天数(d)Gn用量(支)HCG注射日激素水平LH(U/L)E2(ng/L)P(nmol/L)每卵E2(ng/L)获卵数(个)A组569.2±1.730.4±8.21.07±0.952 452±1 3772.28±1.81321±14210.6±9.5∗#B组919.3±2.031.8±10.70.99±0.422 688±1 5672.79±1.97256±11914.0±6.9C组1 8999.2±2.629.7±10.31.04±0.872 515±1 4452.47±2.03296±18713.7±7.2F值0.4230.3112.5672.3462.5110.1933.529P值0.6250.7410.2260.2320.1410.9310.023
*P值<0.05与C组比较 #P值<0.05与B组比较(SNK-q检验)
2.4 3组治疗方案和获得卵子数比较 A组、B组、C组治疗方案,包括长方案、短方案和拮抗剂方案,差异均无统计学意义(P>0.05);3组成熟卵子和不正常卵子比例比较,A组、B组成熟卵子比例低于C组,且A组低于B组,A组、B组不正常卵子比例高于C组,且A组高于B组,差异均有统计学意义(P<0.05);获卵数1~4枚的比例,A组高于B组和C组,差异均有统计学意义(P<0.05)。见表4。
表4 3组治疗方案和获得卵子数比较
Table 4 Comparison of treatment options and laboratory data among three groups (周期数,%)
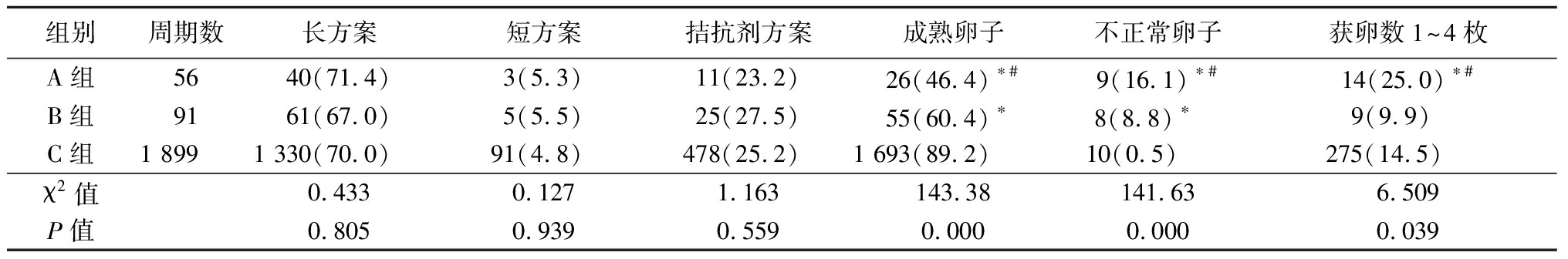
组别周期数长方案 短方案 拮抗剂方案 成熟卵子不正常卵子获卵数1~4枚A组5640(71.4)3(5.3)11(23.2)26(46.4)∗#9(16.1)∗#14(25.0)∗#B组9161(67.0)5(5.5)25(27.5)55(60.4)∗8(8.8)∗ 9(9.9) C组1 8991 330(70.0)91(4.8)478(25.2)1 693(89.2)10(0.5) 275(14.5) χ2值0.4330.1271.163143.38141.636.509P值0.8050.9390.5590.0000.0000.039
*P值<0.05与C组比较 #P值<0.05与B组比较(χ2 检验)
2.5 3组处理前后精液参数的比较 处理前精子浓度A组、B组低于C组,差异均有统计学意义(P<0.05);A组处理前精子活动率、前向运动精子比例、前向运动中A级精子比例低于C组,且A组低于B组,差异均有统计学意义(P<0.05)。处理后3组精子浓度、精子活动率差异均无统计学意义(P>0.05);处理后前向运动精子比例、前向运动中A级精子比例, A组、B组低于C组,差异均有统计学意义(P<0.05)。见表5。
表5 3组处理前后精液参数比较
Table 5 Comparison of sperm parameters before and after processing among three groups ![]()
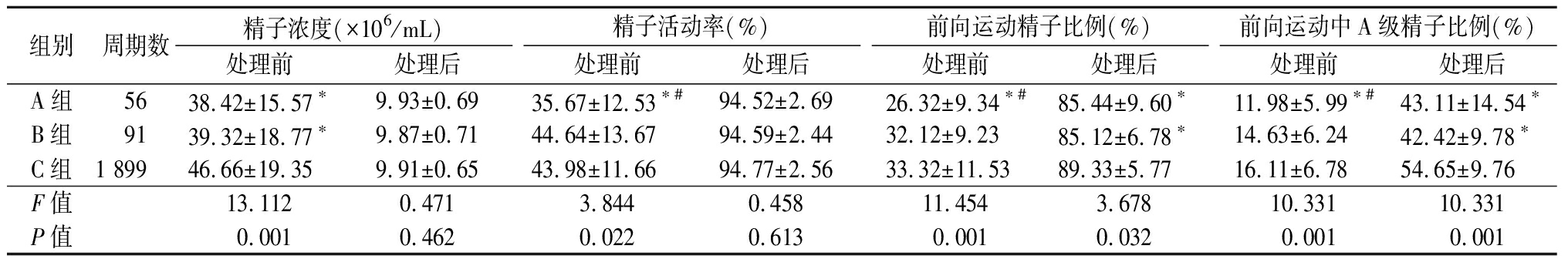
组别周期数精子浓度(×106/mL)处理前处理后精子活动率(%)处理前处理后前向运动精子比例(%)处理前处理后前向运动中A级精子比例(%)处理前处理后A组5638.42±15.57∗9.93±0.6935.67±12.53∗#94.52±2.6926.32±9.34∗#85.44±9.60∗11.98±5.99∗#43.11±14.54∗B组9139.32±18.77∗9.87±0.7144.64±13.6794.59±2.4432.12±9.2385.12±6.78∗14.63±6.2442.42±9.78∗C组1 89946.66±19.359.91±0.6543.98±11.6694.77±2.5633.32±11.5389.33±5.7716.11±6.7854.65±9.76F值13.1120.4713.8440.45811.4543.67810.33110.331P值0.0010.4620.0220.6130.0010.0320.0010.001
*P值<0.05与C组比较 #P值<0.05与B组比较(SNK-q检验)
3 讨 论
3.1 受精失败的发生 虽然IVF技术日益完善,但IVF完全受精失败或低受精率仍不可避免。据文献报道,在常规IVF中,发生低受精(包括完全受精失败)的比率为3%~5%[1-2]。本研究常规IVF完全受精失败率为2.73%(56/2046),低受精率为4.44%(91/2046)。低受精乃至完全受精失败发生的原因可能与低质量的精子、卵子有密切关系,但也可能与精卵结合过程、精卵体外操作培养等相关。
常规IVF发生卵母细胞受精失败与ICSI发生卵母细胞受精失败的原因是不同的。对常规IVF受精周期的未受精卵进行免疫荧光染色分析发现,未受精卵中,56%~92%存在卵子自身的染色体,但不存在精子的染色质。因此,常规IVF受精失败可能的重要原因是精子未能与透明带结合,或是精子未能穿过透明带进入卵子内[3],其发生的比例要高于卵母细胞激活失败[2]。
3.2 一般临床资料与受精失败 女方年龄可能影响卵母细胞的质量,年龄越大,卵子发生染色体不分离或非整倍体概率越大,卵母细胞质量随之下降,进而影响体外受精率[4]。研究发现,在不孕原因为非男性因素时,行常规IVF受精发生受精失败的患者,往往表现为女方高龄及较少的获卵数目,而且卵母细胞的质量影响着卵母细胞能否正常受精[5]。但本研究A、B、C组年龄及基础激素差异无统计学意义。可能与本研究为回顾性分析,引起卵母细胞质量低下、低受精的发生乃至完全受精失败原因非常复杂,不仅涉及精卵质量的原因,而且还受到有些不能预计因素的影响有关。
研究表明,IVF-ET助孕时存在不明原因不孕、或伴有轻中度男方少弱畸精症的患者可能存在受精失败的风险[6]。赵芳等[7]研究也表明,不明原因不育患者最易出现IVF全卵不受精,其次为IVF低受精。那些长期不能自然妊娠而又查不到不孕原因的不孕夫妇,可能存在精卵结合障碍所表现出的受精失败及低受精率。精子结合卵子的功能障碍,或卵子精子结合障碍的免疫因素等导致的精卵结合障碍,用目前检测方法还不能确诊,在临床上表现为不明原因。Liu等[8]对不明原因不育的男性患者的研究发现,虽然他们常规精液分析结果正常,但有41%的患者存在精子与透明带结合不正常,或是透明带功能不正常,不能诱发精子发生顶体反应。此类患者进行常规IVF受精,表现为受精率很低,而改行ICSI时,可显著改善受精率。本研究A、B、C组间不孕年限差异有统计学意义,A组和B组不孕年限显著高于C组; 3组原发不孕和继发不孕比例差异有统计学意义,A组和B组原发不孕比例显著高于C组;不孕原因中,输卵管因素A组和B组比例显著低于C组,而男性因素及不明原因不孕A组和B组比例均高于C组。因此,存在较长的不孕年限、存在男方不育因素、原发性不孕,特别是存在不明原因不孕的患者,行常规IVF时可能更容易发生受精障碍导致的受精失败或低受精率。
3.3 卵子因素与受精失败 IVF助孕时卵母细胞是受精发生的最关键因素之一,其数量和质量的变化均会影响受精。对常规IVF周期中低受精(受精率≤25%)的患者进行回顾性分析,发现卵母细胞的成熟程度与与卵子受精能力关系密切,卵母细胞成熟度差,是发生常规IVF受精失败的一个重要原因[9]。本研究结果显示,完全受精失败组获卵1~4个的比例较高,受精失败及低受精率患者成熟卵比例均显著低于受精正常组,A组、B组和C组成熟卵比例逐渐升高,且组间差异有统计学意义。由于获卵数目偏少,并且可能存在影响卵子质量的潜在因素,造成受精障碍发生的风险较高,故卵母细胞成熟程度较差和卵母细胞数量不足是受精失败的主要原因。通常可以用特征性皮质颗粒的分布特点对卵母细胞细胞质的成熟程度进行评价,因而对未受精的卵母细胞进行免疫荧光分析发现,卵母细胞胞质成熟度差,正常受精的卵母细胞比例就低。受精障碍导致的受精失败或低受精,可能与卵母细胞胞质中线粒体、纺锤体、皮质颗粒等有关,表现为较低的线粒体DNA拷贝数、异常结构的纺锤体、异常数量和排列的皮质颗粒、卵母细胞胞浆内异常的Ca2+震荡方式等。尽管精子可以进入卵母细胞内,但对于卵母细胞胞浆不成熟者,精子表现为染色体凝集,影响受精[2]。
受精是否受卵子形态的影响,还存在争议。有学者认为,卵子外观的异常表现为胞浆粗颗粒状,存在细胞胞浆内物质如空泡、折光小体、黑色颗粒状物等,虽然最终表现为种植率显著下降,但受精率并未受到影响[10]。但对未能受精的卵母细胞进行电镜观察发现,形态异常的卵母细胞与受精障碍密切相关。而在常规IVF后48 h,未受精的卵母细胞透明带比受精的卵母细胞明显增厚,透明带异常增厚则可能引起精子穿透卵子的障碍[11]。本研究结果显示,A、B、C组不正常卵子率分别为16.1%(9/56)、8.8%(8/91)、0.5%(10/1 899)。表明受精异常与卵子的非正常形态有关。
3.4 精子因素与受精失败 精子因素可能为受精失败主要原因,边缘临界性精液参数异常易致受精失败或受精率低下。对常规IVF受精低下患者精液参数的研究发现,处理后授精前,与其他组相比较,前向运动精子的总数低于5×106时,其受精率极显著降低[12]。邓唐等[13]研究结果提示弱精子症(前向运动精子百分率<32%)患者行常规IVF助孕时,受精失败的风险增加。本研究A、B、C组处理前精子浓度,A、B组均低于C组,处理前精子活动率、前向运动精子比例、前向运动中A级精子比例, A组低于C、B组; A、B、C组处理后前向运动精子比例、前向运动种A级精子比例,A、B组均低于C组。表明与精子运动相关的参数明显降低和受精失败或低受精有关,精子质量的下降可能是导致受精障碍的一个重要因素。精卵结合及融合障碍的因素,如精子顶体功能或诱发顶体反应功能缺陷,精子与卵子透明带结合障碍,造成精子难以与透明带结合并穿透。
研究发现,完全受精失败中约70%的原因为精子与卵子未能有效结合,而其中未受精的卵母细胞有42%未见精子穿过透明带进入卵子内[8]。但目前的精液常规分析存在很大的局限性,很难预测精子的体内外受精能力,也就很难对受精障碍进行精确诊断。精子顶体酶活性异常可能与精液常规分析中主要参数的异常有相关性,精子顶体酶活性可能是判断精子能否具有穿透透明带能力的重要指标之一,其活性下降可导致常规IVF受精率显著降低[14],但目前顶体酶活性检测方法及判断标准还存在很大的局限性。马兰等[15]研究提示,生殖源性血管紧张素Ⅰ转换酶的表达水平与受精率具有相关性,精子中其缺乏可能会导致受精率降低。因此,虽然精液质量如何导致受精障碍的原因还没有明确,但较差的精液质量或与低下的精子功能与受精障碍的发生有关。
[1] 刘平,郑晓英.体外受精失败的原因及对策[J].中国实用妇科与产科杂志,2010,26(10):758-761.
[2] Yu M,Zhao H,Chen T,et al. Mutational analysis of IZUMO1R in women with fertilization failure and polyspermy after in vitro fertilization[J]. J Assist Reprod Genet,2018,35(3):539-544.
[3] 宋成,曾勇,万才云,等.正常形态精子百分率对IVF临床结局的影响[J].中国优生与遗传杂志,2013,21(7):119-121,123.
[4] Zuckerman S,Zeevi DA,Gooldin S,et al. Acceptable applications of preimplantation genetic diagnosis(PGD) among Israeli PGD users[J]. Eur J Hum Genet,2017,25(10):1113-1117.
[5] Braga DP,Setti AS,Figueira Rde C,et al. Contributing factors for the incidence of aneuploidy in older patients undergoing intracytoplasmic sperm injection cycles[J]. J Assist Reprod Genet,2012,29(9):911-916.
[6] 王娜,李澎涛,邢鹏,等.短时受精失败或低受精率周期不同受精来源卵母细胞发育潜能比较[J].河北医科大学学报,2017,38(12):1464-1467.
[7] 赵芳,吕玉珍,王娟,等.常规IVF完全/部分受精失败后行早期补救ICSI的应用价值[J].生殖医学杂志,2015,24(2):87-92.
[8] Liu DY,Liu ML,Baker HW. Defective protein kinase A and C pathways are common causes of disordered zona pellucida(ZP)--induced acrosome reaction in normozoospermic infertile men with normal sperm-ZP binding[J]. Fertil Steril,2013,99(1):86-91.
[9] 宋岳强,沙艳伟,丁露,等.影响常规IVF体外受精的相关因素探讨[J].中国妇幼保健杂志,2014,29(22):3619-3622.
[10] van Beirs N,Shaw-Jackson C,Rozenberg S,et al. Policy of IVF centres towards oocytes affected by smooth endoplasmic reticulum aggregates: a multicentre survey study[J]. J Assist Reprod Genet,2015,32(6):945-950.
[11] 郝大勇,杨晓娜,刘景,等.人卵母细胞胞浆形态与卵胞浆内单精子显微注射受精率与胚胎质量的关系[J].中国优生与遗传杂志,2016,24(7):108-109.
[12] 李征,陈美佳,钟惠芝,等.不同精液参数对体外受精结局的影响及预测价值[J].广西医学,2017,39(6):885-887.
[13] 邓唐,李尚为.部分卵母细胞胞浆内单精子注射周期中影响其常规体外受精受精率的相关因素分析[J/CD].中华妇幼临床医学杂志:电子版,2016,12(5):530-534.
[14] 廖宏庆,聂玉林,赵魁,等.精子形态对体外受精结局的影响[J].中国男科学杂志,2015,29(8):44-47.
[15] 马兰,刘洋,镡颖,等.精子因素对体外受精-胚胎移植术中受精率的影响[J].实用医学杂志,2016,32(8):1271-1274.