放疗具有较高安全性,可明显提高患者生存质量,是宫颈癌的重要治疗手段。但放疗抵抗使得部分患者的放疗效果不佳,同时还需要忍受放疗引起的不良反应。故评估放疗的可行性与有效性成为当前的研究热点。研究证实,细胞间黏附分子3(intercellular cell adhesion molecule-3,ICAM-3)与肿瘤的增殖、浸润有较大关联,且ICAM-3高表达的SiHa细胞经放射线照射后细胞寿命反而提高约30%[1],推测可能与放射抵抗有关,但相关研究较为缺乏。缺氧诱导因子1(hypoxia inducible factor-1,HIF-1)是目前为止发现的唯一一个在低氧状态下具有活性的转录因子,其可在缺氧条件下使细胞、组织发生一系列适应性反应以维持供氧平衡,已被证实参与多种肿瘤的恶性转化及肿瘤进展[2]。本研究分析58例高原地区宫颈鳞癌患者ICAM-3、HIF-1蛋白表达水平与高原女性宫颈癌放疗抵抗的关联,旨在为高原地区宫颈癌患者放疗敏感性预测指标的选择及个体化治疗方案的制定提供指导,现报告如下。
1 资料与方法
1.1 一般资料 选择2015年7月—2017年7月青海大学附属医院收治的高原地区宫颈鳞癌患者60例。纳入标准:①患者均于放疗前经过活组织检查取得宫颈鳞癌组织,取材前未进行过手术、化疗治疗;②经病理检查确定组织分化程度;③国际产妇科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期为Ⅱb、Ⅲa、Ⅲb期;④均采取根治性放疗及同步化疗(以铂类为基础的化疗方案);⑤均获得患者或家属知情同意;⑥临床资料完善。排除标准:①治疗过程中出现严重并发症无法继续治疗者;②中途自愿放弃治疗者。治疗过程中有1例出现严重不良反应无法耐受治疗而退出,1例失访,最终58例患者入选。年龄44~69岁,平均(53.1±6.9)岁; FIGO分期:Ⅱb期13例、Ⅲa期18例、Ⅲb期27例;组织学分级:低分化14例、中分化20例、高分化24例;影像学提示:淋巴结阳性25例、阴性33例。
1.2 方法 患者确诊后均给予根治性放疗及同步化疗,治疗前、治疗中、治疗后3个月均行妇科检查、CT或MRI检查,治疗结束后定期门诊复查,记录瘤体变化。
1.2.1 放疗 应用直线加速器外照射全盆腔,总量DT50 Gy,25次,5周。DT25~50 Gy时中线遮挡4 cm;3周时高剂量率内照射(铱-192),DT7 Gy/次,1次/周。5~7周A点剂量:内照射2/3,外照射1/3;B点剂量:内照射1/3,外照射2/3。放射治疗前,经宫颈取材进行SP法免疫组织化学分析,由医师阅片核实诊断。
1.2.2 同步化疗 顺铂每周30 mg/m2,4~6周。
1.2.3 组织标本的免疫组织化学方法 将所得组织蜡块每个标本连续切片6张,厚度4 μm,置于600 ℃烤箱中烘干。石蜡切片脱蜡脱水,洗涤,抗原修复,染色,树胶封片。由2位经验丰富的病理科医师于标准显微镜下阅片。采用SP法检测,试剂盒购自福州迈新生物技术开发有限公司。
1.2.4 ICAM-3检测结果判定 根据光镜下观察结果,ICAM-3定位于细胞膜,阳性表现为棕黄色颗粒,采用半定量法进行判定。①染色数目评分:染色细胞占细胞总数的10%以下,计0分;10%~25%,计1分;26%~50%,计2分;51%~75%,计3分;75%以上,计4分。②染色强度评分:未染色,计0分;淡黄色,计1分;棕黄色,计2分;棕褐色,计3分。免疫染色评分=染色数目评分×染色强度评分。总分0分为阴性(-);1~4分为弱阳性(+);5~8分为阳性(++);9~12分为强阳性(+++)。++与+++视为阳性。
1.2.5 HIF-1检测结果判定 根据光镜下观察结果,HIF-1定位于细胞质,阳性表现为棕黄色颗粒。采用半定量法进行判定。①染色数目评分:染色细胞占细胞总数的1%以下,计0分;1%~10%,计1分;11%~50%,计2分;51%~80%,计3分;80%以上,计4分。②染色强度评分:未染色,计0分;淡黄色,计1分;棕黄色,计2分;棕褐色,计3分。染色数目评分+染色强度评分为最终评分,总分0~1分为阴性(-);2~3分为弱阳性(+);4~5分为阳性(++);6~7分为强阳性(+++)。++与+++视为阳性。
1.3 宫颈癌放疗敏感性判定 参照WHO实体瘤客观疗效标准[3]并结合病灶治疗前后的变化情况。①近期疗效:包括肿瘤未控与肿瘤消失,肿瘤未控指放疗结束后3个月内肿瘤持续存在或出现新病灶;肿瘤消失指放疗结束后3个月内肿瘤消失。②远期疗效:包括肿瘤复发与肿瘤治愈,肿瘤复发指放疗后肿瘤消失,但一段时间后(≥3个月)复查发现盆腔或远处出现肿瘤;肿瘤治愈指肿瘤消失未见复发(截至2018年8月)。将肿瘤未控与肿瘤复发定义为放疗抵抗,既未出现肿瘤未控也未出现肿瘤复发定义为放疗敏感。
1.4 统计学方法 应用SPSS 19.0统计软件分析数据。计数资料比较采用χ2检验;等级资料比较采用秩和检验;相关性采用Kendall′s tau-b相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 放疗近期疗效与远期随访结果 58例患者均顺利完成治疗且相关资料记录完善。其中8例肿瘤未控、50例肿瘤消失,50例肿瘤消失患者远期随访期间出现11例复发(放疗结束后11~27个月)。最终放疗敏感组39例、放疗抵抗组19例。
2.2 放疗敏感组与放疗抵抗组ICAM-3表达比较 2组ICAM-3表达分布差异有统计学意义(P<0.05);放疗敏感组ICAM-3阳性表达率低于放疗抵抗组,差异有统计学意义(P<0.05)。见表1。
表1 2组ICAM-3表达比较
Table 1 Comparison of ICAM-3 expression between two groups (例数,%)
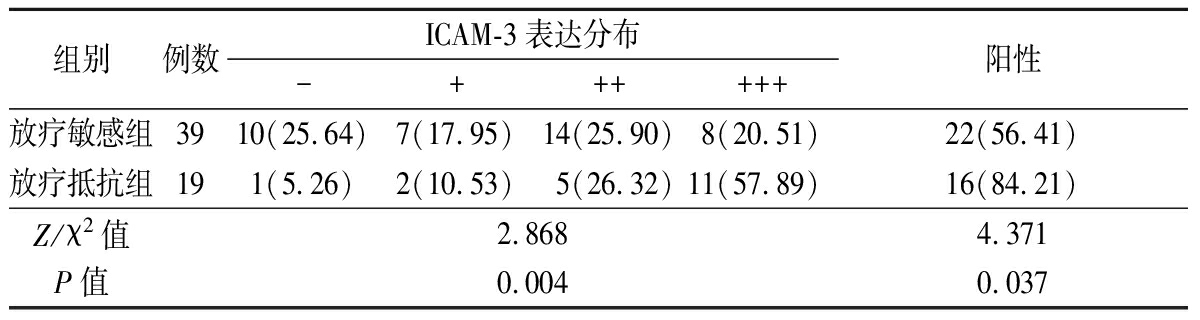
组别例数ICAM-3表达分布-++++++阳性放疗敏感组3910(25.64)7(17.95)14(25.90)8(20.51)22(56.41)放疗抵抗组191(5.26)2(10.53)5(26.32)11(57.89)16(84.21)Z/χ2值2.8684.371P值0.0040.037
2.3 放疗敏感组与放疗抵抗组HIF-1表达比较 2组HIF-1表达分布差异有统计学意义(P<0.05);放疗敏感组HIF-1阳性表达率低于放疗抵抗组,差异有统计学意义(P<0.05)。见表2。
表2 2组HIF-1表达比较
Table 2 Comparison of HIF-1 expression between two groups (例数,%)
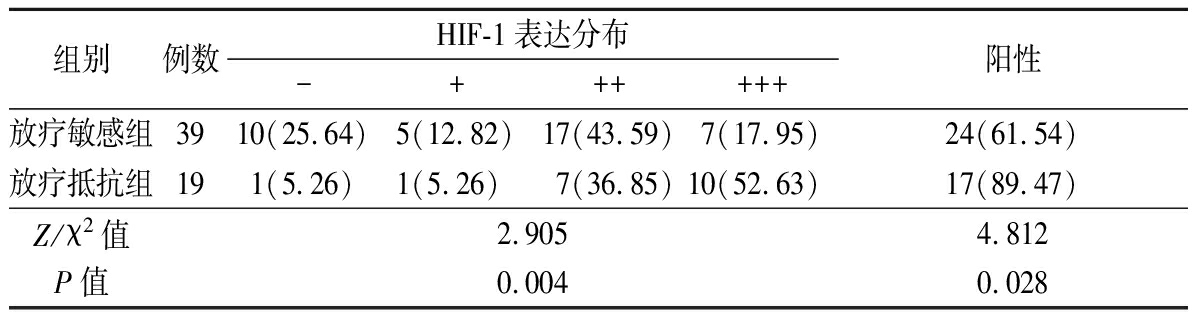
组别例数HIF-1表达分布-++++++阳性放疗敏感组3910(25.64)5(12.82)17(43.59)7(17.95)24(61.54)放疗抵抗组191(5.26)1(5.26) 7(36.85)10(52.63)17(89.47)Z/χ2值2.9054.812P值0.0040.028
2.4 ICAM-3、HIF-1阳性检出率比较 高分化患者ICAM-3、HIF-1阳性率高于低、中分化患者,淋巴结阳性患者ICAM-3、HIF-1阳性率高于淋巴结阴性患者,差异有统计学意义(P<0.05);不同临床分期患者ICAM-3与HIF-1阳性率差异无统计学意义(P>0.05)。见表3。
表3 不同临床分期、组织学分级和淋巴结转移患者ICAM-3、HIF-1阳性检出率比较
Table 3 Positive detection rate of ICAM-3 and HIF-1 in different clinical stages,histological grades and lymph node metastasis (例数,%)
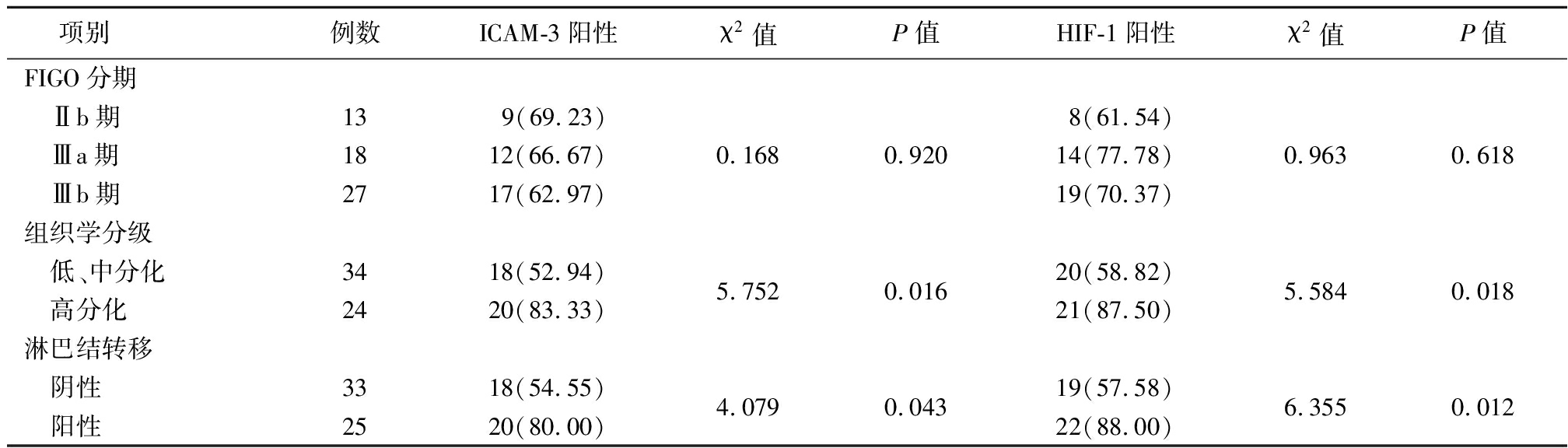
项别例数ICAM-3阳性χ2值P值HIF-1阳性χ2值P值FIGO分期 Ⅱb期139(69.23)8(61.54) Ⅲa期1812(66.67)0.1680.92014(77.78)0.9630.618 Ⅲb期2717(62.97)19(70.37)组织学分级 低、中分化 高分化342418(52.94)20(83.33)5.7520.01620(58.82)21(87.50)5.5840.018淋巴结转移 阴性 阳性332518(54.55)20(80.00)4.0790.04319(57.58)22(88.00)6.3550.012
2.5 ICAM-3、HIF-1表达与组织学分化及淋巴结转移的相关性分析 ICAM-3、HIF-1阳性赋值为1,阴性赋值为0,Kendall′s tau-b相关分析结果显示,ICAM-3表达与组织学分化(b=0.529,P=0.007)、淋巴结转移(b=0.510,P=0.012)呈正相关,组织学分级越高、淋巴结转移阳性的ICAM-3阳性表达风险越大;HIF-1表达与组织学分化(b=0.489,P=0.018)、淋巴结转移(b=0.535,P=0.003)呈正相关,组织学分级越高、淋巴结转移阳性的HIF-1阳性表达风险越大。
3 讨 论
宫颈癌为发展中国家女性死亡的主要原因之一,5年生存率约为55%[4]。放疗适用范围较广,可用于各期宫颈癌患者的治疗,在宫颈癌患者的临床治疗中占重要地位,但宫颈癌疗效并未随着放疗技术的改进、设备的升级而有大幅提高[5]。专家认为,这一现状的原因在于放疗抵抗[6]。因此,明确放疗抵抗的影响因素,在宫颈癌患者采取放疗前充分评估放疗的有效性,有利于进一步提高患者个体化治疗方案的科学性。
细胞间黏附分子指可调节细胞与细胞外基质及细胞间黏附作用的一列膜表面糖蛋白,其中ICAM-3被认为与放射抵抗有关[7]。本研究对宫颈癌患者放疗前的标本组织ICAM-3表达进行检测,发现放疗敏感组与放疗抵抗组ICAM-3表达分布存在差异,放疗敏感组ICAM-3阳性表达率显著低于放疗抵抗组。提示ICAM-3高表达会增加放疗抵抗风险。沙红兰等[8]研究证实,ICAM-3对放疗敏感性的影响可能是通过黏着斑激酶(focal adhesion kinase,FAK)信号途径发挥作用。研究证实,ICAM-3细胞中FAK磷酸化水平是对照组的2倍以上[9],提示ICAM-3表达会诱导FAK磷酸化并提高其活性,而FAK已被证实会抑制放疗后的细胞凋亡[10]。也有研究认为,ICAM-3可与淋巴细胞功能相关抗原1结合,从而调节二者之间的相互作用[11]。但详细机制尚不明确,有待于进一步探讨。
HIF-l调节的基因涉及细胞能量代谢、血管舒缩控制等,介导转录的基因有血管内皮生长因子、糖酵解酶基因等[12-13]。研究表明,HIF-l在肺癌、胃癌、宫颈癌等恶性肿瘤患者中均呈高表达,且与预后、病死率呈明显关联[14]。本研究对宫颈癌患者放疗前标本组织中的HIF-l表达进行检测,发现放疗敏感组与放疗抵抗组HIF-1表达分布存在差异,放疗敏感组HIF-1阳性表达率显著低于放疗抵抗组。表明HIF-1高表达会增加放疗抵抗风险,不利于放疗疗效与预后。目前认为,HIF-1可能通过抑制细胞凋亡、调控DNA修复过程的相关因子表达、降低电离辐射对肿瘤细胞DNA损伤等多种途径降低放疗敏感性[15]。
目前有关HIF-1、ICAM-3表达与肿瘤临床分期、分化程度等的相关性报道不一。王芳等[16]的研究证实,HIF表达与临床分期有关,Ⅲa期患者HIF-l表达高于Ⅱb期患者。本研究结果显示,不同肿瘤临床分期患者间HIF-1、ICAM-3表达差异无统计学意义,推测与本研究中FIGO分期的亚项(Ⅱb期、Ⅲa期、Ⅲb期)的样本量不足有关,有待进一步证实;但HIF-1、ICAM-3表达与组织学分级、淋巴结转移呈正相关,高分化患者与淋巴结转移阳性患者ICAM-3与HIF-1阳性率均相对更高,证实ICAM-3、HIF-1表达不仅与放疗敏感性有关,与肿瘤进展也有较大关系,与宋妮娜等[17]的结论一致。赵小玲等[18]的研究显示,抗凋亡基因、p53基因等与宫颈癌放疗敏感性有较大关联,可作为后续研究的主要方向,进一步完善可预测放疗敏感性,为高原地区宫颈癌患者放疗效果预测提供更全面的参考信息。
综上所述,ICAM-3、HIF-1蛋白高表达的高原女性宫颈癌患者出现放疗抵抗的概率相对更大,且ICAM-3、HIF-1蛋白表达与组织学分级、淋巴结转移有一定关联,术前可检测其表达情况,以便充分评估放疗的可行性与有效性。
[1] 朴秉国,翟敏,许世清,等.人肝癌微血管内皮细胞黏附分子表达特点及其对外周血单个核细胞黏附和跨内皮迁移的影响[J].中国肿瘤生物治疗杂志,2017,24(10):1058-1062.
[2] 罗昊翔.HIF-1在肿瘤形成中的作用及有氧运动对肿瘤的防治机制[J].基因组学与应用生物学,2015,34(12):2570-2574.
[3] 任伟,闫婧,钱晓萍,等.食管癌放化疗后近期疗效评价标准的研究进展[J].中华肿瘤杂志,2014,36(9):641-644.
[4] 马海丹,刘灿华,麦丽兰,等.182例宫颈癌患者生存情况及其影响因素分析[J].现代医学,2017,45(1):90-93.
[5] 张冬娟.局部晚期宫颈癌的放射治疗进展[J].重庆医学,2017,46(22):3147-3150.
[6] 戴蜜蜜,耿筱虹.宫颈癌放疗抵抗相关因素研究进展[J].中国现代医生,2017,55(26):165-168.
[7] 丁立新,赵现哲,姜晓燕,等.宫颈癌辐射敏感性相关基因的研究进展[J].癌变·畸变·突变,2017,29(5):394-396,401.
[8] 沙红兰,何陈云,李咏,等.ICAM-3蛋白表达在预测宫颈癌放射抵抗性中的价值[J].浙江临床医学,2016,18(9):1575-1577.
[9] 梁秋实,任卫东.PI3K信号通路抑制剂在人乳腺癌细胞侵袭的作用及可能机制[J].解剖科学进展,2015,21(3):249-251,255.
[10] 宁思思,谢莹.DC-SIGN与肿瘤关系的研究进展[J].生命科学研究,2015,19(3):252-257.
[11] 马超,赵继志,张韬,等.细胞黏附分子-1和淋巴细胞功能相关抗原在口腔鳞癌中的表达及其临床意义[J].中国药物与临床,2015,15(9):1337-1339.
[12] 娄英,梁文倩.宫颈癌患者HIF-1α、VEGF、MVD、CXCL12/CXCR4的表达及其预后研究[J].中国妇幼保健,2016,31(20):4135-4138.
[13] 黄平,张立民,黄冬冬,等.缺氧诱导因子1α在促卵泡激素促进卵巢癌SKOV3细胞增殖与侵袭中的作用[J].河北医科大学学报,2016,37(4):450-453.
[14] 应申鹏,曹学全,王赛赛,等.缺氧诱导因子-1α在宫颈癌放疗过程中的表达[J].现代实用医学,2017,29(5):661-663.
[15] 张德太,左曙蓉,杨文,等.siRNA沉默转酮醇酶样基因1下调人宫颈癌细胞HIF-1α表达及糖酵解关键酶活性[J].中国病理生理杂志,2014,30(1):72-76.
[16] 王芳,尹立勇,娄娟,等.HIF-1α及其靶基因在宫颈癌中的表达[J].河北医科大学学报,2017,38(7):764-769.
[17] 宋妮娜,瞿全新.宫颈上皮内瘤变分子生物学指标的研究进展[J].国际妇产科学杂志,2016,43(5):524-527.
[18] 赵小玲,孔为民.宫颈癌放疗敏感性相关基因研究进展[J].医学综述,2018,24(10):1883-1887.