术后肺部并发症(postoperative pulmonary complications,PPCs)是外科手术常见并发症之一,不仅影响手术效果,严重者可导致患者死亡。目前治疗胰头癌、胆管癌、壶腹周围癌以及引起梗阻性黄疸的其他恶性肿瘤的方法为腹腔镜胰十二指肠切除术(laparoscopic pancreaticoduodenectomy,LPD)。LPD术式操作复杂,不仅涉及胃、十二指肠、胰腺、胆囊、胆总管、空肠上端的切除,而且需行胰肠、胆肠、胃肠吻合,手术时间长,并发症发生率高达40%~60%,其中PPCs发生率为26.8%,病死率达5%,是普通外科难度大的手术方式之一[1]。自1992年国外实施第1例LPD后,经过20多年的发展,其安全性和实用性已得到证实[2]。国内此类手术开展相对较晚,2005年才有相关报道,关于PPCs的研究也少有报道。LPD患者多为老年人,身体机能降低且并发症多,尤其呼吸系统功能明显改变,通气储备下降,对麻醉手术耐受力降低,长时间腹腔镜手术操作导致术后呼吸系统并发症较多,这对LPD围术期麻醉管理提出了新挑战。本研究回顾性分析100例LPD患者的临床资料,探讨PPCs围术期高危因素,旨在为降低PPCs发生率提供方法和思路。
1 资料与方法
1.1 一般资料 选取2015年10月—2017年1月河北医科大学第二医院肝胆外科行择期LPD患者100例。纳入标准:①术前X线或者肺CT证实无肺部感染者;②术中无心跳骤停或者意外事件发生者;③术后无不明原因出院者。排除标准:①术前合并肺部感染者;②临床资料不全、失访或资料记录前后矛盾者。
1.2 方法 记录患者性别、年龄、体重指数(body mass index,BMI)、美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级、吸烟史、慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)、高血压、糖尿病、冠心病、肝功能分级、术中输血、术中输液量、术中吸入氧浓度(fraction of inspiration O2,FiO2)、术中保温、应用乌司他丁、术后镇痛、留观ICU、手术时间、术后住院时间。采用回顾性研究方法,探讨PPCs发生的高危因素。
1.3 PPCs诊断标准 PPCs是指术后发生的对疾病进程有负面影响且有临床症状的一系列肺部异常,包括肺不张、肺炎、急性肺损伤、术后呼吸衰竭、脓胸、气胸、支气管痉挛等。因回顾性查阅临床资料有限,本研究中PPCs仅包括肺不张、肺炎、急性肺损伤和术后呼吸衰竭。①肺不张:术后影像学显示肺叶或全肺不张。②肺炎:参看中华医学会呼吸病学会制定的《医院内获得性支气管炎-肺部感染诊断标准》,咳嗽、脓痰;发热,体温>38.0℃;肺部可闻及湿啰音,与术前比较,胸部X线或者CT可见新的肺部浸润影或炎性病灶;痰细菌培养(+)。③急性肺损伤:突发性氧合指数<300 mmHg;胸部正位X线片显示双肺斑片状阴影;无左心房压力增高的临床证据。④术后呼吸衰竭:术后任意时间需要再次机械通气、再次插管;术后需要不间断机械通气>72 h。
1.4 统计学方法 应用SPSS 21.0统计软件分析数据。计量资料比较采用t检验,计数资料比较采用χ2检验;高危因素确定采用多因素Logistic回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1 PPCs发生率 100例LPD患者术后发生PPCs 33例,PPCs发生率为33.0%。
2.2 PPCs组与非PPCs组观察指标比较 PPCs组吸烟率、COPD发生率、留观ICU比例及FiO2(纯氧)使用率高于非PPCs组,乌司他丁使用率低于非PPCs组,年龄大于非PPCs组,住院时间长于非PPCs组,差异均有统计学意义(P<0.05);其余指标差异无统计学意义(P>0.05)。见表1。
表1 PPCs组与非PPCs组观察指标比较
Table 1 Comparison of general data between PPCs group and NPPCs group (例数,%)
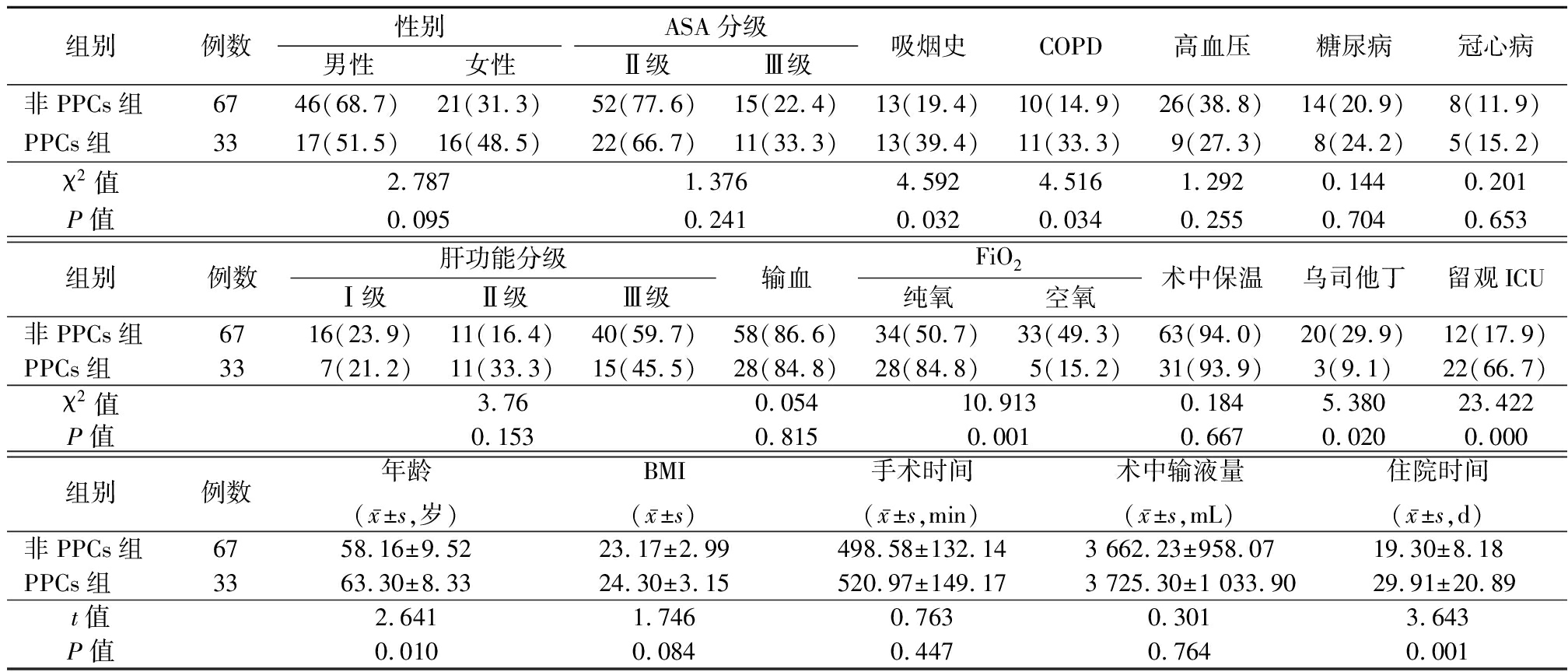
组别例数性别男性女性ASA分级Ⅱ级Ⅲ级吸烟史COPD高血压糖尿病冠心病非PPCs组6746(68.7)21(31.3)52(77.6)15(22.4)13(19.4)10(14.9)26(38.8)14(20.9)8(11.9)PPCs组3317(51.5)16(48.5)22(66.7)11(33.3)13(39.4)11(33.3)9(27.3)8(24.2)5(15.2)χ2值2.7871.3764.5924.5161.2920.1440.201P值0.0950.2410.0320.034 0.2550.7040.653组别例数肝功能分级Ⅰ级Ⅱ级Ⅲ级输血FiO2纯氧空氧术中保温乌司他丁留观ICU非PPCs组6716(23.9)11(16.4)40(59.7)58(86.6)34(50.7)33(49.3)63(94.0)20(29.9)12(17.9)PPCs组337(21.2)11(33.3)15(45.5)28(84.8)28(84.8)5(15.2)31(93.9)3(9.1)22(66.7)χ2值3.760.05410.9130.1845.38023.422P值0.1530.8150.0010.6670.0200.000 组别例数年龄(x-±s,岁)BMI(x-±s)手术时间(x-±s,min)术中输液量(x-±s,mL)住院时间(x-±s,d)非PPCs组6758.16±9.5223.17±2.99498.58±132.143 662.23±958.0719.30±8.18PPCs组3363.30±8.3324.30±3.15520.97±149.173 725.30±1 033.9029.91±20.89t值2.6411.7460.7630.3013.643P值0.0100.0840.4470.7640.001
2.3 多因素Logistic回归分析 以PPCs(有=1,无=0)作为因变量,以吸烟(是=1,否=0)、COPD(有=1,否=0)、FiO2(纯氧=1,空氧=0)、乌司他丁(应用=1,未用=0)、留观ICU(是=1,否=0)、年龄(<65岁=1,≥65岁=0)、住院时间(<20 d=1,≥20 d=0)为自变量,进行多因素Logistic回归分析,结果显示有吸烟史、合并COPD、100% FiO2为LPD患者术后发生PPCs的高危因素,见表2。
表2 多因素分析Logistic回归结果
Table 2 Logistic regression analysis of multivariate analysis
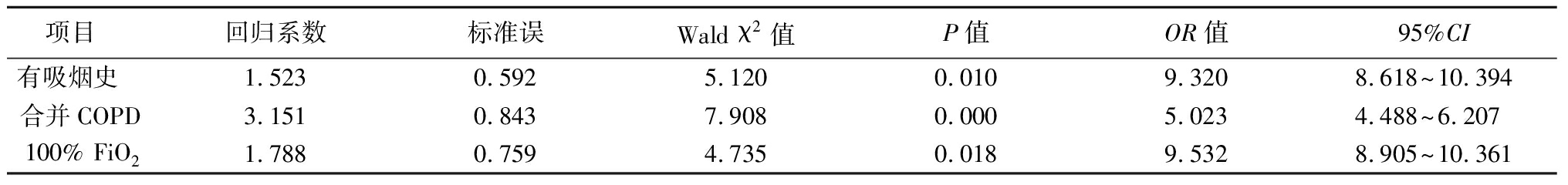
项目 回归系数标准误Wald χ2值P值OR值95%CI有吸烟史 1.5230.5925.1200.0109.3208.618~10.394合并COPD3.1510.8437.9080.0005.0234.488~6.207100% FiO21.788 0.7594.7350.0189.5328.905~10.361
3 讨 论
LPD是操作复杂、手术时间长、术后并发症发生率高的大型手术。关于LPD患者PPCs发生率的报道有很大差异性,可能与各地区LPD发展成熟度及当地特定人群有关。本研究100例LPD患者,PPCs发生率为33.0%,高于所查阅文献报道,可能诊断标准不一,有的研究仅将肺部感染判定为PPCs,本研究PPCs包括肺不张、肺炎、急性肺损伤和术后呼吸衰竭。尽管有其他主观因素存在,但LPD操作时间长、患者年龄偏大,PPCs发生风险高。
长期吸烟对呼吸系统造成的损害已是不争的事实。吸烟是PPCs的独立危险因素,而积极劝导患者术前提早戒烟、进行有效呼吸训练、术后指导正确排痰及应用化痰、抗炎药物等干预措施可显著降低PPCs发生率。魏丽娟[3]在吸烟与冠状动脉旁路移植术后早期结果关系中阐述,吸烟不仅是冠心病的重要病因及独立危险因素,而且增加心肌梗死、高血压、高血脂、术后肺部感染等发生率,不吸烟组较吸烟组术后呼吸机辅助时间明显缩短、肺部并发症发生率降低。关于食管癌PPCs高危因素分析的研究表明,吸烟指数(吸烟指数=每天吸烟支数×吸烟年数)>400的患者术前肺功能损害程度明显高于不吸烟组,术后并发肺不张、肺部感染概率较不吸烟组显著增高;术前戒烟、雾化吸入、术后完善镇痛是肺部并发症发生的抑制因素[4]。一项对74例胰十二指肠切除术术后早期并发症危险因素的临床分析,认为肺部感染是胰十二指肠切除术后主要早期并发症之一,年龄≥65岁和手术时间≥7 h是术后肺部感染的独立危险因素[5]。本研究结果显示吸烟史(OR=9.320,95%CI=8.618~10.394,P=0.010)是PPCs的高危因素。由于患者吸烟史在临床客观资料记录中信息有限,本研究仅将患者是否有吸烟史作为影响因素,未对吸烟患者戒烟与否、戒烟时间进行细化,故戒烟时间对PPCs的影响情况需要进一步研究。
术前合并COPD的患者,心肺功能相对差,免疫力低,术后发生呼吸系统并发症的概率较普通患者高。Takegahara等[6]研究结果显示,术前合并COPD行肺部手术患者术后PPCs发生率明显高于术前不伴COPD者(22.2% vs 6.7%),且提示COPD患者术前接受支气管舒张剂治疗可有效降低PPCs发生率。本研究结果与其一致。本研究Logistic回归分析结果显示,COPD是PPCs的独立危险因素(OR=5.023,95%CI=4.488~6.207,P=0.000)。既往研究结论提示,无论术前还是术后指导COPD患者进行呼吸功能训练,均能降低术后呼吸系统不良事件发生率[7-8]。目前尚无精确的肺功能参数或者血气分析结果参数预测术后并发症,但对COPD患者进行简易肺功能测定,评估其COPD病情程度,给予个体化干预措施,对患者术后康复大有益处。对于行LPD伴COPD患者,笔者建议:①术前进行良好评估,建议患者就诊术前麻醉评估中心,指导患者咳嗽排痰、呼吸训练,纠正低蛋白,抗感染等,做好术前准备;②术中尽量缩短手术时间,CO2气腹建立时选择尽量满足手术要求的最小腹内压,机械通气时选用合适的呼气末正压,防止肺泡萎陷;③术后疼痛严重干扰COPD患者进行深呼吸训练,故术后必须完善疼痛管理,鼓励患者尽早活动,避免长时间卧床,适当给予氧疗,按需雾化吸入等,促进患者术后肺功能恢复。
吸入高浓度氧气会导致高氧性肺损伤、肺不张等[9]。吸入高浓度氧气亦可能导致肺型氧中毒,其发生机制尚未完全阐明,且目前并无敏感性、特异性强的检测指标。其发生机制可能有三:①氧自由基产生过多;②炎性反应及炎性因子作用;③细胞凋亡及信号转导通路机制[10]。麻醉期间纯氧机械通气,患者术后初期均有可能出现不同程度局灶性肺不张,无论患者术前是否存在肺部疾病,吸入氧浓度越高,肺不张程度越严重[11]。陈鸣等[12]研究结果显示,在腹腔镜直肠癌根治术中空氧混合通气较纯氧吸入,患者术中氧合指数变化更小且术后肺功能损伤发生率更低。王英等[13]通过研究FiO2对后腹腔镜手术患者术后肺损伤的影响,发现血清Clara细胞分泌的CC16蛋白作为肺损伤早期诊断的生物学指标,其浓度随着腹腔镜操作时间延长而逐渐升高,FiO2越高,其升高水平越明显。本研究结果显示100% FiO2更易导致PPCs。与大部分文献结果一致。目前临床实践中对于全身麻醉期间最合适的FiO2仍处于不断试验摸索阶段。陈鸣等[12]认为在腹腔镜直肠癌根治术中,FiO2为50%对患者肺泡氧合功能有益。鲍方等[14]研究发现左剖胸食管癌根治术中单肺通气时最合适FiO2为75%,低于60%则警惕术中持续性低氧血症的发生。由此可见,单肺通气较双肺通气最佳FiO2不同,不同手术类型术中FiO2的设置也不同。本研究仅将FiO2分为纯氧和空氧混合通气,未记录空氧混合通气时具体FiO2数值,因而LPD术中最合适的FiO2需要后续更详尽的探讨。
乌司他丁是从男性尿液中提取纯化的广谱酶抑制剂,能抑制多种蛋白、糖类及脂肪水解酶,同时乌司他丁清除氧自由基,稳定溶酶体,改善组织灌注和局部微循环,从而改善机体氧化应激状态。乌司他丁早期用于急性胰腺炎的治疗,随后诸多研究证实了其良好的肺保护作用[15-17]。乌司他丁对腹腔镜手术患者肺部炎症的发生具有什么作用呢?相关研究报道,乌司他丁可通过刺激炎性因子释放的纤维蛋白原的合成而抑制气腹期间机体的炎性反应,提高肺顺应性,在腹腔镜胆囊切除、腹腔镜直肠癌手术中应用乌司他丁均能有效改善手术患者气腹期间的呼吸功能、降低全身氧化应激水平、保护肺功能、减少PPCs[18-19]。但是在大型腹腔镜手术(如LPD)中应用乌司他丁的价值还没有报道。本研究结果显示,LPD患者术中应用乌司他丁能降低PPCs发生率、缩短术后住院时间。机制有待进一步研究探讨。
综上所述,有吸烟史、合并COPD、术中麻醉期间100% FiO2为择期LPD患者PPCs发生的高危因素。从麻醉角度,在整个围术期对LPD患者呼吸系统进行干预和防护,包括术前麻醉宣教、戒烟、呼吸锻炼,术中设置合适FiO2、应用乌司他丁,到术后完善镇痛等环节降低PPCs的发生对患者快速康复意义重大。不久的将来,在多学科合作模式和ERAS理念的指导下,针对长时间腔镜手术特性,制定出一套循证医学支持下规范化的麻醉管理模式必将成为现实,从而为手术效果和患者利益提供更好的保障。
[1] Sulpicel L,Farges O,Goutte N,et al. Laparoscopic distal pancreatectomy for pancreatic ductal adenocarcinoma:time for a randomized controlled trial?Result of an all-inclusive national observational study[J]. Ann Surg,2017,266(6):e84.
[2] Subar D,Gobardhan PD,Gayet B. Laparoscopic pancreatic surgery:an overview of the literature and experience of a single cencer[J]. Best Pract Res Clin Gastroenterol,2014,28(1):123-132.
[3] 魏丽娟.患者吸烟情况与冠脉旁路移植术后早期结果的相关性[J].实用医学杂志,2014,30(23):3772-3774.
[4] 田静静,李娇丽,李玮浩.全腔镜下老年食管癌根治术后肺部并发症相关因素研究[J].中华实验外科杂志,2015,32(11):2851-2853.
[5] Hughes MJ,McNally S,Wigmore SJ. Enhanced recovery following liver surgery:a systematic review and meta-analysis[J]. HPB(Oxfod),2014,16(8):699-706.
[6] Takegahara K,Usuda J,Inoue T,et al. Preoperative management using inhalation therapy for pulmonary complications in lung cancer patients with chronic obstructive pulmonary disease[J]. Gen Thorac Cardiovasc Surg,2017,65(7):388-391.
[7] 金颖,李珏,王军.深吸气训练在COPD患者开胸术后的临床应用[J].局解手术学杂志,2015,24(1):45-47.
[8] Saito H,Hatakeyama K,Konno H,et al. Impact of pulmonary rehabilitation on postoperative complications in patients with lung cancer and chronic obstructive pulmonary disease[J]. Thorac Cancer,2017,8(5):451-460.
[9] Zoremba M,Dette F,Hunecke T,et al. The infiuence of perioperative oxygen concentration on postopetative lung function in modetately obese adults[J]. Eur J Anaesthesiol,2010,27(6):501-517.
[10] 刘晓峰,强显成,赵金柱,等.肺型氧中毒的研究进展[J].解放军医学杂志,2016,41(3):258-262.
[11] 李彭依,顾连兵,许仄平,等.单肺通气时降低吸入氧浓度对兔肺损伤的影响[J].中华临床医师麻醉杂志,2014,7(23):4239-4243.
[12] 陈鸣,王玲,吴青华.吸入氧浓度对全麻腹腔镜直肠癌根治术患者肺泡氧合功能的影响[J].实用医药杂志,2016,33(6):522-524.
[13] 王英,张岚,胡斌,等.吸入氧浓度对腹膜后腔镜手术患者血清CC16的影响[J].中国老年学杂志,2016,36(14):3503-3504.
[14] 鲍方,王强,刘礼军,等.单肺通气不同水平吸入氧浓度对食管癌剖胸手术患者血清炎性因子的影响[J].中国医药,2016,11(7):1026-1030.
[15] 米娜瓦·阿巴斯,祖木来提·土尔逊,杨晓红.乌司他丁对慢性阻塞性肺疾病急性期患者血清炎性因子及氧化应激的影响[J].海南医学院学报,2015,21(7):917-919.
[16] Wang LZ,Luo MY,Zhang JS,et al. Effect of ulinastatin on serum inflammatory factors in Asian patients with acute pancreatitis before and after treatment:a meta-analysis[J]. Int J Clin Pharmacol Ther,2016,54(11):890-898.
[17] Li W,Qiu X,Jiang H,et al. Ulinastatin inhibits the inflammation of LPS-induced acute lung injury in mice via regulation of AMPK/NF-κB pathway[J]. Int Immunopharmacol,2015,29(2):560-567.
[18] 严六狮,袁慧,王伟,等.乌司他丁对腹腔镜直肠癌手术围术期炎性反应的影响[J].临床麻醉学杂志,2012,28(8):756-758.
[19] 贾桂花,梁吉文,刘馨,等.乌司他丁对慢性阻塞性肺病患者腹腔镜手术中肿瘤坏死因子及白细胞介素6、8水平的影响[J].中国老年学杂志,2014,34(9):2365-2366.