夫妇同居1年,有正常性生活,未避孕而未受孕者称为不孕症[1],是严重影响身心健康的医学和社会问题,且近年来门诊发病率逐年提高。目前,在排卵障碍的患者中,随着高效促排卵药物的出现,控制性促排卵(control ovarian stimulation,COS)妊娠率比以往有所提高,但对于大部分不孕症患者仍不理想。卵泡发育不完全以及子宫内膜厚度达不到要求均会影响妇女受孕。卢丽丽等[2]研究发现,子宫内膜容受性和卵巢储备功能与妊娠密切相关,良好的子宫内膜容受性有利于胚胎着床和生长,较多的卵泡数可以增加促排卵妊娠的概率。但在COS时,对子宫内膜的情况以及评价依然没有非常统一的标准,故还需对此进行深入的研究[3]。虽然子宫内膜活组织检查及病理学检查对于评价子宫内膜容受性有着较高的准确性,但也存在有创、可重复性差的弊端。近年来关于超声评估子宫内膜相关情况以及测量卵巢大小和卵泡数评估卵巢情况的报道越来越多[4]。邓丽萍[5]研究发现,经阴道超声可以直接观察卵泡发育、子宫内膜生长情况,对临床合理诊断和治疗均具有重要的指导意义。李雪凤等[6]研究发现经阴道超声能够客观评价患者的宫腔容积和血流变化情况,对临床诊断具有参考价值,值得推广应用。本研究通过超声观察接受COS助孕患者子宫内膜参数及卵巢参数的相关特点,并对其进行影像学评价,分析超声监测指标对不孕患者妊娠结局的预测作用。报告如下。
1 资料与方法
1.1 一般资料 收集2017年1—12月在河北医科大学第二医院生殖中心行COS治疗的不孕患者(共209个周期)的相关临床及超声影像学资料。纳入标准:①年龄≤38岁,月经规律;②输卵管造影证实至少一侧输卵管通畅;③男方精液基本正常;④通过使用促排卵药物可有优势卵泡发育;⑤3个月内无雌/孕激素类药物使用史。排除标准:患有子宫疾病(如子宫肌瘤、子宫腺肌症、子宫畸形等)。
1.2 促排卵方案 患者月经第3天给予来曲唑2.5 mg,1次/d,连续服用5 d,停药2 d后,监测卵泡发育,如无优势卵泡,则给予尿源性促性腺激素(丽珠制药)促排。当输卵管通畅侧有优势卵泡,且直径在14 mm 以上,同时监测尿促黄体生成素(luteotropic hormone,LH)。待优势卵泡直径约15 mm时嘱男方手淫排精1次,当优势卵泡直径达17~20 mm,并结合尿LH适时给予人绒毛膜促性腺激素(human chorionic gonadotropin,HCG,丽珠制药) 6 000~10 000 U肌内注射。促排卵期间,超声监测子宫内膜厚度、类型、容积,卵巢体积、卵泡数、优势卵泡直径。肌内注射HCG后28~36 h指导同房。2 d后复查超声,观察优势卵泡是否消失。若消失给予口服黄体酮黄体支持。
1.3 妊娠结局 卵泡消失14 d后检测血清HCG确定生化妊娠,30 d行阴道超声检查,宫腔内见胚芽及心管搏动者为临床妊娠。
1.4 分组 COS治疗患者共209周期,其中妊娠30周期,临床妊娠率为14.35%,无宫外孕及多胎妊娠。①根据妊娠结局分为妊娠组(30周期),从未妊娠周期中随机抽取30周期作为对照定为非妊娠组(30周期);②根据内膜厚度分为<8 mm、8~14 mm、>14 mm组;③根据内膜类型分为A型(常见于内膜增生早期,此时内膜厚度4~9 mm,常说的三线型,外层和中央为强回声线,外层和宫腔中线间为低回声区或暗区)、B型(常见于内膜增生晚期,排卵时内膜厚度9~12 mm,为均一的中等强度回声,宫腔强回声中线断续不清)、C型(常见于黄体期,厚度10~14 mm,为均质强回声,无宫腔中线回声,此时“三线征”消失)组;④根据内膜容积分为<2 mL、2~4 mL、>4 mL组;⑤根据卵巢体积分为<3 cm3、3~6 cm3、>6 cm3组;⑥根据窦卵泡数分为<5个、5~15个、>15个组。
1.5 观察指标 比较妊娠组和未妊娠组年龄、不孕年限、原发不孕及继发不孕比例,子宫内膜厚度、子宫内膜类型、子宫内膜容积,卵巢体积、窦卵泡数、最大卵泡直径。比较不同子宫内膜厚度、子宫内膜类型、子宫内膜容积、卵巢体积、窦卵泡数各组的妊娠率。
1.6 统计学方法 应用SPSS 17.0统计软件处理数据。计量资料比较采用t检验;计数资料比较采用χ2检验。 P<0.05为差异有统计学意义。
2 结 果
2.1 妊娠组与未妊娠组一般资料比较 妊娠组与未妊娠组平均年龄、不孕年限及原继发不孕比例差异均无统计学意义(P>0.05),见表1。
表1 妊娠组与未妊娠组一般资料比较
Table 1 Comparison of the general data of pregnancy group and non-pregnant group (n=30)
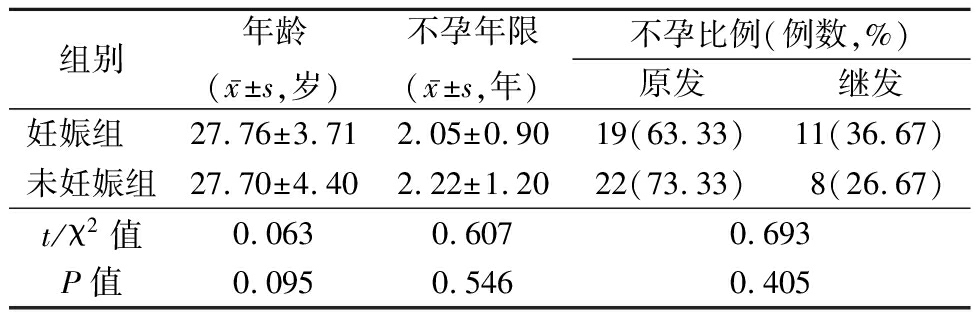
组别年龄(x-±s,岁)不孕年限(x-±s,年)不孕比例(例数,%)原发继发妊娠组 27.76±3.712.05±0.9019(63.33)11(36.67)未妊娠组27.70±4.402.22±1.2022(73.33)8(26.67)t/χ2值0.0630.6070.693P值0.0950.5460.405
2.2 妊娠组与未妊娠组子宫内膜参数比较 妊娠组子宫内膜厚度和内膜容积均大于未妊娠组,妊娠组子宫内膜形态A型较多,未妊娠组子宫内膜形态C型较多,差异有统计学意义(P<0.05),见表2。
表2 妊娠组与未妊娠组子宫内膜数据比较
Table 2 Comparison of the endometrial data of pregnancy group and non pregnant group (n=30)
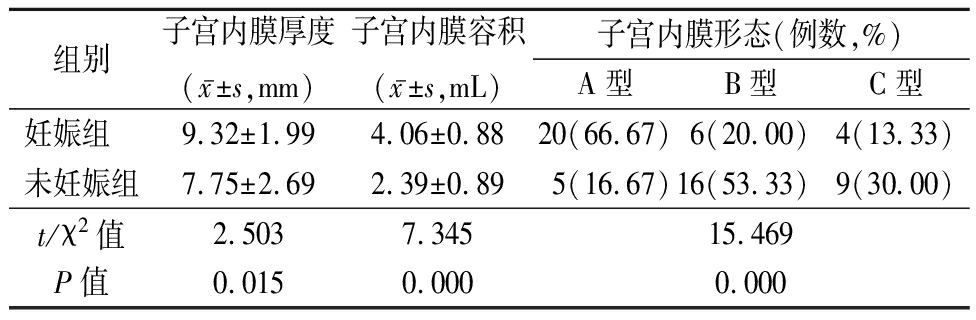
组别子宫内膜厚度(x-±s,mm)子宫内膜容积(x-±s,mL)子宫内膜形态(例数,%)A型B型C型妊娠组 9.32±1.994.06±0.8820(66.67)6(20.00)4(13.33)未妊娠组7.75±2.692.39±0.895(16.67)16(53.33)9(30.00)t/χ2值2.5037.34515.469P值0.0150.0000.000
2.3 妊娠组与未妊娠组卵巢参数比较 妊娠组卵巢体积、窦卵泡数明显大于或多于未妊娠组,差异有统计学意义(P<0.05); 2组HCG日最大卵泡直径差异无统计学意义(P>0.05)。见表3。
表3 妊娠组与未妊娠组卵巢数据比较
Table 3 Comparison of the ovarian data of pregnancy group and non pregnant group
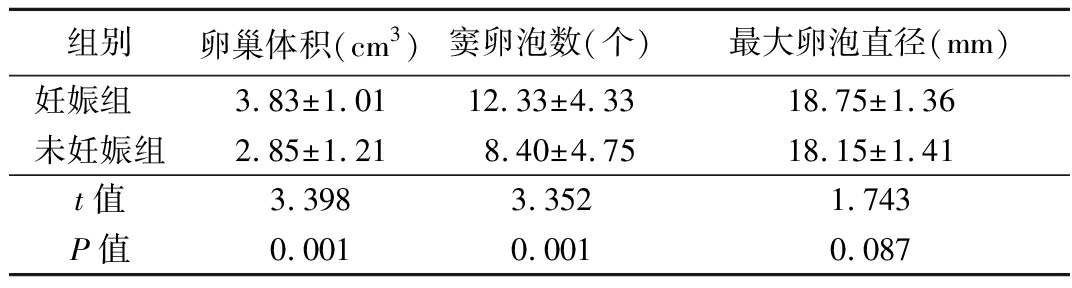
组别卵巢体积(cm3)窦卵泡数(个)最大卵泡直径(mm)妊娠组 3.83±1.0112.33±4.3318.75±1.36未妊娠组2.85±1.218.40±4.7518.15±1.41t值3.3983.3521.743P值0.0010.0010.087
2.4 不同分组妊娠率比较 子宫内膜厚度8~14 mm组妊娠率明显高于<8 mm、>14 mm组,子宫内膜A型组妊娠率明显高于B型、C型组,子宫内膜容积>4 mL组妊娠率明显高于<2 mL、2~4 mL组,卵巢体积3~6 cm3组妊娠率明显高于<3 cm3、>6 cm3组,卵泡数5~15个组妊娠率明显高于<5个、>15个组,差异均有统计学意义(P<0.05),见表4。
表4 不同分组妊娠率比较
Table 4 Comparison of the pregnancy rates in different groups (例数,%)
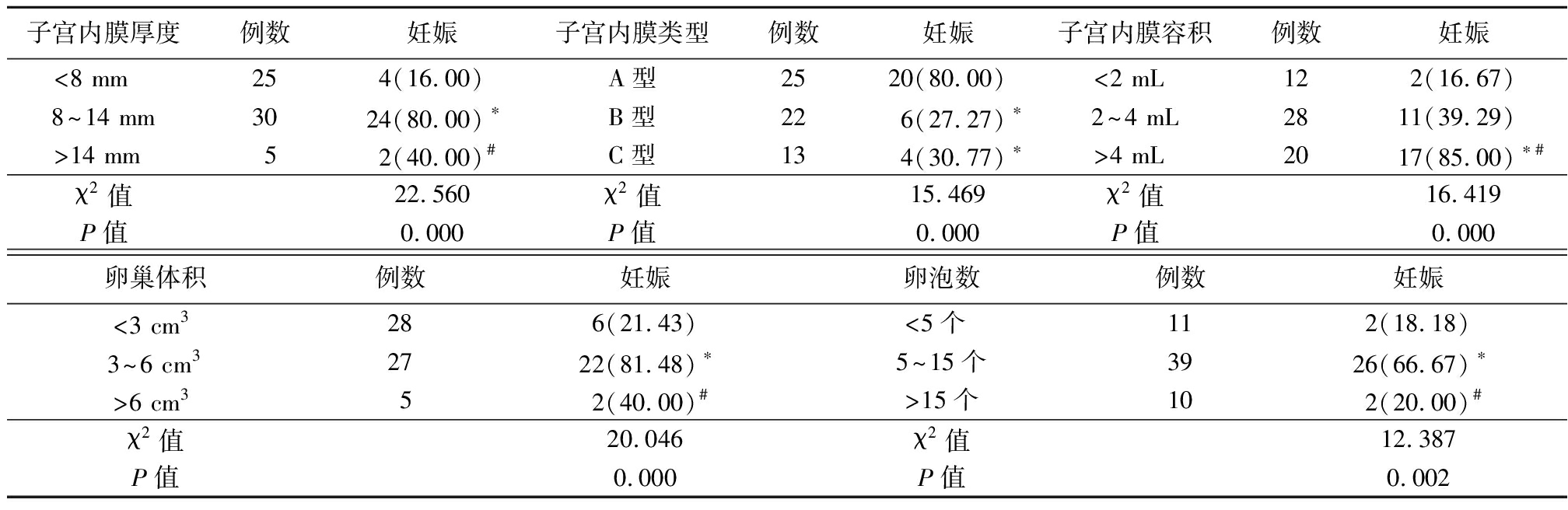
子宫内膜厚度例数妊娠子宫内膜类型例数妊娠子宫内膜容积例数妊娠<8 mm 254(16.00)A型2520(80.00)<2 mL 122(16.67)8~14 mm3024(80.00)∗B型226(27.27)∗2~4 mL2811(39.29)>14 mm 52(40.00)#C型134(30.77)∗>4 mL 2017(85.00)∗#χ2值22.560χ2值15.469χ2值16.419P值0.000P值0.000P值0.000卵巢体积例数妊娠卵泡数例数妊娠<3 cm3286(21.43)<5个 112(18.18)3~6 cm32722(81.48)∗5~15个3926(66.67)∗>6 cm352(40.00)#>15个102(20.00)#χ2值20.046χ2值12.387P值0.000P值0.002
*P值<0.05与第1组比较 #P值<0.05与第2组比较(χ2检验)
3 讨 论
不孕症发病受多种因素影响,不同国家地区存在较大差距,流行病学研究显示,发达国家原发不孕发生率为5%~8%,发展中国家一些地区可高达30%。女性不孕以排卵障碍、输卵管因素为主,但如果子宫内膜出现病变,可能导致受精卵着床困难不能受孕[7]。在生殖中心就诊的患者,通常需行阴道超声观察其子宫内膜及卵巢情况。各项参数监测正常者,可以通过促排卵+指导同房自然受孕,具有操作简单、用药较少、周期短、卵巢过度刺激风险小等优点,但其妊娠率较低也是一个急需解决的问题。促排卵并指导同房,每周期妊娠率为10%~15%,而年龄>38岁的妇女,其妊娠率明显降低。卵巢储备功能正常、有优势卵泡发育成熟并排卵以及良好的子宫内膜容受性是成功的关键。卵巢功能减退是女性生育能力低下的重要原因:小卵泡排卵或卵泡过度成熟发生黄素化会影响受精,从而降低妊娠率;而子宫内膜容受性差、内膜太薄,会因影响受精卵着床导致助孕失败。目前,通过超声评估子宫内膜相关情况以及测量卵巢大小和卵泡数评估卵巢情况的报道越来越多,但仍缺乏统一标准,故还需对此进行更深入的研究,以期指导临床提高成功率。
近年来超声技术在医疗方面的应用越来越成熟,也被广泛应用于生殖中心。多数生殖中心会使用经阴超声监测患者卵泡以指导用药。阴道超声监测卵泡发育检查的直观性、重复性好,可以连续监测卵泡的生长、成熟和排卵过程中的各项特征,是预测排卵期的重要手段之一。超声图像特征可以有效地判断卵泡成熟度,连续超声检查还可能发现一些排卵过程中与机体激素水平不一致的情况。蔡春洁[8]研究发现,经阴道超声可动态监测卵泡发育、掌握卵泡成熟情况并指导性生活,对不孕症患者有重要意义。还有研究表明,经阴道超声监测技术能够为医生提供更全面的卵泡发育及盆腔情况信息,帮助更准确地临床诊断;可有效指导患者性生活,大大提高受孕率[9]。另外,李春婷[10]发现,经超声引导下行夫精宫腔内人工授精有利于提高授精成功率,值得临床推广。故本研究采用经阴道超声技术对行COS不孕患者的卵泡发育以及子宫内膜情况进行监测,分析监测指标对妊娠结局的预测价值。
子宫内膜容受性与临床妊娠率关系密切。梁琨等[3]研究发现,子宫内膜厚度(>10 mm)、子宫内膜容积(>4 mL)、优势卵泡直径(18~23 mm)是COS成功的关键因素。通过阴道超声监测子宫内膜下血流可以预测子宫内膜容受性[11]。超声图像所示子宫内膜厚度、血流分型及血流参数能够评估子宫内膜容受性,而子宫内膜血流指数和子宫内膜厚度预测妊娠率的价值较高[12]。有文献报道,子宫内膜厚度0.8~1.4 cm者的妊娠率高于子宫内膜厚度<0.8 cm、>1.4 cm者[13]。林松泉等[14]采用经阴道超声技术对患者卵泡发育以及其子宫内膜变化情况进行观察,结果显示子宫内膜厚度同卵泡增长表现呈正相关,排卵前子宫内膜厚度<7 mm时,妊娠率较低。通过超声对不孕患者进行卵泡与子宫内膜的监测,其结果为患者提供治疗方案具有重要意义。Wolff等[15]认为,在HCG当日监测子宫内膜厚度,妊娠率会随着子宫内膜厚度增加而增加。本研究结果显示,妊娠组子宫内膜厚度和内膜容积均大于未妊娠组,妊娠组子宫内膜形态A型较多,未妊娠组子宫内膜形态C型较多,差异有统计学意义(P<0.05);且子宫内膜类型A型组,子宫内膜厚度8~14 mm组,子宫内膜容积>4 mL组妊娠率明显高于相应其他组。表明妊娠组与非妊娠组具有不同内膜影像学特点,且不同的子宫内膜影像学特征可以反映出内膜的容受性。
张宇等[1]研究发现,卵巢体积与排卵率关系密切,患者卵巢平均体积3~6.2 cm3者的排卵率明显大于卵巢体积>6.2 cm3及<3 cm3者。万桂香[16]发现经阴道超声监测子宫内膜厚度、卵泡情况,有助于临床诊治不孕症。促排卵妊娠成功的主要因素是年龄和卵泡数目[17-18]。尹春琳[19]研究发现,对于不孕症患者,可以采用经阴道超声监测技术对卵泡发育、子宫内膜变化进行监测,并以监测结果为依据,指导患者合理用药,提升治疗效果。本研究结果显示,妊娠组卵巢体积、窦卵泡数明显大于或多于未妊娠组,差异有统计学意义(P<0.05)。因此,通过超声对患者的卵巢功能以及卵泡发育状况进行监测,能够为患者制定更加合理的促排卵方案,提高患者临床妊娠率。
综上所述,对于接受COS治疗的不孕症患者行超声监测子宫内膜厚度8~14 mm、子宫内膜容积>4 mL、子宫内膜A型、卵巢体积3~6 cm3、窦卵泡数5~15个时妊娠的概率更大。超声影像学对子宫内膜及卵巢相关情况的评估对接受COS治疗的不孕患者的妊娠结局有一定预测作用。
[1] 张宇,梁建芬.阴道三维超声测量卵巢体积及监测排卵在不孕症中的价值[J].现代医用影像学,2018,27(1):200-201.
[2] 卢丽丽,费维,曹蓉蓉.超声监测卵泡发育及子宫内膜厚度与受孕的关系[J].中外女性健康研究,2016,24(4):71-72.
[3] 梁琨,陈智毅,黎月薇,等.超声评价夫精人工授精子宫内膜容受性的重要性及影响因素探讨[J/CD].中华临床医师杂志:电子版,2013,6(5):2245-2246.
[4] 吴爱华,杨丽.阴道B超测量卵巢体积及监测排卵在不孕症中的价值分析[J].中国继续医学教育,2018,10(23):47-49.
[5] 邓丽萍.采用阴道超声监测卵泡和子宫内膜的应用价值[J].医疗装备,2016,29(24):128.
[6] 李雪凤,闫雅妮,冯艳霞,等.经阴道超声对宫腔粘连患者宫腔容积和血流变化的临床评价及诊断价值[J].河北医科大学学报,2017,38(9):1072-1075.
[7] 邹丽,袁丽,张珍,等.采用经阴道超声评价不孕患者子宫内膜及动脉血流的临床研究[J].中国性科学,2018,27(4):76-79.
[8] 蔡春洁.经阴道超声在不孕症中卵泡监测的应用体会[J].职业教育与区域发展,2017,31(3):39-41.
[9] 陈晓,杨晓霞.经阴道超声监测卵泡发育对临床防治不孕症的临床价值[J].现代诊断与治疗,2016,27(14):2652-2653.
[10] 李春婷.超声引导下夫精宫腔内人工授精护理方法及效果评价[J/CD].实用临床护理学电子杂志,2017,2(22):114-115.
[11] Riad ON,Hak AA. Assessment of endometrial receptivity using Doppler ultrasonography in infertile women undergoing intrauterine insemination[J]. Gynecol Endocrinol,2014,30(1):70-73.
[12] 张茜,周尉玺,夏洪波.超声评估子宫内膜容受性对不孕症促排卵治疗妊娠率的预测价值[J].现代仪器与医疗,2018,24(4):13-15.
[13] 张锋英.经阴道超声监测子宫内膜厚度、类型与妊娠结局的关系[J].江西医药,2016,51(7):715-717.
[14] 林松泉,温兰妹.阴道超声监测卵泡与子宫内膜变化在不孕症中的临床价值[J].吉林医学,2015,36(5):900-901.
[15] Wolff EF,Vahidi N,Alford C,et al. Influences on endometrial development during intrauterine insemination: clinical experience of 2,929 patients with unexplained infertility[J]. Fertil Steril,2013,100(1):194-199.
[16] 万桂香.探讨经阴道超声监测卵泡发育对不孕症患者临床价值[J].世界最新医学信息文摘,2018,18(73):158-159.
[17] 尹敏娜,刘春林,刘俊,等.自然周期与促排卵周期宫腔内人工授精助孕临床结局分析[J].生殖医学杂志,2015,24(12):1008-1013.
[18] 徐仰英,王海燕,乔杰,等.影响宫腔内人工授精妊娠率的临床因素分析[J].北京大学学报:医学版,2013,45(6):887-891.
[19] 尹春琳.超声监测卵泡及子宫内膜在不孕症治疗中的意义[J].大家健康:上旬版,2017,11(10):70-71.