随着世界人口的老龄化和生活方式改变,2型糖尿病发病率不断升高。目前,我国是世界上糖尿病人口最多的国家,预计到2030年2型糖尿病患者将达到4.4亿人[1]。2型糖尿病以高血糖为主要特点,其临床表现为多尿、多饮、多食和消瘦等特征。2型糖尿病能够引起许多严重的并发症,如糖尿病心血管疾病、糖尿病眼病、糖尿病肾病及其神经系统病变等[2]。骨质疏松症是2型糖尿病常见的骨骼组织并发症,其主要特征为骨组织微观结构退化、骨量降低[3]。2型糖尿病性骨质疏松症能够引起患者周身疼痛,增加骨折风险,危害和影响患者的健康和生活。2型糖尿病性骨质疏松症患病率呈逐渐增长的趋势,给社会带来沉重的经济负担,将成为前所未有的公共卫生问题[4]。近年研究发现,胰岛素样生长因子1(insulin-like growth factor-1,IGF-1)与2型糖尿病性骨质疏松症的发病密切相关[5-6]。IGF-1属于胰岛素样生长因子家族,是胰岛素信号通路重要的调节因子,参与调节细胞增殖和分化[7]。骨骼组织中的成骨细胞和骨基质细胞能够产生IGF-1,并作用于成骨细胞[8]。在成骨细胞中,IGF-1与IGF结合蛋白(insulin-like growth factor binding protein,IGFBP)结合,促进成骨细胞有丝分裂和骨基质合成、矿化[9]。本研究以2型糖尿病性骨质疏松大鼠模型为研究对象,通过实时定量PCR检测2型糖尿病骨质疏松大鼠骨组织中IGF-1 mRNA表达水平,探讨2型糖尿病骨质疏松发病与骨组织中IGF-1表达水平的关系。
1 材料与方法
1.1 实验动物 清洁级雌性Wistar大鼠20只,体重180~200 g,2.5~3个月龄,由河北省实验动物中心提供。实验动物饲养于清洁级动物房,室温18~24 ℃,相对湿度55%~65%,通风干燥,安静,12 h日光交替照射,自由摄食饮水,适应性喂养7 d后开始实验。本研究所有动物实验过程均遵照动物伦理学要求。20只Wistar大鼠随机分为4组:正常对照组、正常去卵巢组、2型糖尿病对照组和2型糖尿病去卵巢组,每组各5只。
1.2 实验试剂及实验仪器 链脲佐菌素购自美国Sigma公司;RNA提取试剂Trizol(Invitrogen公司)、Random primer(TaKaRa公司)、 SYBR Green(TaKaRa公司)、dNTP(TaKaRa公司)、反转录MMLV(TaKaRa公司)。PCR引物由上海生物工程有限公司合成。主要实验仪器包括酶联免疫测定仪(南京华东电子集团公司)、台式高速低温离心机Allegra 64R(美国Beckman-Culter公司)、紫外分光光度计UV-2550(日本Himadzu公司)、深低温冰箱(-80 ℃)MDF-382(日本SANYO公司)、纯水系统Milli-QS(美国MILLIPORE公司)、罗氏血糖仪(上海罗氏公司)、梯度基因扩增仪(TaKaRa公司)、实时定量PCR仪(美国伯乐公司)。常规饲料购自中国人民解放军白求恩国际和平医院实验动物中心,高糖高脂饲料为常规饲料中加入20%蔗糖、15%熟猪油、2.5%胆固醇。
1.3 2型糖尿病性骨质疏松大鼠模型的建立 正常去卵巢组给予常规饲料喂养;2型糖尿病对照组和2型糖尿病去卵巢组大鼠给予高糖高脂饲料喂养,8周后禁食12 h并腹腔注射链脲佐菌素(30 mg/kg),第9周测量大鼠空腹血糖。当大鼠空腹血糖≥7.0 mmol/L时,认定2型糖尿病动物模型成功建立。于第10周在无菌条件下对正常去卵巢组和2型糖尿病去卵巢组大鼠麻醉后行双侧卵巢切除手术;对正常对照组和2型糖尿病对照组大鼠实施假手术。手术后12周测量大鼠体重、腰椎3~6骨密度、空腹血糖和胰岛素水平,计算胰岛素敏感指数。
1.4 动物样品收集 去卵巢手术后第12周麻醉处死大鼠,分离股骨和肱骨,收集动物血清,动物样本存放于-80 ℃冰箱。
1.5 实时荧光定量RT-PCR 收集股骨和肱骨组织,使用Trizol试剂提取组织中总RNA,应用紫外分光光度计测量RNA浓度,并取2 μg RNA样品逆转录合成cDNA,反应体系如下:2 μL RNA(1 μg/μL)、1 μL dNTP Mix(10 mmol/L)、1 μL Random Primer、 1 μL DEPC水,70 ℃预变性10 min,冷却至4℃。再加入酶反应体系:1 μL 10×Buffer、1 μL RNA酶抑制剂、1 μL M-MuLV 逆转录酶、 2 μL DEPC H2O, 42 ℃ 60 min、95 ℃ 5 min,冷却至4 ℃。将逆转录合成cDNA样品进行10倍稀释后用于实时定量PCR。参照SYBR Green试剂盒说明书,使用如下反应条件:取2 μL稀释cDNA模板、上下游引物各0.4 μL、5 μL SYBR Green Mix、2.2 μL ddH2O。反应程序如下:95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,40个循环。以β-actin为内参照,计算目的基因mRNA表达量。采用△Ct法处理结果,计算相对表达量,即2-△△Ct。所有数据处理时以对照组的平均数进行标准化,以求得相对表达水平。IGF-1上游引物:5′-CCGCTGAAGCCTACAAAGTC-3′;IGF-1下游引物:5′-GGGAGGCTCCTCCTACATTC-3′;PCR产物长度为172 bp。β-actin 上游引物:5′-ACGGTCAGGTCATCACTATC-3′;β-actin 下游引物:5′-TAGAGCCACCAATCCACAC-3′;PCR产物长度为303 bp 。
1.6 统计学方法 应用SPSS 13.0统计软件包分析数据。计量资料比较分别采用F检验和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠体重、空腹血糖、空腹胰岛素和胰岛素敏感指数比较 正常去卵巢组体重略高于正常对照组,2型糖尿病组和2型糖尿病去卵巢组体重低于正常对照组和正常去卵巢组,2型糖尿病去卵巢组体重又高于2型糖尿病组(P<0.05);正常去卵巢组空腹血糖低于正常对照组,2型糖尿病组和2型糖尿病去卵巢组空腹血糖高于正常对照组和正常去卵巢组,2型糖尿病去卵巢组空腹血糖又高于2型糖尿病组(P<0.05);各组间空腹胰岛素水平呈逐渐升高,各组间胰岛素敏感指数呈逐渐降低(P<0.05)。见表1。
表1 各组大鼠体重、空腹血糖、空腹胰岛素和胰岛素敏感指数比较
Table 1 Body weight, fasting blood glucose,insulin and insulin sensitivity index among each group ![]()
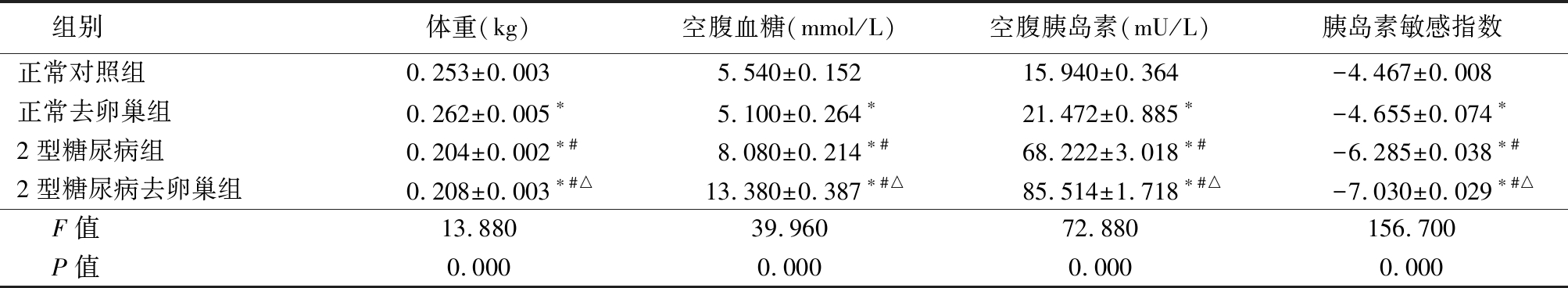
组别体重(kg)空腹血糖(mmol/L)空腹胰岛素(mU/L)胰岛素敏感指数正常对照组0.253±0.0035.540±0.15215.940±0.364-4.467±0.008正常去卵巢组0.262±0.005∗5.100±0.264∗21.472±0.885∗-4.655±0.074∗2型糖尿病组0.204±0.002∗#8.080±0.214∗#68.222±3.018∗#-6.285±0.038∗#2型糖尿病去卵巢组0.208±0.003∗#△13.380±0.387∗#△85.514±1.718∗#△-7.030±0.029∗#△F值13.88039.96072.880156.700P值0.0000.0000.0000.000
*P值<0.05与正常对照组比较 #P值<0.05与正常去卵巢组比较 △P值<0.05与2型糖尿病组比较(SNK-q检验)
2.2 各组大鼠骨密度和IGF mRNA相对水平比较 正常去卵巢组骨密度低于正常对照组,2型糖尿病组骨密度低于正常对照组,高于正常去卵巢组,2型糖尿病去卵巢组骨密度又低于2型糖尿病组(P<0.05);各组间IGF mRNA相对水平呈逐渐降低(P<0.05)。见表2。
表2 各组大鼠骨密度和IGF mRNA相对水平比较
Table 2 Comparison of bone mineral density and the relative levels of IGF-1 mRNA among each group ![]()
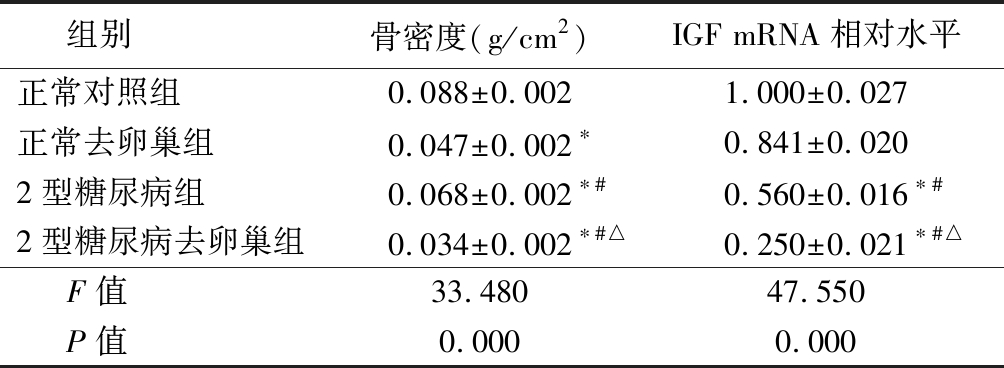
组别骨密度(g/cm2)IGF mRNA相对水平正常对照组0.088±0.0021.000±0.027正常去卵巢组0.047±0.002∗0.841±0.0202型糖尿病组0.068±0.002∗#0.560±0.016∗#2型糖尿病去卵巢组0.034±0.002∗#△0.250±0.021∗#△F值33.48047.550P值0.0000.000
*P值<0.05与正常对照组比较 #P值<0.05与正常去卵巢组比较 △P值<0.05与2型糖尿病组比较(SNK-q检验)
3 讨 论
目前,中国是世界上糖尿病患者人数最多的国家,并且这种情况将至少持续到2030年[10]。2型糖尿病是由机体糖脂代谢紊乱所引起的内分泌代谢疾病,能够引起多种严重的并发症。2型糖尿病性骨质疏松症是一种骨骼并发症,以骨量减少、骨骼微观结构破坏为特征的全身性骨骼疾病。2型糖尿病性骨质疏松症者骨脆性增加,容易发生骨折,极大地危害患者的身体健康,给社会带来了巨大的经济负担。因此,研究2型糖尿病性骨质疏松症发生的机制具有重要意义。
IGF是胰岛素信号通路中的重要因子,包括IGF-1、IGF-2和 IGFBP,其中IGF-1与骨代谢密切相关[11]。IGF-1是成骨细胞的促有丝分裂剂,可促进成骨细胞分化、增殖、募集。IGF-1可与成骨细胞上的IGF受体结合直接作用于破骨细胞抑制胶原酶的合成,还可不依赖促有丝分裂作用促进骨基质合成与矿化,影响骨代谢。目前研究已证实IGF可促进骨骼生长发育[12]。有研究发现IGF-1转基因小鼠成骨细胞中IGF-1过表达,骨细胞寿命延长,骨形成增加[13]。IGF-1可增加成骨细胞数目和活性,抑制骨胶原降解[14],在一定浓度范围内IGF-1促进成骨细胞增殖并呈浓度依赖性[15]。研究表明高糖使成骨细胞葡萄糖载体1(glucose transporter 1,GLUT1) mRNA 和蛋白表达增加,影响成骨细胞对葡萄糖的吸收,阻碍成骨细胞的分化;胰岛素和IGF-1可使已增加的GLUT1 mRNA和蛋白表达下调,这可能是胰岛素及IGF治疗糖尿病骨质疏松和骨量减少的机制之一[16]。近年研究发现骨髓中IGF-1与不耐酸亚单位复合物形成受损可诱导MSCs向成脂分化,相对减少向成骨分化;低强度激光照射可使IGF-1表达增加,刺激体外成骨细胞矿化;IGF-1能减轻小鼠去卵巢对骨髓前破骨细胞数目和骨基质中骨细胞发育的影响而减少骨吸收,促进成骨[17]。有研究证实重组人IGF-I制剂可有效治疗骨代谢疾病[18]。本研究使用高脂饲料喂养大鼠8周后,与对照组相比,2型糖尿病组大鼠体重降低,空腹血糖和胰岛素水平升高,胰岛素敏感性降低,说明2型糖尿病模型构建成功。同时,实施双侧卵巢切除手术,诱导2型糖尿病性骨质疏松模型。在大鼠实施卵巢切除手术12周后,与正常去卵巢组相比,2型糖尿病去卵巢组大鼠体重降低,空腹血糖和胰岛素水平升高,胰岛素敏感性降低。与正常组和2型糖尿病组相比,正常去卵巢组和2型糖尿病去卵巢组大鼠骨密度降低,且2型糖尿病去卵巢组大鼠骨密低于正常去卵巢组。实时定量PCR方法检测结果显示, 2型糖尿病和2型糖尿病去卵巢组大鼠骨骼组织中IGF-1 mRNA水平低于正常对照组和正常去卵巢组,且2型糖尿病去卵巢组骨骼组织中IGF-1 mRNA 水平低于2型糖尿病组。
因此,在2型糖尿病骨质疏松大鼠模型中,骨组织IGF-1是骨代谢重要的调节因子,与2型糖尿病性骨质疏松发病有关,其具体机制有待更深入研究。
[1] Zhang WL,Meng HZ,Yang RF,et al. Melatonin suppresses autophagy in type 2 diabetic osteoporosis[J]. Oncotarget,2016,7(32):52179-52194.
[2] Fan T,Yang S,Geng Q. Smoking and other risk factors in type 2 diabetes[J]. N Engl J Med,2018,379(26):2573.
[3] 赵爽,鲍晓雪.几种2型糖尿病治疗药物对骨代谢的影响[J].河北医科大学学报,2018,39(10):1227-1231.
[4] Song J,Jiang X,Juan J,et al. Role of metabolic syndrome and its components as mediators of the genetic effect on type 2 diabetes:a family-based study in China[J]. J Diabetes,2018[Epub ahead of print].
[5] Kanazawa I,Sugimoto T. Diabetes mellitus-induced bone fragility[J]. Intern Med,2018,57(19):2773-2785.
[6] Miyake H,Kanazawa I,Sugimoto T. Decreased serum insulin-like growth factor-I is a risk factor for non-vertebral fractures in diabetic postmenopausal women[J]. Intern Med,2017,56(3):269-273.
[7] Armakolas N,Armakoias A,Antonopoulos A,et al. The role of the IGF-1 Ec in myoskeletal system and osteosarcoma pathophysiology[J]. Crit Rev Oncol Hematol,2016,108:137-145.
[8] Kanazawa I,Notsu M,Miyake H,et al. Assessment using serum insulin-like growth factor-I and bone mineral density is useful for detecting prevalent vertebral fractures in patients with type 2 diabetes mellitus[J]. Osteoporos Int,2018,29(11):2527-2535.
[9] Bakker AD,Gakes T,Hogervorst JM,et al. Mechanical stimulation and IGF-1 enhance mRNA translation rate in osteoblasts via activation of the AKT-mTOR pathway[J]. J Cell Physiol,2016,231(6):1283-1290.
[10] Wu H,Meng X,Wild SH,et al. Socioeconomic status and prevalence of type 2 diabetes in mainland China,Hong Kong and Taiwan:a systematic review[J]. J Glob Health,2017,7(1):011103.
[11] Xi G,Rosen CJ, Clemmons DR. IGF-I and IGFBP-2 stimulate AMPK activation and autophagy,which are required for osteoblast differentiation[J]. Endocrinology,2016,157(1):268-281.
[12] Ma R,Wang L,Zhao B,et al. Diabetes perturbs bone microarchitecture and bone strength through regulation of sema3A/IGF-1/beta-catenin in rats[J]. Cell Physiol Biochem,2017,41(1):55-66.
[13] Ashpole NM,Herron JC,Mitschelen MC,et al. IGF-1 Regulates vertebral bone aging through sex-specific and time-dependent mechanisms[J]. J Bone Miner Res,2016, 31(2):443-454.
[14] Cohen A,Kousteni S,Bisikirska B,et al. IGF-1 Receptor expression on circulating osteoblast progenitor cells predicts tissue-based bone formation rate and response to teriparatide in premenopausal women with idiopathic osteoporosis[J]. J Bone Miner Res,2017,32(6):1267-1273.
[15] Qi Z,Xia P,Pan S,et al. Combined treatment with electrical stimulation and insulin-like growth factor-1 promotes bone regeneration in vitro[J]. PLoS One,2018,13(5):e0197006.
[16] Lee WC,Guntur AR,Long F. Energy metabolism of the osteoblast:implications for osteoporosis[J]. Endocr Rev,2017,38(3):255-266.
[17] Dicarlo M,Bianchi N,Ferretto C. Evidence Supporting a Paracrine Effect of IGF-1/VEGF on Human Mesenchymal Stromal Cell Commitment[J]. Cells Tissues Organs,2016,201(5):333-341.
[18] Bonjour JP. The dietary protein,IGF-I,skeletal health axis[J]. Horm Mol Biol Clin Investig,2016,28(1):39-53.