胃癌是一种常见的消化系统肿瘤,世界卫生组织于2014年发布的《全球癌症报告2014》[1]指出,胃癌是全球死亡人数最多的三大癌症之一。我国是胃癌高发区,每年胃癌的新增病例人数和死亡人数均居世界首位,严重危害了国民的健康。早期胃癌的预后及远期生存率均显著优于进展期胃癌,国家癌症中心强调“早诊早治”是治愈及最大程度改善患者预后、减轻我国癌症医疗经济负担的重要手段[2]。早期胃癌是指癌组织局限于胃黏膜层或黏膜下层,不论病灶大小及有无淋巴结转移[3]。日本学者在早期胃癌方面研究较为深入,有报道其早期胃癌的检出率>60%[4]。近年来,我国内镜水平也在经历着飞速的进步,以内镜下黏膜下剥离术(endoscopic submucosal dissection,ESD)为代表的内镜下治疗已被广泛应用于早期胃癌的治疗中。日本胃癌协会发行的《胃癌治疗指南》对早期胃癌的内镜下ESD治疗适应证有详尽的规定[5]。ESD的绝对适应证为:病灶≤2 cm,无溃疡的分化型黏膜内癌[6-7]。其扩大适应证包括:①病灶>2 cm,无溃疡的分化型黏膜内癌;②病灶≤3 cm,伴溃疡的分化型黏膜内癌;③病灶≤3 cm,无溃疡的分化型黏膜下浅层癌,即距黏膜肌层≤500 μm;④病灶≤2 cm,无溃疡的未分化型黏膜内癌。由此可见,胃癌病灶的浸润深度是判断ESD适应证的一项重要指标。本研究对107例行手术治疗的胃癌患者的术前血清肿瘤标志物癌胚抗原、癌抗原125、癌抗原19-9、甲胎蛋白水平与术后大体标本病理组织学特征进行分析,旨在评价几种肿瘤标志物对胃癌浸润深度的评估价值及判断是否可行ESD治疗。
1 资料与方法
1.1 一般资料 选取2008年4—12月在苏州大学附属第三医院﹙常州市第一人民医院﹚行手术治疗的胃癌患者107例,所有患者病历资料完整,均经胃镜、术前胃镜病理结果、影像学检查、手术及术后病理确诊,并排除合并其他可导致甲胎蛋白升高的疾病(如生殖腺胚胎瘤、活动性肝炎、肝硬化等)患者。107例胃癌患者术后病理显示其病变浸润深度:穿透浆膜层或侵及浆膜层47例,侵犯至肌层及黏膜下深层22例,侵犯至黏膜下浅层20例,局限于黏膜层者18例。本研究以胃癌病变浸润距黏膜肌层下方≤500 μm(即黏膜下浅层)为临界点,将患者分为2组:符合ESD扩大适应证者为A组 38例,男性21例,女性17例,年龄33~88岁,平均 (59.3±6.1)岁;不符合ESD扩大适应证者为B组 69例,男性41例,女性28例,年龄35~89岁,平均(62.6±7.0)岁。2组性别、年龄差异均无统计学意义(P>0.05),具有可比性。
1.2 检测方法 入院第二天晨起抽取患者术前空腹静脉血3 mL,室温自然凝固后以3 500 r/min离心4 min,分离上清液。应用美国雅培ARCHITECTi2000SR全自动免疫分析仪,以电化学发光免疫分析法检测患者血清癌胚抗原、癌抗原125、癌抗原19-9和甲胎蛋白水平,严格按照雅培公司提供的配套试剂盒说明书进行操作。
1.3 统计学方法 应用SPSS 22.0统计软件分析数据。计数资料比较采用χ2检验。正态分布计量资料比较采用t检验;非正态分布计量资料以中位数和四分位数间距[M(QR)]表示,组间比较采用秩和检验。应用受试者工作特征(receiver operating characteristic,ROC)曲线下面积分析4种肿瘤标志物水平对胃癌病变浸润程度的评估价值及判断患者是否符合ESD适应证的最佳临界值。P<0.05为差异有统计学意义。
2 结 果
2.1 2组术前血清肿瘤标志物水平比较 B组术前血清肿瘤标志物癌胚抗原、癌抗原125、癌抗原19-9水平均较A组明显升高,差异有统计学意义(P<0.05);2组间甲胎蛋白水平差异无统计学意义(P>0.05)。见表1。
表1 2组术前血清肿瘤标志物水平比较
Table 1 Comparison of preoperative serum tumor markers between two groups [M(QR)]
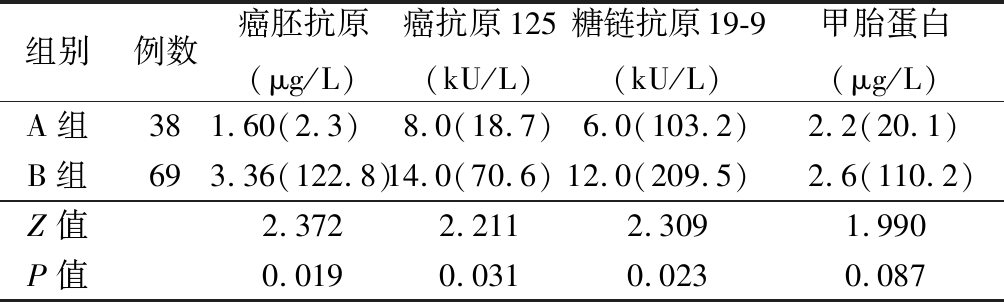
组别例数癌胚抗原(μg/L)癌抗原125(kU/L)糖链抗原19-9(kU/L)甲胎蛋白(μg/L)A组381.60(2.3) 8.0(18.7)6.0(103.2)2.2(20.1)B组693.36(122.8)14.0(70.6)12.0(209.5)2.6(110.2)Z值2.3722.2112.3091.990P值0.0190.0310.0230.087
2.2 4种肿瘤标志物对胃癌患者是否可行ESD治疗的预测价值 绘制4种肿瘤标志物的ROC曲线,并计算各ROC曲线下面积,癌胚抗原的ROC曲线下面积最高(0.792),其他依次为癌抗原125(0.758)、癌抗原19-9(0.693)、甲胎蛋白(0.533)。甲胎蛋白的ROC曲线下面积最小,与癌胚抗原及癌抗原125的ROC曲线下面积比较,差异均有统计学意义(P=0.022、0.029),可以认为甲胎蛋白对胃癌患者是否可行ESD治疗的评估价值较小,将其从本研究中剔除;而癌抗原19-9与癌胚抗原、癌抗原125的ROC曲线下面积比较,差异无统计学意义(P=0.233、0.278),可以认为这3种肿瘤标志物在判断胃癌患者是否可行ESD治疗的评估中具有较高的价值。见图1,表2。
2.3 肿瘤标志物评估胃癌患者是否可行ESD治疗的最佳临界值 根据ROC曲线计算癌胚抗原、癌抗原125、癌抗原19-9评估胃癌患者是否可行ESD的最佳临界值,分别为4.37 μg/L、12.10 kU/L、17.92 kU/L。分别以上述最佳临界值作为临界点,对癌胚抗原、癌抗原125、癌抗原19-9进行诊断性试验分析。敏感度以癌抗原125最高,特异度和准确度以癌胚抗原最高,三者联合则敏感度、准确度和阴性预测值均有大幅度提高。见表2。
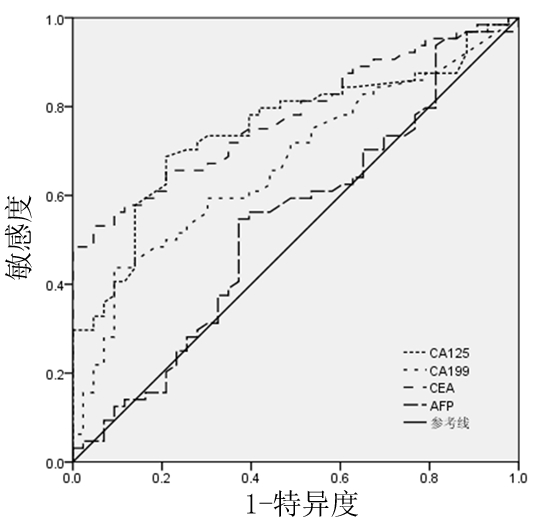
图1 4种肿瘤标志物的ROC曲线
Figure 1 ROC curves of 4 tumor markers
表2 对癌胚抗原、癌抗原125、癌抗原19-9的诊断性评价
Table 2 Diagnostic evaluation of CEA,CA125,CA19-9
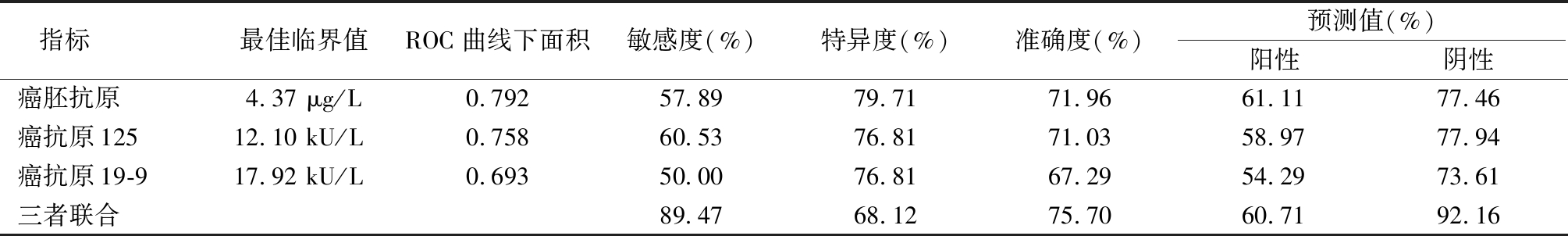
指标 最佳临界值ROC曲线下面积敏感度(%)特异度(%)准确度(%)预测值(%)阳性阴性癌胚抗原4.37 μg/L0.79257.8979.7171.9661.1177.46癌抗原12512.10 kU/L0.75860.5376.8171.0358.9777.94癌抗原19-917.92 kU/L0.69350.0076.8167.2954.2973.61三者联合89.4768.1275.7060.7192.16
3 讨 论
血清肿瘤标志物是在肿瘤发生和增殖过程中由肿瘤细胞生物合成、释放或是宿主对癌类反应性的一类物质,它并非肿瘤的特异性抗原,而是与肿瘤有相关性的,在一定程度上能够反映癌的发生和发展[8-10]。一种理想的肿瘤标志物应同时具备较高的敏感度和特异度,且检测技术易开展。肿瘤标志物癌胚抗原、癌抗原125、癌抗原19-9在正常组织中几乎不产生或产生甚微,且其检测方法目前已被临床广泛采用,在肿瘤性疾病的筛查、诊断中体现了一定的参考价值。
癌胚抗原是癌细胞膜上的一种结构蛋白,它是一种较复杂的含糖蛋白质,目前临床主要应用于消化系统肿瘤的筛查、诊断。本研究中以其最佳临界值4.37 μg/L作为诊断界点,评估胃癌患者的病变浸润深度条件是否符合ESD扩大适应证的敏感度为57.89%、特异度为79.71%。
癌抗原125是最初从卵巢癌组织中发现的一种糖类抗原,对卵巢癌有较高的特异性,它是一种广谱的肿瘤标志物,在消化系肿瘤中也见升高。本研究中以其最佳临界值12.10 kU/L为诊断界点,评估胃癌患者的病变浸润深度条件是否符合ESD扩大适应证的敏感度为60.53%、特异度为76.81%。
癌抗原19-9目前临床上主要用于胆胰系统恶性肿瘤及其他胃肠道肿瘤的筛查,也是一种糖类抗原。本研究中以其最佳临界值17.92 kU/L为诊断界点,其评估胃癌患者的病变浸润深度条件是否符合ESD扩大适应证的敏感度为50.00%、特异度为76.81%。
胃癌病变的浸润程度对于患者下一步治疗方案的选择具有重要的影响,早期胃癌浸润深度的影响因素仍存在部分争议,现阶段尚无标准体系用于临床判断[11]。对早期胃癌浸润深度的判断,临床上目前主要依靠超声内镜检查[12],也有推荐只有当白光内镜难以判断时再进行超声内镜检查[13]。关于超声内镜评估早期胃癌浸润深度准确度的研究,国内外均有报道,但研究结果相差较大,报道的总体准确度在60%~85%不等[14-15],这种差异主要与超声设备、操作者间差异以及病变的内镜下和病理学特点等有关[16]。
本研究结果显示,术前联合检测癌胚抗原、癌抗原125、癌抗原19-9,其评估胃癌病变浸润深度及患者是否可行ESD治疗的准确度达75.70%,这几乎可与超声内镜对胃癌浸润深度评估的准确度相媲美。
对于基层医院的医务工作者来说,面临着超声内镜设备短缺以及医务人员超声内镜技术水平的局限。本研究旨在为基层临床医生寻找一种简便易行并行之有效的方法,以协助评估患者胃癌病变的浸润深度,判断患者是否可行ESD治疗。ROC曲线常用于二分类判别效果的评价,ROC曲线下面积越大,其判断的准确度越高。当一个判断指标的ROC曲线下面积>0.9时,表示其判断的准确度较高;在>0.7~0.9之间时,表示其判别的准确度中等;在0.5~0.7之间时,表示其判断的准确度较低。依据本研究结果,癌胚抗原和癌抗原125的ROC曲线下面积均>0.7,癌抗原19-9的ROC曲线下面积为0.693,与癌胚抗原及癌抗原125之间差异无统计学意义,可以认为这3项指标对判断胃癌病变浸润程度具有较好的价值;而甲胎蛋白的ROC曲线下面积为0.533,与癌胚抗原及癌抗原125之间差异均有统计学意义,故将甲胎蛋白剔除,不推荐其作为胃癌病变浸润深度的判断指标。临床上用于胃癌筛查及诊断的肿瘤标志物单独检测时在敏感度和特异度上均存在有一定的局限性,故本研究采用了多种肿瘤标志物联合检测以提高胃癌的诊断率,但目前少有报道分析它们在评估胃癌病变浸润深度中的价值。本研究结果显示,临床上当胃癌患者联合检测上述3种肿瘤标志物时,如癌胚抗原>4.37 μg/L、癌抗原125>12.10 kU/L或癌抗原19-9>17.92 kU/L时应高度怀疑病变侵及黏膜肌层下方超过500 μm,此时则不适宜选择ESD作为治疗方案。
综上所述,术前血清肿瘤标志物癌胚抗原、癌抗原125、癌抗原19-9联合检测在评估胃癌患者病变浸润深度中具有较高的敏感度,对于判断该类患者是否可行ESD治疗具有一定的参考价值。
[1] McGuire S. World Cancer Report 2014.Geneva,Switzerland:World Health Organization,International Agency for Research on Cancer,WHO Press,2015[J]. Adv Nutr,2016,7(2):418-419.
[2] 程捷瑶,吴晰,杨爱明,等.超声内镜对浅表胃癌诊断及治疗决策的影响[J].中华消化内镜杂志,2016,33(10):663-666.
[3] 孙秀静,张倩,邢洁,等.超声内镜对早期胃癌浸润深度的诊断价值及影响因素分析[J].首都医科大学学报,2018,39(5):669-674.
[4] 赵恩昊,李晓波,曹晖.2015年日本消化器内视镜学会《早期胃癌内镜黏膜切除术和黏膜下剥离术治疗指南》解读[J].中国实用外科杂志,2016,36(1):79-83.
[5] Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2014(ver. 4)[J]. Gastric Cancer,2017,20(1):1-19.
[6] 李风,项平,欧阳琪,等.符合内镜黏膜下剥离术扩大适应证的早期胃癌内镜与外科手术回顾性比较研究[J].中华消化内镜杂志,2018,35(7):486-491.
[7] Chen W,Zheng R,Baade PD,et al. Cancer statistics in Chnia,2015[J]. CA Cancer J Clin,2016,66(2):115-132.
[8] 郭欣,时晓冬,宫敬伟,等.胃癌患者T淋巴细胞亚群和白细胞相关参数的表达分析[J].河北医科大学学报,2018,39(7):828-832.
[9] 李林海.常见肿瘤标志物的临床应用及进展[J].中华检验医学杂志,2016,39(12):995-998.
[10] 王燕,何燕霞.胃癌应用CA724、CEA、CA242、CA199肿瘤标志物联合检验的价值分析[J].中华肿瘤防治杂志,2016,23(S1):137-138.
[11] 程畅,叶乐平,汪胡根,等.早期胃癌浸润深度影响因素及DPS对浸润深度的预测价值[J].山东医药,2017,57(29):16-19.
[12] Hwang SW,Lee DH. Is endoscopic ultrasonography still the modality of choice in preoperative staging of gastric cancer?[J]. World J Gastroenterol,2014,20(38):13775-13782.
[13] Ono H,Yao K,Fujishiro M,et al. Guidelines for endoscopic submueosal dissection and endoscopic mucosal resection for early gastric cancer[J]. Dig Endosc,2016,28(1):3-15.
[14] Mocellin S,Pasquali S. Diagnostic accuracy of endoscopic ultrasonography(EUS) for the preoperative loeoregional staging of primary gastric cancer[J]. Cochrane Database Syst Rev,2015,(2):CD009944.
[15] Pei Q,Wang L,Pan J,et al. Endoscopic ultrasonography for staging depth of invasion in early gastric cancer:a meta-analysis[J]. J Gastroenterol Hepatol,2015,30(11):1566-1573.
[16] 程捷瑶,吴晰,杨爱明,等.浅析超声内镜对早期胃癌浸润深度的研究进展[J].中华消化内镜杂志,2016,33(8):575-578.