食管癌居世界癌症死因顺位的第6位[1]。我国食管癌以食管鳞癌为主,但食管腺癌的发病率逐步上升,发病率在过去的40年里已增加了7倍。同时全世界每年新增食管腺癌病例有18%来自中国[2-3]。近年来Hedgehog/Gli信号通路的异常激活与多种肿瘤的发生发展密切相关[4-6]。Polo样激酶(Polo-like kinases,PLK)与细胞有丝分裂的调控事件关系密切,在G2/M期过渡、纺锤体成熟及染色体分离等过程中发挥重要作用[7-9]。研究表明PLK1在多种恶性肿瘤细胞中异常表达,而作为有丝分裂的重要成员PLK1在食管腺癌中是否与Hedgehog/Gli信号通路有关尚无明确报道, 本研究旨在探讨食管腺癌中Hedgehog/Gli与PLK1的关系。
1 材料与方法
1.1 材料 ①细胞系来源:人食管腺癌细胞系OE33购自上海通派生物科技有限公司;②主要试剂:胎牛血清购自上海玉博生物科技有限公司,RPMI1640 培养液购自上海博升生物科技有限公司,GANT61购自美国Selleckchem公司(Hedgehog/Gli通路抑制剂),N-Shh蛋白购自美国EBioscience公司(Hedgehog/Gli通路激动剂),总RNA提取试剂盒购自北京索莱宝科技有限公司,TaqMan®基因表达预混液购自上海恒斐生物科技有限公司, iScriptTMcDNA合成试剂盒购自伯乐生命医学(上海)有限公司,TaqMan®Gli1引物及探针(Hs00171790)购自美国Life Technologies公司,TaqMan® Gli2引物及探针(Hs01119974_m1)购自美国Life Technologies公司,TaqMan® PLK1引物和探针(Hs00983227_m1)和TaqMan®GAPDH(Hs02758991_g1)购自美国Life Technologies公司,Pierce-BCA 蛋白分析试剂盒购自上海玉博生物科技有限公司,Gli1兔抗人多克隆抗体购自上海煊翎生物科技有限公司,Gli2鼠抗人单克隆抗体购自美国Santacruz公司, PLK1鼠抗人单克隆抗体购自美国Abcam公司、GAPDH鼠抗人单克隆抗体购自美国Santa Cruz公司, ECL 化学发光试剂盒购自美国Thermo Scientific公司,碘化丙啶购自上海翊圣生物科技有限公司,FC500型流式细胞仪购自贝克曼库尔特商贸(中国)有限公司。
1.2 细胞培养 37 ℃、5%CO2恒湿培养箱中的10%胎牛血清、100 kU/L青霉素和链霉素的培养液中进行OE33细胞培育,进行传代培养。将细胞融合生长至70%~80%分为4组:DMSO组、GANT61组用GANT61以15 μmol/L处理细胞,N-Shh蛋白组用N-Shh以0.5 g/L处理细胞,GANT61&N-Shh组用GANT61以15 μmol/L处理细胞30 min后再用N-Shh以0.5 g/L处理细胞24 h,检测Gli1、Gli2、PLK1 mRNA变化。
1.3 实时荧光定量PCR法检测Gli1、Gli2、PLK1 mRNA的表达 ①总RNA的提取:将细胞按照总RNA提取试剂盒说明书的方法提取4组样本RNA,测定4组各样本的RNA浓度;②cDNA合成:按照反转录合成试剂盒说明书进行cDNA 的反转录,反应体系为40 μL分别包含iScript逆转录酶2 μL,iScript反应混合液8 μL,总RNA500 ng,反转录条件为25 ℃ 5 min,42 ℃ 30 min和85 ℃ 5 min;③PCR扩增:将样本cDNA稀释后放在384孔板上,每孔包括cDNA 4.5 μL、Taqman基因表达预混液5 μL、TaqMan® Gli1、Gli2、PLK1和 GAPDH各自的引物和探针0.5 μL,上机进行PCR扩增。进行40 个循环。GAPDH的Ct 值为内参,用2-△Ct法进行分析。
1.4 Western blot 法检测Gli1、Gli 2、PLK1蛋白表达 将细胞用PBS 洗涤细胞3次,每个6孔板内加入蛋白酶抑制剂的M-PER细胞总蛋白提取试剂100 μL,每组样本的总蛋白提取液并以BCA 法测定总蛋白浓度。然后以SDS-PAGE电泳,工作条件200 V 50 min。冰浴下100 V 1 h转至PVDF膜。室温5%脱脂奶粉的TBST液封膜1 h,剪膜分别加入一抗Gli1(1∶1 000)、一抗Gli2(1∶250)、一抗PLK1(工作浓度为1∶ 1 000)和一抗 GAPDH(2∶10 000),4 ℃摇床孵育过夜。第二天TBST洗膜并加入羊抗兔或羊抗鼠二抗(1∶20 000)室温孵育, ECL 试剂染色曝光显影, Image软件检测蛋白条带的灰度值。以GAPDH为内参,蛋白相对表达量=目的蛋白表达量/GAPDH蛋白表达量,实验重复3次。
1.5 流式细胞术检测 细胞周期变化取上述食管腺癌细胞融合生长至70%~80%分为2组:DMSO组、GANT61组(15 μmol/L)处理细胞72 h。弃培养液再用消化液消化细胞,吹打成单细胞悬液并收集细胞上机离心,1 000 r/min离心5 min,去除上清,用冷 PBS液吹匀细胞,在细胞悬液中加入-20 ℃无水乙醇(注意置振荡器上,旋转搅拌,防止结团)。 4℃固定并吹打均匀再加入PBS,离心去除乙醇最后用PBS洗涤。加入100 μL RNase 37 ℃消化 30 min。流式细胞术检测细胞周期分布取单细胞悬液1 mL(含1×106细胞),冷PBS洗涤然后加入碘化丙啶染液在4 ℃避光环境下染色30 min,用500目铜网过滤,使样品成为合格的单细胞悬液,流式细胞仪检测。细胞增殖状态增殖指数=(S+G2/M)/(G0/G1+S+G2/M)×100%表示。流式细胞术检测细胞凋亡单细胞:取单细胞悬液1 mL(含1×106细胞),冷PBS洗涤1次,100 μL冷1×binding buffer悬浮细胞加入10 μL Annexin V-FITC,4 ℃避光环境放置15 min然后再加入380 μL 1×binding buffer,加入10 μL碘化丙啶染液4 ℃避光放置15 min,冷PBS洗涤细胞进行流式细胞仪检测,实验重复3次。
1.6 统计学方法 应用 SPSS 17.0统计软件分析数据。计量资料比较分别采用两独立样本的t检验、F检验和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 实时荧光定量PCR方法检测Gli1、Gli2和PLK1基因的表达 在OE33细胞株中,GANT61组在Gli1 mRNA、Gli2 mRNA和PLK1 mRNA的表达明显低于DMSO组,N-Shh组明显高于DMSO组和GANT61组,GANT61+N-Shh组低于DMSO组,但高于GANT61组,差异均有统计学意义(P<0.05),见表1。
表1 各组Gli1 mRNA、Gli2 mRNA和PLK1 mRNA表达比较
Table 1 Comparison of Gli1, Gli2 and PLK1 mRNAexpression in each group ![]()
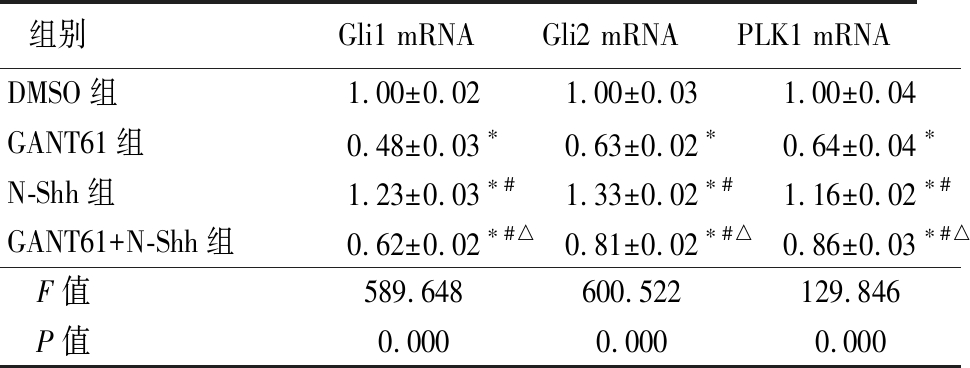
组别Gli1 mRNAGli2 mRNAPLK1 mRNADMSO组1.00±0.021.00±0.031.00±0.04GANT61组0.48±0.03∗0.63±0.02∗0.64±0.04∗N-Shh组1.23±0.03∗#1.33±0.02∗#1.16±0.02∗#GANT61+N-Shh组0.62±0.02∗#△0.81±0.02∗#△0.86±0.03∗#△ F值589.648600.522129.846 P值0.0000.0000.000
*P值<0.05与DMSO组比较 #P值<0.05与 GANT61组比较 △P值<0.05与N-Shh组比较(SNK-q检验)
2.2 Western blot 检测Gli1、Gli2和PLK1蛋白表达 在OE33细胞株中,GANT61组在Gli1蛋白、Gli2蛋白和PLK1蛋白的表达明显低于DMSO组,N-Shh组明显高于DMSO组和GANT61组,GANT61+N-Shh组低于DMSO组,但高于GANT61组,差异均有统计学意义(P<0.05),见表2。
表2 各组Gli1、Gli2和PLK1蛋白表达比较
Table 2 Comparison of Gli1, Gli2 and PLK1 protein expression in each group![]()
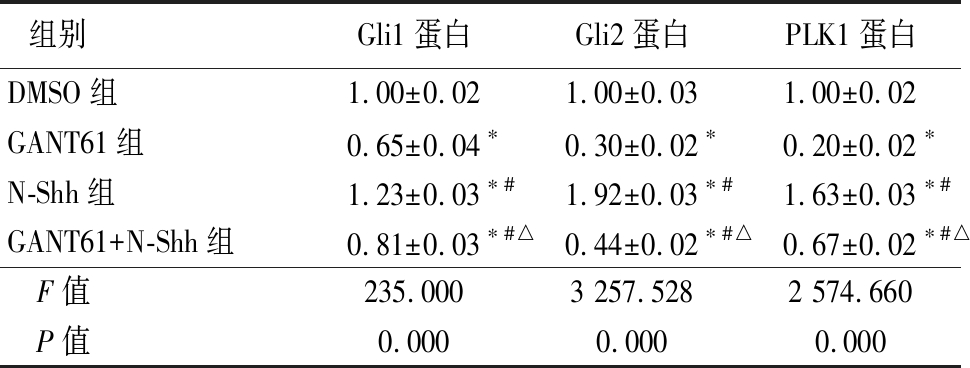
组别Gli1蛋白Gli2蛋白PLK1蛋白DMSO组1.00±0.021.00±0.031.00±0.02GANT61组0.65±0.04∗0.30±0.02∗0.20±0.02∗N-Shh组1.23±0.03∗#1.92±0.03∗#1.63±0.03∗#GANT61+N-Shh组0.81±0.03∗#△0.44±0.02∗#△0.67±0.02∗#△ F值235.0003 257.5282 574.660 P值0.0000.0000.000
*P值<0.05与DMSO组比较 #P值<0.05与GANT61组比较 △P值<0.05与N-Shh组比较(SNK-q检验)
2.3 流式细胞术检测细胞周期的影响 GANT61组G0/G1期、S期和G2/M期增殖率以及GANT61组培养72 h凋亡率均高于DMSO组,差异有统计学意义(P<0.05),见表3。
表3 DMSO组和GANT61组细胞周期增殖率和凋亡率比较
Table 3 Comparison of cell cycle proliferation ability and apoptosis rate between DMSO group and GANT61 group![]()
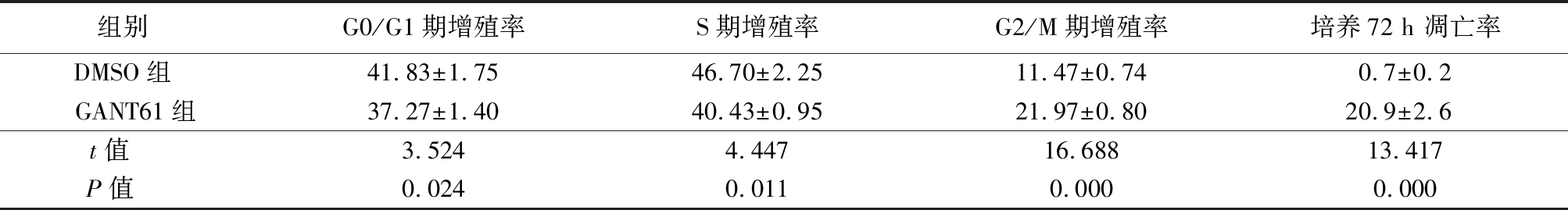
组别 G0/G1期增殖率S期增殖率G2/M期增殖率培养72 h 凋亡率DMSO组 41.83±1.7546.70±2.2511.47±0.740.7±0.2GANT61组37.27±1.4040.43±0.9521.97±0.8020.9±2.6t值 3.5244.44716.68813.417P值 0.0240.0110.0000.000
3 讨 论
Hedgehog/Gli通路的异常活化是许多肿瘤发生发展的原因之一,可以调控肿瘤细胞的增殖、迁移和组织分化等过程,针对其通路的深入研究则有助于阐明整个 Hedgehog信号通路网络导致疾病发生的机制。笔者在前期研究中发现食管腺癌组织中存在Gli高表达现象,并且发现Gli可以调控细胞周期相关蛋白表达[10], Neelakantan等[11]在乳腺癌、Chun等[12]在肝癌中、Li等[13]在肺腺癌中均证明抑制Gli1可以影响细胞周期蛋白,从而导致细胞周期停滞影响细胞的增殖。Polo样激酶可以调节细胞有丝分裂的开始与维持,其中过表达的PLK1使细胞有丝分裂检查点失控,造成中心体复制、染色体分离异常以及促进细胞增殖速度加快导致肿瘤细胞形成。de C rcer等[14]已研究发现PLK1的过表达可诱导染色体不稳定并抑制肿瘤发展,PLK1可作为一个有效的抗肿瘤靶点[15]。而在食管腺癌中Gli的表达变化是否通过影响PLK1的表达而达到抑制肿瘤的进展尚未明确。
rcer等[14]已研究发现PLK1的过表达可诱导染色体不稳定并抑制肿瘤发展,PLK1可作为一个有效的抗肿瘤靶点[15]。而在食管腺癌中Gli的表达变化是否通过影响PLK1的表达而达到抑制肿瘤的进展尚未明确。
目前尚不清楚Gli和PLK1两者如何调控食管腺癌细胞生长增殖,故本研究通过应用N-Shh和GANT61分别活化和抑制Hedgehog/Gli通路观察Gli与PLK1表达的相关性,结果显示GANT61可以明显下调Gli1、Gli2和PLK1基因表达和蛋白的表达;N-Shh可以活化Hedgehog/Gli通路导致Gli1、Gli2表达增高以及上调PLK1基因和蛋白表达。为了能更好地了解Gli和PLK1通路的相互关系,本研究采用了救援实验,既先应用GANT61抑制Hedgehog/Gli通路,再用N-Shh活化Hedgehog/Gli通路,结果显示与GANT61组相比,可以部分恢复Gli1、Gli2、PLK1等相应基因和蛋白表达。表明食管腺癌细胞中Hedgehog/Gli通路和PLK1通路之间存在“串活”关系,Gli可以调控PLK1表达。
细胞周期通常分为G1期、S期、G2期和M期,在G1/S和G2/M期的转换以及S期的进行均是受到严密调控的,如果细胞周期紊乱可导致肿瘤发生。细胞分裂增殖的正常进行对维持肿瘤的生长至关重要。研究表明Hedgehog/Gli通路异常激活,可以调控细胞周期以及CyclinD1、bcl-2等下游靶基因的异常表达,对肿瘤的发生和恶性生物学特性的维持发挥重要作用[6,15-16],抑制其通路可以导致细胞周期阻滞和凋亡。PLK1参与有丝分裂的各个环节,具有促进细胞周期由G2期进入M期以及促进染色体分离和中心体成熟等功能。本研究应用流式细胞术分析GANT61处理OE33细胞72 h的周期分布变化,结果显示GANT61组较空白对照组相比可将更多细胞阻滞于G2/M期,并且肿瘤细胞凋亡率显著增加。分析其原因可能是食管腺癌细胞Gli通过调控PLK1表达促进肿瘤发生发展的。
综上所述,Gli和PLK1对食管腺癌细胞的生长增殖发挥重要作用,两者存在“串活”关系,有效抑制Hedgehog/Gli通路活性,可阻断肿瘤细胞异常增殖。本研究为食管腺癌的精准医疗提供了新思路。
[1] Chen W,Zheng R,Baade PD,et al. Cancer statistics in China,2015[J]. CA Cancer J Clin,2016,66(2):115-132.
[2] 杜媛鲲,米源,陈阁,等.Gli通过PI3K/AKT途径促进肺腺癌A549细胞侵袭转移的研究[J].河北医科大学学报,2018,39(1):24-28.
[3] 许梦雀,陈鑫,王邦茂.食管腺癌起源的再认识[J].中华消化杂志,2015,35(5):291-293.
[4] Boehme KA,Zaborski JJ,Riester R,et al. Targeting hedgehog signalling by arsenic trioxide reduces cell growth and induces apoptosis in rhabdomyosarcoma[J]. Int J Oncol,2016,48(2):801-812.
[5] Arnhold V,Boos J,Lanvers-Kaminsky C. Targeting hedgehog signaling pathway in pediatric tumors: in vitro evaluation of SMO and GLI inhibitors[J]. Cancer Chemother Pharmacol,2016,77(3):495-505.
[6] Long B,Wang LX,Zheng FM,et al. Targeting gli1 suppresses cell growth and enhances chemosensitivity in CD34+ enriched acute myeloid leukemia progenitor cells[J]. Cell Physiol Biochem,2016,38(4):1288-1302.
[7] Palmisiano ND,Kasner MT. Polo-like kinase and its inhibitors:ready for the match to start?[J]. Am J Hematol,2015,90(11):1071-1076.
[8] Kumar S,Kim J. PLK-1 targeted inhibitors and their potential against tumorigenesis[J]. Biomed Res Int,2015,2015:705745.
[9] Talati C,Griffiths EA,Wetzler M,et al. Polo-like kinase inhibitors in hematologic malignancies[J]. Crit Rev Oncol Hematol,2016,98:200-210.
[10] 王雷,王林,米源,等.Gli抑制剂GANT61抑制食管腺癌细胞发生上皮-间质转化[J].肿瘤,2016,36(1):35-42.
[11] Neelakantan D,Zhou H,Oliphant MUJ,et al. EMT cells increase breast cancer metastasis via paracrine GLI activation in neighbouring tumour cells[J]. Nat Commun,2017,8:15773.
[12] Chun HW,Hong R. Significance of the hedgehog pathway-associated proteins Gli-1 and Gli-2 and the epithelial-mesenchymal transition-associated proteins Twist and E-cadherin in hepatocellular carcinoma[J]. Oncol Lett,2016,12(3):1753-1762.
[13] Li H,Yue D,Jin JQ,et al. Gli promotes epithelial-mesenchymal transition in human lung adenocarcinomas[J]. Oncotarget,2016,7(49):80415-80425.
[14] de C rcer G,Venkateswaran SV,Salgueiro L,et al. Plk1 overexpression induces chromosomal instability and suppresses tumor development[J]. Nat Commun,2018,9(1):3012.
rcer G,Venkateswaran SV,Salgueiro L,et al. Plk1 overexpression induces chromosomal instability and suppresses tumor development[J]. Nat Commun,2018,9(1):3012.
[15] Palmisiano ND,Kasner MT. Polo-like kinase and its inhibitors:ready for the match to start?[J]. Am J Hematol,2015,90(11):1071-1076.
[16] Plaisant M,Giorgetti-Peraldi S,Gabrielson M,et al. Inhibition of hedgehog signaling decreases proliferation and clonogenicity of human mesenchymal stem cells[J]. PLoS One,2011,6(2):e16798.