胃癌是我国最常见的消化系统恶性肿瘤,是一个多阶段、多步骤、多因素的疾病[1-2]。探明胃癌细胞发生的重要调节因子能够为胃癌治疗提供新的靶点。microRNA是一类非编码小分子RNA,在转录水平或者翻译水平调节下游靶基因表达水平[3]。已有文献报道多种microRNA参与胃癌的发生与发展,如miR-5590-3p[4]、miR-124-3p[5]、miR-23a/27a[6]和miR-155-5p[7]。miR-19a-3p属于miR-17-92家族,具有重要的生物学功能[8]。miR-19a-3p与多种癌症的发生相关[9-11]。本研究探讨miR-19a-3p与人胃癌细胞增殖的关系,旨在为人胃癌的防治提供新的思路,报告如下。
1 资料与方法
1.1 一般资料 选择2016年2月—2017年9月河北省邢台市第一医院收治的人胃癌病理标本20例,男性12例,女性8例;年龄30~60岁,其中年龄<50岁12例,≥50岁8例。以肿瘤中心的癌组织作为胃癌组织标本;距胃癌组织3 cm的组织标本作为癌旁组织标本;取胃癌组远离癌灶近侧或远侧断端胃黏膜,所有断端均距离癌灶超过5 cm,并经病理染色证实为正常胃黏膜,作为正常胃黏膜组织标本。
1.2 材料与试剂 人胃癌MKN28细胞系购自中国医学科学院基础医学研究所细胞中心。H-DMEM培养基(Gibico公司)、胎牛血清(Hyclone公司)、PTEN抗体和GAPDH抗体(Cell signaling Technology公司)、HRP标记的山羊抗兔二抗(北京中杉金桥生物技术有限公司)、化学发光试剂盒(millipore公司)、MTT(北京索莱宝生物技术有限公司)。miR-19a-3p mimics、miR-19a-3p inhibitor及其阴性对照片段、PTEN特异的siRNA及其阴性对照片段均购于上海吉玛生物技术有限公司。RNA提取试剂Trizol(Invitrogen公司)、SYBR Green(TaKaRa公司);反转录和PCR引物均由上海生物工程有限公司合成。
1.3 人胃癌细胞株MKN28细胞培养 人胃癌MKN28细胞培养于含10%胎牛血清H-DMEM培养基,孵育于37 ℃、含5% CO2的培养箱(Thermo公司)。每2 d更换培养基1次,待细胞密度达70%~80%时,使用0.25%胰蛋白酶消化3 min,培养基中和后800 r/min室温离心8 min,弃上清重悬后按照1∶5进行传代。
1.4 miR-19a-3p 类似物、miR-19a-3p 反义链及siRNA-PTEN细胞转染 转染前1 d将MKN28细胞种于6孔板中,待细胞80%融合后,用PBS洗6孔板中的细胞1次,每孔加入1.6 mL完全培养基(含 10%牛血清和双抗的H-DEME培养液)。按照说明将siRNA稀释成为20 μmol/L工作液。按转染试剂试剂盒说明书,在1.5 mL EP管中加入如下体系:3.75μL siRNA(20 μmol/L),116.25 μL EC buffer,8 μL Enhancer振荡1 s后室温放置3 min,然后加入10 μL Effectene,混匀后室温放置10 min,同时,以上1.5 mL EP管分别加入462 μL完全培养基,混匀后加入6孔板中,置于37 ℃、含5% CO2的培养箱中培养48 h,收集细胞进行检测。miR-19a-3p 类似物、miR-19a-3p 反义链及siRNA-PTEN均购买于上海吉玛生物技术公司。miR-19a-3p类似物序列:5′-UGUGCAAAUCUAUGCAAA-CUGA-3′;阴性对照:5′-UUCUCCGAACGUGU-CACGU-3′。miR-19a-3p反义链序列:5′-UCAGUUUUGCAUAGAUUUGCACA-3′;反义链阴性对照:5′-CAGUACUUUUGUGUAGUAC-AA-3′。siRNA-PTEN序列:5′-AGACUUGAAG-GCGUAUACA-3′。
1.5 实时荧光定量RT-PCR检测miR-19a-3p水平 MKN28细胞转染后48 h,使用Trizol试剂提取细胞总RNA。20 μL DEPC水稀释后测RNA浓度。取2 μg RNA进行逆转录合成测cDNA。反应体系如下:2 μL RNA(1 g/L),1 μL dNTP Mix(10 mmol/L),1 μL Oligo(dT)18 Primer(0.5 g/L), 1 μL DEPC水,加入PCR管中并瞬时离心混匀,放入PCR仪中70 ℃预变性10 min,骤冷至4 ℃。再加入1 μL 1×Rection Buffer,1 μL RNAse inhibtior,1 μL M-MuLV transcriptase,2 μL DEPC H2O,加入PCR管中并瞬时离心混匀,放入PCR仪中42 ℃ 60 min,95 ℃ 5 min,反转录成cDNA。
cDNA稀释10倍后取2 μL稀释液,用SYBR Green试剂盒进行PCR。反应条件为:上下游引物各0.4 μL,5 μL SYBR Green Mix,2 μL 模板cDNA,2.2 μL ddH2O加入PCR管中并瞬时离心混匀,放入PCR仪中95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min(收集荧光),40个循环。以gapdh为内参照,计算目的基因mRNA表达量。采用△Ct法处理结果,计算相对表达量,即2-△△Ct。所有数据处理时以对照组的平均数进行标准化,以求得相对表达水平。反转录引物如下:miR-19a-3p,GTCGTATCC-AGTGCAGGGTCCGAGGTATTCGCACTGGAT-ACGACTCAGTT;U6,GTCGTATCCAGT GCA-GGGTCCGA GTA TTC GCACTGGATACGACA AAAATATG。PCR引物如下:miR-19a-3p forward,GCGTGTGCAAATCTATGCAA;U6 forward,GCGCGTCGTGAAGCGTTC;universal reverse primer,GTGCAGGGTCCGAGGT;PTEN forward,CATTTCCATCCTGCAG AAGAAG;PTEN reverse,CCCAATACAGATTCACTTCCT-TTAG;18 s forward,GGAAGGGCACCACCAGG-AGT;18 s reverse,TGCAGCCCCG GACATCT-AAG。
1.6 Western blot检测蛋白表达 MKN28细胞转染后48 h,吸弃培养液,用2 mL预冷PBS洗涤细胞2次;加入200 μL细胞蛋白裂解液 RIPA,用细胞刮刀将细胞刮下,将细胞裂解液收集于1.5 mL EP管中,超声破碎细胞膜结构,4 ℃ 12 000 r/min离心10 min,将上清液转移至新的1.5 mL EP管中,使用BCA试剂盒测量蛋白浓度。取30 μg 蛋白进行SDS-PAGE电泳,300 mA恒定电流转印至PVDF膜上,5%脱脂牛奶室温封闭2 h,1∶1 000稀释PTEN和GAPDH抗体4 ℃孵育过夜,TBS-T洗膜3次,每次10 min;使用1∶5 000稀释HRP标记山羊抗兔二抗室温孵育2 h,TBS-T洗膜3次,每次10 min;使用化学发光试剂盒显影。应用Image J软件打开相应显影结果,分析蛋白条带灰度值,以内参为基准计算各组蛋白的相对比值,计算各组蛋白的相对表达量。
1.7 MTT实验 MKN28细胞转染后48 h,离心收集细胞,细胞计数并调整细胞浓度为5×104个细胞/mL,接种于96孔平底培养板中,每孔1×104个细胞,设置3个复孔;在37 ℃、5% CO2培养箱中培养4 h,待细胞完全贴壁后,更换新的200 μL RPMI-1640培养基。37 ℃、5% CO2培养箱培养继续培养24 h、48 h和72 h。每孔小心加入20 μL MTT溶液(5 g/L),避免划到孔底细胞,继续在37 ℃、5% CO2培养箱中培养4 h。终止培养,小心吸取全部上清。每孔加入200 μL DMSO,置于震荡器上振荡10 min,80 r/min,充分溶解结晶物质,使用酶标仪测量OD490 nm吸光值。
1.8 统计学方法 应用SPSS 13.0统计软件分析数据。计量资料比较分别采用两独立样本的t检验、F检验和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 miR-19a-3p在人胃癌组织中表达 采用实时荧光定量PCR方法检测20例人胃癌组织和癌旁组织中的miR-19a-3p表达水平,结果显示胃癌组织中miR-19a-3p表达水平明显高于癌旁组织,差异有统计学意义(P<0.05),见表1。
Table 1 Comparison of the expression of miR-19 a-3 p between adjacent normal tissues and gastric cancer tissues

组别miR-19a-3p相对表达水平癌旁组织1.000±0.099胃癌组织2.349±0.069t值11.200P值0.000
2.2 miR-19a-3p调节人胃癌MKN28细胞增殖 为了验证miR-19a-3p对人胃癌MKN28细胞增殖的调节作用,通过转染miR-19a-3p 类似物或miR-19a-3p 反义链在MKN28细胞中过表达或者低表达miR-19a-3p,结果显示转染miR-19a-3p 类似物组MKN28细胞中miR-19a-3p水平和细胞增殖水平均明显高于阴性对照组,差异有统计学意义(P<0.05);转染miR-19a-3p 反义链组MKN28细胞中miR-19a-3p水平和细胞增殖水平均明显低于反义阴性对照组,差异有统计学意义(P<0.05)。见表2,3。
Table 3 Comparison of the expression of miR-19 a-3 p and cell proliferation of miR-19 a-3 p between negative control group and miR-19 a-3 p mimic group
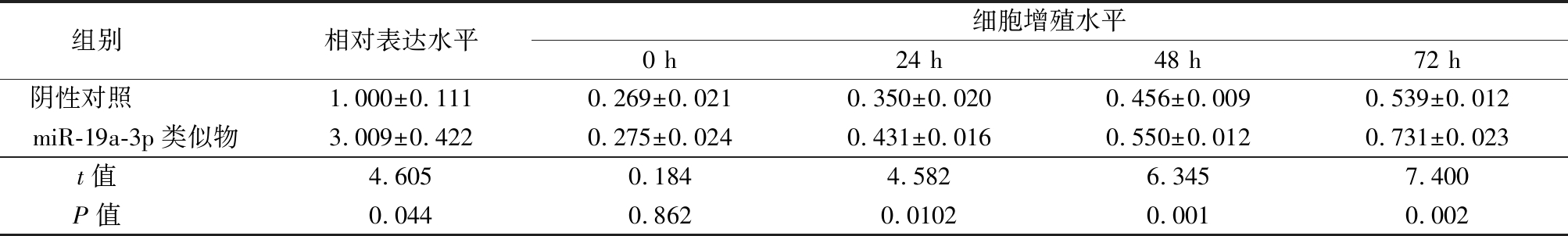
组别 相对表达水平细胞增殖水平0 h24 h48 h72 h阴性对照 1.000±0.1110.269±0.0210.350±0.0200.456±0.0090.539±0.012miR-19a-3p类似物3.009±0.4220.275±0.0240.431±0.0160.550±0.0120.731±0.023t值 4.6050.1844.5826.3457.400P值 0.0440.8620.01020.0010.002
Table 3 Comparison of the expression of miR-19 a-3 p and cell proliferation of miR-19 a-3 p between negative control group and miR-19 a-3 p inhibiton group
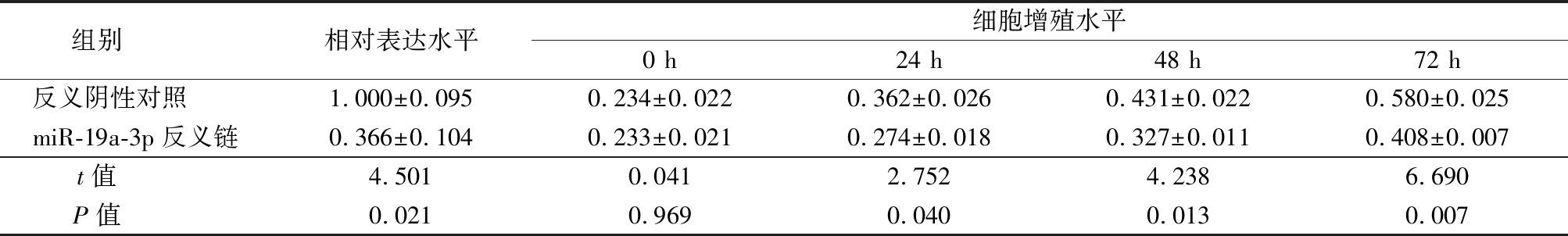
组别 相对表达水平细胞增殖水平0 h24 h48 h72 h反义阴性对照 1.000±0.0950.234±0.0220.362±0.0260.431±0.0220.580±0.025miR-19a-3p反义链0.366±0.1040.233±0.0210.274±0.0180.327±0.0110.408±0.007t值 4.5010.0412.7524.2386.690P值 0.0210.9690.0400.0130.007
2.3 miR-19a-3p调节PTEN表达水平 转染miR-19a-3p mimic能降低PTEN蛋白水平,但转染miR-19a-3p mimic类似物组与阴性对照组PTEN mRNA水平差异无统计学意义(P>0.05);转染miR-19a-3p inihibitor能升高PTEN蛋白水平,但转染miR-19a-3p inihibitor反义链组与反义阴性对照组PTEN mRNA水平差异无统计学意义(P>0.05)。见图1,2,表4,5。

图1 阴性对照组与miR-19a-3p类似物组PTEN蛋白水平比较
NC.阴性对照组;19a mimc.miR-19a-3p类似物组
Figure 1 Comparison of PTEN protein levels between negative control group and miR-19a-3p mimic group
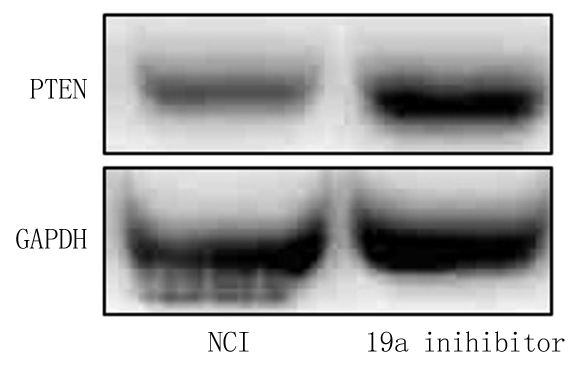
图2 反义阴性对照组与miR-19a-3p反义链组PTEN蛋白水平比较
NCI.反义阴性对照组;19a inhibitor.miR-19a-3p反义链组
Figure 2 Comparison of PTEN protein levels between negative control inhibitor group and miR-19a-3p inhibitor group
Table 4 Comparison of PTEN mRNA levels between negative control group and miR-19 a-3 p mimic group

组别 PTEN mRNA相对表达水平阴性对照 1.000±0.103miR-19a-3p类似物0.894±0.071t值 0.894P值 0.437
Table 5 Comparison of protein level of PTEN mRNA levels between negative control group and miR-19 a-3 p inhibiton group

组别 PTEN mRNA相对表达水平反义阴性对照 1.000±0.163miR-19a-3p反义链1.164±0.065t值 0.932P值 0.420
2.4 miR-19a-3p通过PTEN调节MKN28细胞增殖水平 为了进一步验证miR-19a-3p通过PTEN调节MKN28细胞增殖水平,在MKN28细胞中转染特异性靶向PTEN 的siRNA,结果显示miR-19a-3p反义链组MKN28细胞增殖水平低于反义阴性对照组,PTEN siRNA组MKN28细胞增殖水平高于反义阴性对照组,miR-19a-3p反义链+PTEN siRNAMKN28细胞增殖水平低于PTEN siRNA组,差异均有统计学意义(P<0.05),见表6。
Table 6 Comparison of cell proliferation of miR-19 a-3 p between different groups
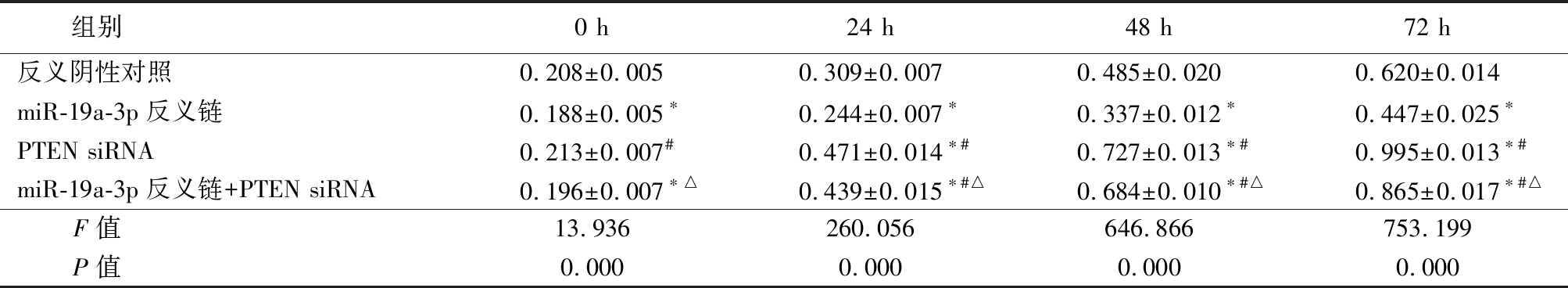
组别 0 h24 h48 h72 h反义阴性对照0.208±0.0050.309±0.0070.485±0.0200.620±0.014miR-19a-3p反义链0.188±0.005∗0.244±0.007∗0.337±0.012∗ 0.447±0.025∗PTEN siRNA0.213±0.007#0.471±0.014∗#0.727±0.013∗#0.995±0.013∗#miR-19a-3p反义链+PTEN siRNA0.196±0.007∗△0.439±0.015∗#△0.684±0.010∗#△0.865±0.017∗#△F值 13.936260.056646.866753.199P值 0.0000.0000.0000.000
*P值<0.05与反义阴性对照组比较 #P值<0.05与miR-19a-3p反义链组比较 △P值<0.05与PTEN siRNA组比较(SNK-q检验)
3 讨 论
胃癌是一种常见的消化系统恶性肿瘤,其5年生存率低。早期胃癌诊断率较低,中晚期胃癌化疗效果差,从而导致胃癌患者病死率居高不下。影响胃癌发生和发展的因素很多,microRNA作为一种重要的基因转录后水平调节分子,也参与调节胃癌的发生和发展。miR-195-5p通过调节ZNF139调节胃癌细胞的多药耐药性[12]。本研究结果显示,人胃癌组织中miR-19a-3p表达高于癌旁组织;在MKN28细胞中过表达miR-19a-3p促进细胞增殖,低表达miR-19a-3p抑制细胞增殖;Western blot实验证明miR-19a-3p能够调节PTEN蛋白水平;在MKN28细胞中沉默PTEN能够逆转miR-19a-3p inhibitor对细胞增殖的抑制作用。
miR-19a-3p属于miR-17-92基因簇,位于人染色体13q31.3,能够编码miR-18a、miR-17-5p、miR-19a-3p、miR-20a-3p、miR-19b-3p和miR-92,具有重要的生物学功能[8]。miR-19a-3p通过调节SOCS1和MXD1促进人胃癌细胞的转移和增殖[13-14]。本研究结果显示miR-19a-3p能够促进人胃癌细胞增殖。另外,miR-19a-3p通过PTEN调节胃癌细胞的上皮间质转化,促进胃癌发展[15]。本研究证实在人胃癌细胞中miR-19a-3能够调节下游靶基因PTEN的蛋白表达。miR-19a-3p通过PTEN影响胃癌细胞增殖水平。PTEN是一个经典的抑癌基因,其基因突变或者表达降低能够引起多种癌症的发生。PTEN能够负调节PI3K/AKT信号通路活性,广泛表达于全身各个组织器官[16]。人PTEN蛋白包含403个氨基酸,其三级结构主要包括2个功能区(磷酸酶功能区和C2功能区)和3个结构域(N端PIP2结合区、C端PEST序列、PDZ结合区)。激活的PI3K/AKT信号通路能够促进细胞增殖,活化的PI3K催化PIP2生成PIP3,使下游AKT磷酸化[17]。PTEN具有磷酸酶功能,能够催化PIP3转化成PIP2,进而负调节PI3K/AKT信号通路活性[18]。PTEN表达减少可增强PI3K/AKT信号通路活性,促进细胞增殖。本研究结果显示,miR-19a-3p通过调节PTEN蛋白水平影响MKN28细胞增殖;沉默PTEN蛋白表达能够促进MKN28细胞增殖,并且逆转miR-19a-3p inhibitor对细胞增殖的抑制作用。证明了miR-19a-3p通过下游靶基因PTEN调节人胃癌MKN28细胞增殖,从miR-19a-3p角度阐明了胃癌细胞增殖的机制,为胃癌防治提供了新的思路。
[1] Barra WF,Moreira FC,Pereira Cruz AM,et al. GEJ cancers:gastric or esophageal tumors? searching for the answer according to molecular identity[J]. Oncotarget,2017,8(61):104286-104294.
[2] Hwang JH. Understanding gastric cancer risk factors:we need to close the gap[J]. Gut Liver,2018,12(1):1-2.
[3] 黄耀孟,吴珺,李秉慧.miRNA在乳腺癌诊断/预后和预测中的作用[J].河北医科大学学报,2018,39(9):1100-1106.
[4] Wu N,Han Y,Liu H,et al. miR-5590-3p inhibited tumor growth in gastric cancer by targeting DDX5/AKT/m-TOR pathway[J]. Biochem Biophys Res Commun,2018,503(3):1491-1497.
[5] Liu F,Hu H,Zhao J,et al. miR-124-3p acts as a potential marker and suppresses tumor growth in gastric cancer[J]. Biomed Rep,2018,9(2):147-155.
[6] Hua K,Chen YT,Chen CF,et al. MicroRNA-23a/27a/24-2 cluster promotes gastric cancer cell proliferation synergistically[J]. Oncol Lett,2018,16(2):2319-2325.
[7] Li S,Zhang T,Zhou X,et al. The tumor suppressor role of miR-155-5p in gastric cancer[J]. Oncol Lett,2018,16(2):2709-2714.
[8] Fuziwara CS,Kimura ET. Insights into regulation of the miR-17-92 cluster of miRNAs in cancer[J]. Front Med(Lausanne),2015,2:e64.
[9] Chen M,Lin M,Wang X. Overexpression of miR-19a inhibits colorectal cancer angiogenesis by suppressing KRAS expression[J]. Oncol Rep,2018,39(2):619-626.
[10] Wang Y,Zhao S,Zhu L,et al. MiR-19a negatively regulated the expression of PTEN and promoted the growth of ovarian cancer cells[J]. Gene,2018,670:166-173.
[11] Bai Y,Lin H,Fang Z,et al. Plasma microRNA-19a as a potential biomarker for esophageal squamous cell carcinoma diagnosis and prognosis[J]. Biomark Med,2017,11(5):431-441.
[12] Nie H,Mu J,Wang J,et al. miR195-5p regulates multi-drug resistance of gastric cancer cells via targeting ZNF139[J]. Oncol Rep,2018,40(3):1370-1378.
[13] Wu Q,Yang Z,An Y,et al. MiR-19a/b modulate the metastasis of gastric cancer cells by targeting the tumour suppressor MXD1[J]. Cell Death Dis,2014,5:e1144.
[14] Qiao F,Gong P,Song Y,et al. Downregulated PITX1 modulated by MiR-19a-3p promotes cell malignancy and predicts a poor prognosis of gastric cancer by affecting transcriptionally activated PDCD5[J]. Cell Physiol Biochem,2018,46(6):2215-2231.
[15] Lu WD,Zuo Y,Xu Z,et al. MiR-19a promotes epithelial-mesenchymal transition through PI3K/AKT pathway in gastric cancer[J]. World J Gastroenterol,2015,21(15):4564-4573.
[16] Milella M,Falcone I,Conciatori F,et al. PTEN:multiple functions in human malignant tumors[J]. Front Oncol,2015,5:e24.
[17] Bermúdez Brito M,Goulielmaki E,Papakonstanti EA. Focus on PTEN Regulation[J]. Front Oncol,2015,5:e166.
[18] Wang X,Huang H,Young KH. The PTEN tumor suppressor gene and its role in lymphoma pathogenesis[J]. Aging(Albany NY),2015,7(12):1032-1049.