维生素D的经典作用为调节机体钙磷稳态,维持骨健康,但近来维生素D在非骨骼系统中的作用受到越来越多的关注,包括代谢综合征、心血管疾病、癌症、全因死亡及自身免疫性甲状腺疾病中的作用[1-3]。关于维生素D在自身免疫性甲状腺疾病中的作用仍存在争议[4]。Graves病为儿童最常见的自身免疫性甲状腺疾病之一[5],血清25羟维生素D(25 hydroxyvitamin D,25-OHD)是维生素D代谢的主要中间产物,不受甲状旁腺激素、血钙、血磷等影响,可反映维生素D综合代谢水平,是评价维生素D营养状况的最佳指标。本研究对初诊Graves病患儿血清25-OHD水平及甲状腺功能等相关指标进行分析,旨在探讨Graves病患儿维生素D状况及维生素D在Graves病发病机制中的作用。
1 资料与方法
1.1 一般资料 收集2016年1月—2017年12月河北医科大学第二医院儿科初诊的石家庄汉族Graves病患儿37例,男性4例,女性33例,年龄6~13岁。按初诊时间分为夏秋季组(初诊时间6—11月)22例及冬春季组(初诊时间12月—次年5月)15例;按年龄分为<10岁组14例及≥10岁组23例。所有患儿均未接受过抗甲状腺药物治疗,无骨骼发育异常,无肝、肾、心血管及遗传性疾病史,无肝炎、结核等传染性疾病;采血前6个月内无应用糖皮质激素、抗癫痫药等影响维生素D代谢药物的病史。
1.2 样本采集及检测 所有患儿均于初诊时采集空腹静脉血4 mL,不抗凝,待血液充分凝固后,3 000 r/min离心5 min,分别留取血清,化学发光法测定促甲状腺激素(thyrotropin,TSH)、总甲状腺素(total thyroxin,TT4)、总三碘甲腺原氨酸(total triiodothyronine,TT3)、游离甲状腺素(free thyroxine,FT4)、游离三碘甲腺原氨酸(free triiodothyronine,FT3)。电化学发光法测定促甲状腺激素受体抗体(thyrotropin receptor antibody,TRAb)、甲状腺球蛋白(thyroglobulin,TG)、甲状腺球蛋白抗体(thyroglobulin antibody,TGAb)。应用全自动酶标仪(Wellscan MK3 ,芬兰)及全自动洗板机(DEM-Ⅱ,北京),采用酶联免疫吸附测定法检测25-OHD。西门子s2000超声检测仪测定甲状腺左叶和右叶长、宽、厚度,根据甲状腺体积=0.479×(左叶长×宽×厚十右叶长×宽×厚)计算甲状腺体积,口服131碘法测定3,6,24 h吸碘率。应用SR-I-100尿碘专用型检测仪测定中段尿尿碘。
1.3 统计学方法 应用SPSS 21.0统计软件分析数据。正态分布计量资料比较采用两独立样本的t检验,非正态分布计量资料比较采用秩和检验;正态分布计量资料相关性采用Pearson相关分析,非正态分布计量资料相关性采用Spearman秩相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 25-OHD总体状况 37例Graves病患儿25-OHD水平为(49.95±22.82) nmol/L,缺乏者(25-OHD<30 nmol/L)11例(29.73%),不足者(25-OHD 30~50 nmol/L)4例(10.81%),充足者(25-OHD>50~250 nmol/L)22例(59.46%)。
2.2 不同季节组25-OHD状况比较 夏秋季组25-OHD水平高于冬春季组,差异有统计学意义(P<0.05),见表1。
表1 不同季节25-OHD状况比较
Table 1 Comparison of 25-OHD status in children with different seasons (M(Q25,Q75),nmol/L)
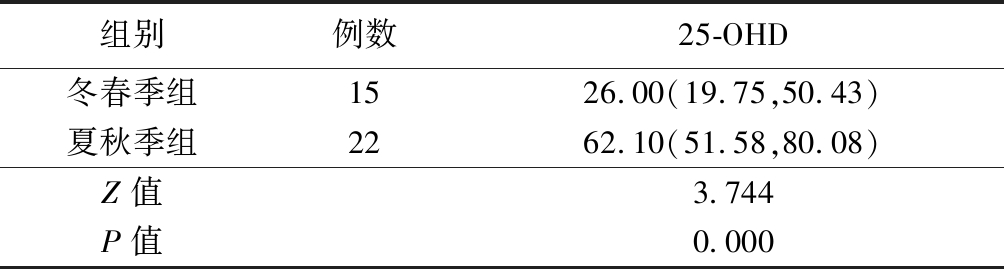
组别例数25-OHD 冬春季组1526.00(19.75,50.43)夏秋季组2262.10(51.58,80.08)Z值3.744P值0.000
2.3 不同年龄组25-OHD状况比较 年龄<10岁组与≥10岁组25-OHD水平差异无统计学意义(P>0.05),见表2。
Table 2 Comparison of 25 -OHD status in different age groups

组别例数25-OHD <10岁组1455.10±22.85≥10岁组2346.80±22.75t值1.074P值0.290
2.4 相关性分析 25-OHD水平与甲状腺体积、TT4、FT4、TT3、FT3、尿碘、3 h 131碘吸碘率、6 h 131碘吸碘率、24 h 131碘吸碘率均无相关性(r/rs=0.316、0.129、0.064、0.147、0.207、0.276、0.342、0.311、0.147,P>0.05)。
3 讨 论
Graves病是一种自身免疫性甲状腺疾病,存在刺激性促甲状腺激素受体抗体,持续促进甲状腺激素分泌,引起甲状腺功能亢进。一些研究表明,低浓度的维生素D可促进自身免疫性炎症的发生[6-8],特别是低于30 nmol/L的维生素D,是甲状腺自身免疫发展的重要危险因素,包括 Graves病。Graves病的高风险与编码维生素D结合蛋白和1,25二羟维生素D3基因多态性有关[9]。维生素D在自身免疫中的作用机制尚不完全清楚,部分通过对免疫系统细胞发挥旁分泌作用,产生抗炎和免疫调节作用。维生素D抑制Th1极化细胞因子白细胞介素12的产生,从而间接地使T细胞从Th1向Th2表型转移。在CD4+T细胞反应中,维生素D直接抑制Th1细胞因子(白细胞介素2和干扰素γ)的产生,促进Th2细胞因子(白细胞介素4)的产生[10]。
Graves病患者是否存在低血清维生素D水平报道不一[4,11-12]。人类膳食维生素D含量较少,紫外线照射皮肤产生维生素D是机体维生素D主要来源。户外活动时间、皮肤颜色、纬度、季节、天空云量、空气污染、紫外线防护措施等均影响维生素D产生。因此,维生素D血清水平有明显的季节性[13] 、年龄性[14]、地域性变化[15]。目前多数研究对季节、年龄、地域等影响因素考虑不足,导致结果不一致,甚至相反。为排除上述影响因素干扰,本研究选择37例初诊Graves病患儿均为石家庄地区汉族儿童,且进行了年龄和季节分组,结果显示相较于同龄及同地区健康查体儿童,37例初诊Graves病患儿25-OHD水平并未见减低,且缺乏及不足者占比40.54%,比例并不高[13,16];夏秋季组25-OHD水平显著高于冬春季组,表明在Graves病患儿中,25-OHD的季节性变化仍然存在;不同年龄组间25-OHD水平差异无统计学意义,可能与入组病例数少及Graves病患儿初诊年龄相对集中有关。
有研究显示,初诊Graves病患者血清25-OHD水平与甲状腺体积呈正相关[17]。本研究结果显示,25-OHD水平与甲状腺体积无相关性。多数研究发现,25-OHD与FT3、FT4、TT3、TT4、TSH水平无相关性[18-19]。本研究结果显示,25-OHD水平与TT4、FT4、TT3、FT3水平均无相关性。与多数文献报道一致。血清25-OHD水平与甲状腺抗体水平相关性结论不一致[18,20-22]。因本研究入选病例均为初诊患儿,所有患儿TSH均小于检测低限,TRAb抗体均大于检测高限,故未能分析TSH及TRAb与25-OHD的相关性。尽管有报道显示Graves病合并维生素D缺乏者单纯纠正维生素D缺乏症有可能逆转Graves病[23],血清25-OHD水平降低可能与Graves病的发生及严重程度相关[24],但结合文献及本研究结果,血清25-OHD水平并不影响Graves病实验室及临床参数,未能对此提供理论支持。此外,Li等[25]认为,放射碘治疗失败Graves病患者血清25-OHD水平低于放射碘治疗成功者,血清25-OHD <20 μg/L可能是预测Graves病患者放射碘治疗失败的独立危险因素,但25-OHD影响131碘治疗结局的机制不详。维生素D除了可能通过前述免疫调节机制影响治疗结局,尚可剂量依赖性直接抑制甲状腺碘摄取。然而在Li等[25]研究中,治疗失败组131碘摄取量高于成功组,无法用抑制甲状腺碘摄取机制解释。本研究亦分析了25-OHD与尿碘、3 h131碘吸碘率、6 h131碘吸碘率、24 h131碘吸碘率的相关性,均未有阳性发现,可能与样本量小有关,也可能有其他机制参与维生素D影响131碘治疗Graves病结局。
由于血清25-OHD水平并不影响Graves病实验室及临床参数,Planck等[19]认为,维生素D受体基因单核苷酸多态性通过降低维生素D水平以外的机制影响Graves病的风险。Meng 等[26]在中国汉族人群维生素D受体基因中检测到4个单核苷酸多态性,其中 rs7975232等位基因A频率在Graves病患者中较对照组显著增加,提示维生素D受体基因可能是Graves病易感基因之一。Inoue等[6]认为维生素D受体基因的遗传差异可能与Graves病的发生发展和活动性有关,而种群特异性成分和25羟化酶基因的遗传差异可能与Graves病的难治性有关。因此,维生素D受体、25羟化酶等维生素D 相关组分基因多态性而非血清维生素D水平可能在Graves病发生发展中发挥作用。
综上所述,去除地域、种族、季节等因素影响后,Graves病患儿血清25-OHD水平未见明显降低,季节性变化仍然存在;血清25-OHD水平并不影响Graves病实验室及临床参数。各研究结论不一致甚至互相矛盾可能与研究人群异质性、地域性变化、采血季节性变化及实验设计等因素相关。需要进一步随机、对照、前瞻性大样本研究,以证明维生素D与Graves病的相互关系。维生素D相关组分单核苷酸基因多态性可能是今后的研究方向。
[1] Kim D. The role of Vitamin D in thyroid diseases[J]. Int J Mol Sci,2017,18(9):E1949.
[2] Muscogiuri G,Tirabassi G,Bizzaro G,et al. Vitamin D and thyroid disease: to D or not to D? [J]. Eur J Clin Nutr,2015,69(3):291-296.
[3] Bozkurt NC,Karbek B,Ucan B,et al. The association between severity of vitamin D deficiency and Hashimoto′s thyroiditis[J]. Endocr Pract,2013,19(3):479-484.
[4] D′Aurizio F,Villalta D,Metus P,et al. Is vitamin D a player or not in the pathophysiology of autoimmune thyroid diseases?[J]. Autoimmun Rev,2015,14(5):363-369.
[5] Pasala P,Francis GL. Autoimmune thyroid diseases in children[J]. Expert Rev Endocrinol Metab,2017,12(2):129-142.
[6] Inoue N,Watanabe M,Ishido N,et al. The functional polymorphisms of VDR,GC and CYP2R1 are involved in the pathogenesis of autoimmune thyroid diseases[J]. Clin Exp Immunol,2014,178(2):262-269.
[7] Bizzaro G,Shoenfeld Y. Vitamin D and thyroid autoimmune diseases: the known and the obscure[J]. Immunol Res,2015,61(1/2):107-109.
[8] Vondra K. Vitamin D and autoimmune thyroid diseases[J]. Vnitr Lek,2016,62(9 Suppl 3):121-125.
[9] Vondra K,St rka L,Hampl R. Vitamin D and thyroid diseases[J]. Physiol Res,2015,64(Suppl 2):S95-100.
rka L,Hampl R. Vitamin D and thyroid diseases[J]. Physiol Res,2015,64(Suppl 2):S95-100.
[10] Rotondi M,Chiovato L. Vitamin D deficiency in patients with Graves disease: probably something more than a casual association[J]. Endocrine,2013,43(1):3-5.
[11] Xu MY,Cao B,Yin J,et al. Vitamin D and Graves disease: a meta-analysis update[J]. Nutrients,2015,7(5):3813-3827.
[12] Ke W,Sun T,Zhang Y,et al. 25-Hydroxyvitamin D serum level in Hashimoto′s thyroiditis,but not Graves disease is relatively deficient[J]. Endocr J,2017,64(6):581-587.
[13] 阎雪,徐佳琛,韩笑,等.石家庄地区儿童血清25羟VD水平的季节和年龄变化[J].营养学报,2017,39(1):37-40.
[14] 韩笑,阎雪,张亚男,等.石家庄市夏季汉族4月龄至14岁健康儿童血清25-羟维生素D和甲状旁腺素的关系[J].中国循证儿科杂志,2015,10(3):202-205.
[15] 刘向辉,阎雪,田旭,等.夏季高海拔地区儿童血清25羟维生素D水平分析[J].中国儿童保健杂志,2016,24(10):1113-1115.
[16] 阎雪,韩笑,张会丰.2016版“营养性佝偻病防治全球共识”解读[J].中华儿科杂志,2016,54(12):891-895.
[17] Yasuda T,Okamoto Y,Hamada N,et al. Serum vitamin D levels are decreased and associated with thyroid volume in female patients with newly onset Graves disease[J]. Endocrine,2012,42(3):739-741.
[18] Zhang H,Liang L,Xie Z. Low Vitamin D status is associated with increased thyrotropin-receptor antibody titer in Graves disease[J]. Endocr Pract,2015,21(3):258-263.
[19] Planck T,Shahida B,Malm J,et al. Vitamin D in Graves Disease: Levels,Correlation with Laboratory and Clinical Parameters,and Genetics[J]. Eur Thyroid J,2018,7(1):27-33.
[20] Ma J,Wu D,Li C,et al. Lower Serum 25-Hydroxyvitamin D Level is Associated With 3 Types of Autoimmune Thyroid Diseases[J]. Medicine(Baltimore),2015,94(39):e1639.
[21] Unal AD,Tarcin O,Parildar H,et al. Vitamin D deficiency is related to thyroid antibodies in autoimmune thyroiditis[J]. Cent Eur J Immunol,2014,39(4):493-497.
[22] Zhou P,Cai J,Markowitz M. Absence of a relationship between thyroid hormones and vitamin D levels[J]. J Pediatr Endocrinol Metab,2016,29(6):703-707.
[23] Alhuzaim ON,Aljohani N. Effect of vitamin d3 on untreated Graves disease with vitamin d deficiency[J]. Clin Med Insights Case Rep,2014,7:83-85.
[24] 雷艺,王小英,阳琰,等.Graves病患者血清25(OH)D水平变化及其临床意义[J].中国骨质疏松杂志,2017,23(4):473-476.
[25] Li X,Wang G,Lu Z,et al. Serum 25-hydroxyvitamin D predict prognosis in radioiodine therapy of Graves disease[J]. J Endocrinol Invest,2015,38(7):753-759.
[26] Meng S,He ST,Jiang WJ,et al. Genetic susceptibility to autoimmune thyroid diseases in a Chinese Han population: Role of vitamin D receptor gene polymorphisms[J]. Ann Endocrinol(Paris),2015,76(6):684-689.