呼吸衰竭(acute respiratory failure,ARF)是新生儿中常见的紧急危重症,其病情发展迅速,加上新生儿肺部发育尚不完善,如果不能及时改善通气,控制疾病的发展,容易导致不良事件的发生,甚至危及患儿生命安全[1]。为了迅速改善患儿缺氧,维持和增强肺内气体交换,临床通常采用机械通气的治疗方法[2-3],机械通气包含同步间歇指令通气(synchronized intermittent mandatory ventilation,SIMV)、有创高频振荡通气(high frequency oscillatory ventilation,HFOV)等。与SIMV相比,HFOV更有利于气体交换,可短时间内改善ARF患者肺顺应性,有效提高氧合,促进CO2的排除。在ARF发病过程中,CC16、KL-6可作为疾病治疗诊断的有效生物指标,CC16、KL-6在各类肺部疾病中均有明显异常表达,两者参与了肺内多种炎症、肿瘤发生和转移以及肺组织重建等[4-5]。 HFOV和SIMV均能明显改善慢性肺病变患者的临床症状,但二者治疗新生儿ARF以及对患儿CC16、KL-6水平影响的报道较少。因此,本研究分别采用高频振荡通气与同步间歇指令通气治疗新生儿ARF,并对2种治疗方法的临床效果以及对患儿CC16、KL-6水平的影响进行比较,旨在能为新生儿ARF的治疗提供临床依据。
1 资料与方法
1.1 一般资料 选择2015年2月—2017年8月河北省邯郸市第一医院收治的ARF新生儿130例,随机数字表法分为观察组和对照组各65例。观察组男性35例,女性30例;胎龄28~41周,平均(36.7±1.2)周;足月儿53例,早产儿12例;顺产41例,剖宫产24例;体重0.8~2.8 kg,平均(1.7±0.2)kg。对照组男性33例,女性32例;胎龄27~40周,平均(35.1±1.7)周;足月儿50例,早产儿15例;顺产42例,剖宫产23例;体重0.8~2.9 kg,平均(1.8±0.3)kg。2组早产儿比例、胎龄、性别、出生体重差异均无统计学意义(P>0.05),具有可比性。
本研究经医院伦理委员会审核通过。
1.2 纳入标准和排除标准 纳入标准:①患儿在出生后有三凹征、呻吟、中心性发绀、活动减少和呼吸率>60次/min等临床症状;②二氧化碳分压(pressure of carbon dioxide,PaCO2)>60 mm/Hg,在吸入氧浓度(fraction of inspiration O2,FiO2)为100%时氧分压(oxygen partial pressure,PaO2)<60 mmHg或氧饱和度<80%,动脉血pH<7.25;③患儿家属对本研究知情,并自愿签署知情同意书。排除标准:①存在心脏等器官先天性畸形或先天性功能障碍;②存在治疗禁忌证;③家属或患儿无法配合完成本研究者。
1.3 方法 患儿均给予Stephen科迪娜新生儿专用呼吸机进行机械通气治疗。对照组采用SIMV模式,依据动脉血气分析等调整呼吸机参数,初始参数设定为:FiO2 25%~100%,气道平台压<15 cmH2O,气道峰压18~26 cmH2O,通气量4~10 L/min,潮气量6~8 mL/kg,呼吸频率20~50次/min。观察组采用HFOV模式,初始参数设定为:FiO230%~100%,平均气道压8~16 cmH2O,振荡压力27~40 cmH2O,频率9~15 Hz,振荡至患儿脐部为宜。机械通气治疗过程中,应根据患儿具体病情适当调节呼吸机参数,以维持患儿血气稳定,并作好防感染、出血控制,维持好患儿机体内环境稳定和给予营养支持等。
1.4 观测指标
1.4.1 临床疗效评估标准[6] 患儿在治疗结束后进行临床疗效评估。有效:临床症状消失或改善,氧合指标改善。无效:病情无改善甚至加重。统计2组经口喂养时间、呼吸机使用时间和住院时间。
1.4.2 血气分析 在机械通气0 h、24 h和72 h分别记录2组动脉血气指标PaCO2、PaO2和FiO2,并计算氧合指数(oxygenation index,OI)、呼吸指数(respiratory index,RI)和PaO2/FiO2。
1.4.3 血清CC16和KL-6水平检测 所有患儿在治疗前后1 d于清晨空腹状态下抽取5 mL静脉血,3 000 r/min离心10 min取上清,-70 ℃保存待测。采用酶联免疫吸附测定法检测血清CC16和KL-6水平,CC16、KL-6试剂盒均购自上海生工生物工程有限公司,所有操作均严格按照试剂盒说明书进行。CC16正常值为<0.35 ng/L,KL-16正常值为<100 kU/L。
1.4.4 不良反应发生情况 对患儿可能出现的肺出血、呼吸机相关性肺炎、下呼吸道感染等不良反应发生情况进行统计。
1.5 统计学方法 应用SPSS 13.0统计软件分析数据。计量资料比较分别采用两独立样本的t检验、配对t检验和重复测量采用的方差分析;计数资料比较采用χ2检验。 P<0.05为差异有统计学意义。
2 结 果
2.1 2组临床疗效比较 观察组总的临床有效率为90.8%(59/65),明显高于对照组的80.0%(52/65)(χ2=5.604,P=0.018)。2组足月儿治疗有效率优于早产儿(χ2=6.160,P=0.013)。观察组经口喂养时间、呼吸机使用时间和住院时间均明显短于对照组,差异有统计学意义(P<0.05)。见表1。
表1 2组临床疗效比较
Table 1 Comparison of clinical effects between two groups (n=65)
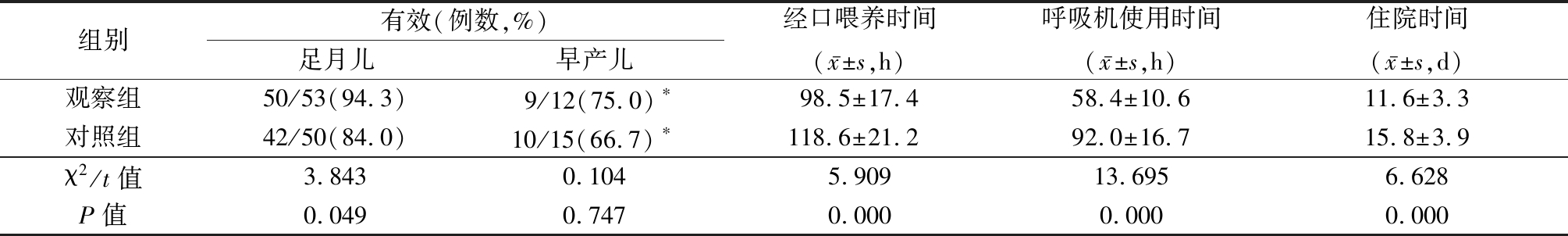
组别有效(例数,%)足月儿早产儿经口喂养时间(x-±s,h)呼吸机使用时间(x-±s,h)住院时间(x-±s,d)观察组50/53(94.3)9/12(75.0)∗98.5±17.458.4±10.611.6±3.3对照组42/50(84.0)10/15(66.7)∗118.6±21.292.0±16.715.8±3.9χ2/t值3.8430.1045.90913.6956.628P值0.0490.7470.0000.0000.000
*P值<0.05与足月儿比较(χ2检验)
2.2 2组OI、RI、PaCO2、PaO2和PaO2/FiO2比较 机械通气后2组OI、RI和PaCO2均呈逐渐下降趋势,2组PaO2和PaO2/FiO2均呈逐渐升高趋势,但观察组降低和升高的幅度更大,2组在组间、时点间以及组间·时点间交互作用差异均有统计学意义(P<0.05),见表2。
2.3 2组治疗前后血清CC16和KL-6水平比较 治疗前,2组血清CC16和KL-6水平差异均无统计学意义(P>0.05);治疗后,2组血清CC16和KL-6均较治疗前明显降低(P<0.05),观察组CC16和KL-6水平均明显低于对照组(P<0.05)。见表3。
2.4 2组不良反应发生率比较 观察组肺出血、呼吸机相关性肺炎、下呼吸道感染等不良反应发生率均明显低于对照组(P<0.05),见表4。
Table 2 Comparison of OI,RI,PaCO 2 PaO 2 and PaO 2 /FiO 2 between two groups
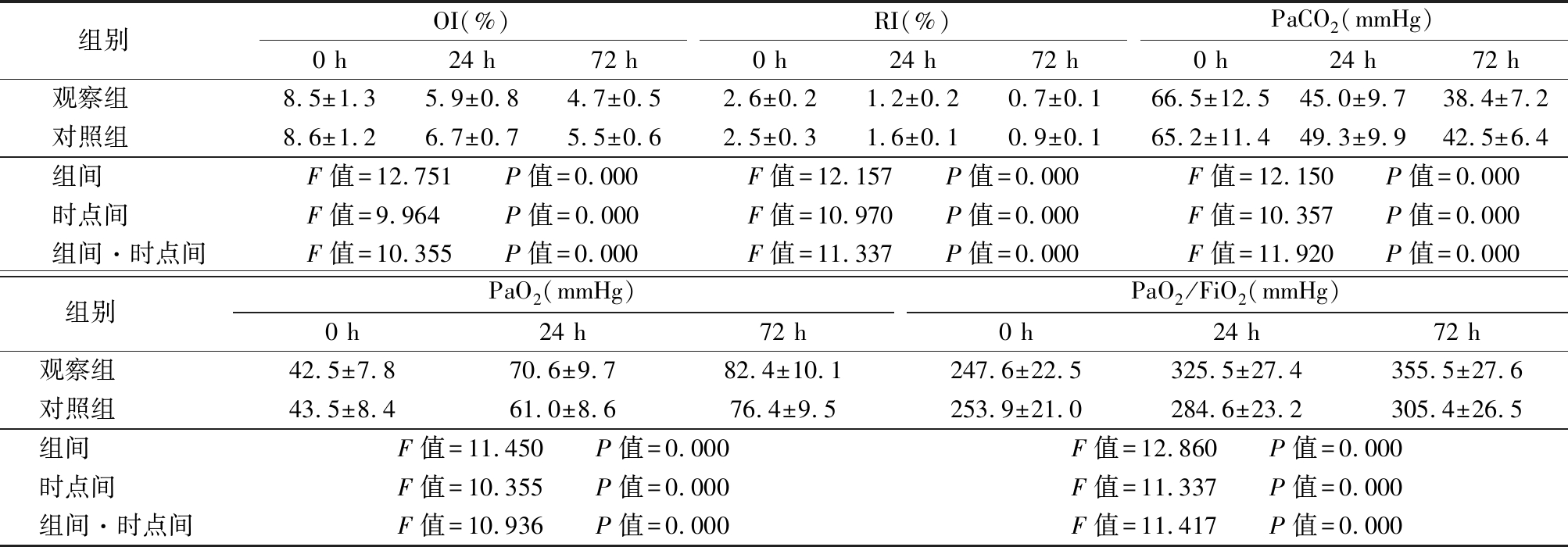
组别 OI(%)0 h24 h72 hRI(%)0 h24 h72 hPaCO2(mmHg)0 h24 h72 h观察组 8.5±1.35.9±0.84.7±0.52.6±0.21.2±0.20.7±0.166.5±12.545.0±9.738.4±7.2对照组 8.6±1.26.7±0.75.5±0.62.5±0.31.6±0.10.9±0.165.2±11.449.3±9.942.5±6.4组间 F值=12.751 P值=0.000F值=12.157 P值=0.000F值=12.150 P值=0.000时点间 F值=9.964 P值=0.000F值=10.970 P值=0.000F值=10.357 P值=0.000组间·时点间F值=10.355 P值=0.000F值=11.337 P值=0.000F值=11.920 P值=0.000组别 PaO2(mmHg)0 h24 h72 hPaO2/FiO2(mmHg)0 h24 h72 h观察组 42.5±7.870.6±9.782.4±10.1247.6±22.5325.5±27.4355.5±27.6对照组 43.5±8.461.0±8.676.4±9.5253.9±21.0284.6±23.2305.4±26.5组间 F值=11.450 P值=0.000F值=12.860 P值=0.000时点间 F值=10.355 P值=0.000F值=11.337 P值=0.000组间·时点间F值=10.936 P值=0.000F值=11.417 P值=0.000
Table 3 Comparison of serum CC16 and KL-6 levels before and after treatment between two groups
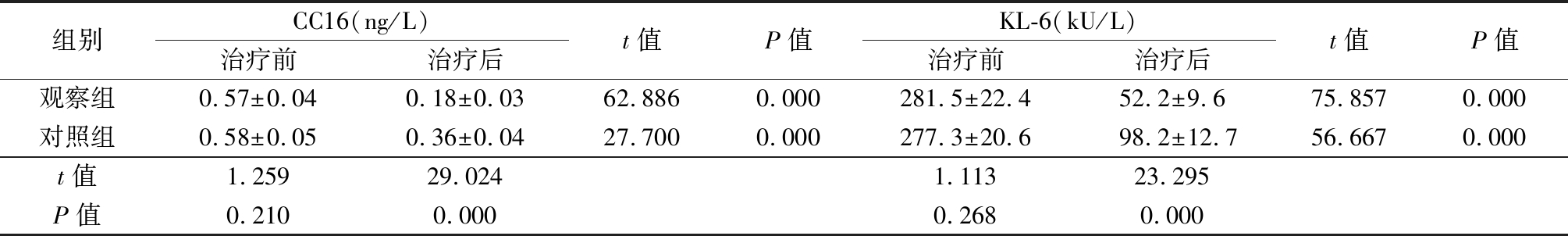
组别CC16(ng/L)治疗前治疗后t值P值KL-6(kU/L)治疗前治疗后t值P值观察组0.57±0.040.18±0.0362.8860.000281.5±22.452.2±9.675.8570.000对照组0.58±0.050.36±0.0427.7000.000277.3±20.698.2±12.756.6670.000t值1.25929.0241.11323.295P值0.2100.0000.2680.000
表4 2组不良反应比较
Table 4 Comparison of adverse reactions between two groups (n=65,例数,%)
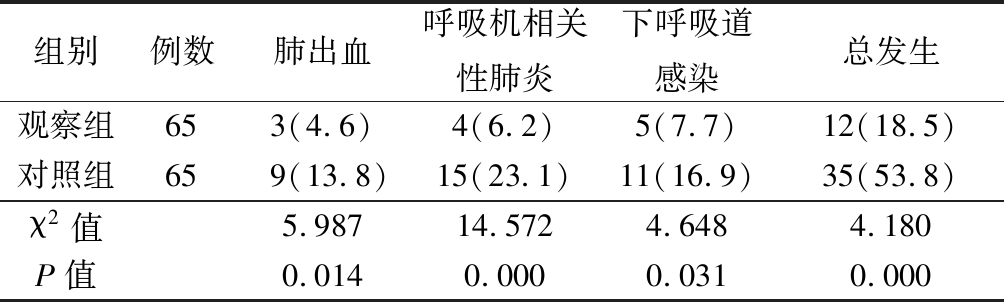
组别例数肺出血呼吸机相关性肺炎下呼吸道感染总发生观察组653(4.6)4(6.2)5(7.7)12(18.5)对照组659(13.8)15(23.1)11(16.9)35(53.8)χ2值5.98714.5724.6484.180P值0.0140.0000.0310.000
3 讨 论
新生儿由于肺部气道阻力高、储备功能相对较弱、发育还不完善等因素,导致肺表面活性物质(pulmonary surfactant,PS)的合成受到影响,呼吸肌容易出现疲劳的情况, 致使ARF在新生儿中发生率较高。有研究显示,ARF是造成新生儿死亡的主要因素之一,尤其对于早产儿来讲,ARF是早产儿出生3 d内死亡的最大疾病因素[7]。ARF患儿的主要临床表现是呼吸困难,伴有皮肤青紫、发绀等缺氧症状,患儿气道阻塞,无法有效进行气体交换,引发“三凹征”[8]。由于肺部换气、通气功能受到阻碍,导致新生儿机体出现CO2潴留和缺氧,各器官代谢出现紊乱,生理功能受到明显抑制。
临床上,通常采用机械通气治疗新生儿ARF,机械通气能够通过压力使氧气顺利进入患儿肺部进行气体交换,帮助患儿建立稳定的呼吸通路,改善患儿的缺氧情况[9]。HFOV以超生理呼吸频率、低周期压力变化的震荡产生双相的压力变化,可以使得肺泡在短时间内均匀膨胀,不增加气压伤的同时改善患儿肺顺应性和气体交换,加快CO2的排除和氧气融合[10-11],相比于SIMV能够降低和预防患儿机械通气带来的肺部损伤,提高患儿存活率。血气检测是ARF治疗过程中肺功能检测的主要指标。OI反映了ARF患儿换气通气效果以及ARF的严重程度,RI则提示了患儿肺部实际的氧合水平,PaO2反映了机体低氧血症程度,PaO2 /FiO2是患儿吸氧下的缺氧情况,体现了肺泡和肺毛细血管的损伤情况[12-14]。本研究观察组总的临床有效率(90.8%)明显高于对照组(80.0%),患儿经口喂养时间、呼吸机使用时间和住院时间均明显短于对照组(P<0.05),提示采用HFOV治疗新生儿ARF疗效更佳;其中足月儿治疗有效率优于早产儿(P<0.05),说明早产儿ARF的疾病程度更加严重,在针对早产儿治疗时,更要密切关注患儿临床体征、病征的变化情况,帮助患儿更快的康复。本研究结果显示,机械通气0 h,2组患儿各血气指标差异无统计学意义(P>0.05);随着机械通气时间增加,2组OI、RI和PaCO2逐渐升高,PaO2和PaO2 /FiO2逐渐降低,且观察组OI、RI和PaCO2明显低于对照组,PaO2和PaO2 /FiO2明显高于对照组(P<0.05)。提示HFOV更有助于改善氧合水平,提升动脉氧分压,提升患儿肺部PS水平,帮助肺泡均匀扩张,避免萎缩塌陷,促进CO2排除,改善肺顺应性和气体交换,这可能与HFOV能够短时间内增加氧供和减少气道压力有关。黄佳[15]研究显示,在新生儿重症监护病房中应用有创高频振荡通气治疗ARF等疾病是有效和安全的,可改善通气,纠正血流通气失调,提高氧分压,改善通气/血流比值。本研究结果与其相似。HFOV相比于SIMV所需的FiO2更低,但却能更好地维持氧合水平,在提高PaO2 /FiO2的同时,还能减少氧中毒的发生,HFOV患儿肺部肺泡压和潮气量低于SIMV,能够很好地降低肺血管阻力和打开肺泡,改善通气/血流比值[16]。
CC16能够拮抗外源性异物蛋白,具有很好的抗炎作用。KL-6是一种Ⅱ型肺泡的上皮细胞中表达的炎性介质,对于肌纤维母细胞等特定细胞具有较强的趋化作用[17]。在受损伤的肺组织中CC16和KL-6水平迅速上升,并与病情严重程度存在显著的正相关性。由于ARF患儿酸中毒、缺氧等对肺泡上皮细胞和肺血管内皮细胞的损害,导致肺间质和肺泡水肿,肺毛细血管通透性增加,肺泡Ⅱ型细胞遭受损害。肺泡Ⅱ型细胞是PS合成释放的重要场所,肺泡Ⅱ型细胞的大量凋亡导致内源性PS活性降低,分泌减少,进而致使氧合水平降低,肺功能受损。因此,在ARF患儿肺组织中同样存在CC16和KL-6显著升高的情况,且与疾病严重程度存在显著的相关性。本研究结果显示,治疗后2组血清CC16和KL-6均较治疗前明显降低(P<0.05),且观察组明显低于对照组(P<0.05)。这与HFOV相较于SIMV能显著减轻肺组织的损伤和炎症反应有关。 HFOV能够通过共振效应增加肺泡通气,减少气道阻力,促进呼吸道纤毛运动,促进肺部炎症异物等的排出。本研究结果还显示,观察组肺出血、呼吸机相关性肺炎、下呼吸道感染等不良反应发生率明显著低于对照组(P<0.05)。实施HFOV治疗能明显提升氧合水平,有效改善患儿换气通气能力,相比于SIMV明显减少了患儿发生感染的机会,提高了临床安全性。HFOV气压更适合ARF患者,可增加血氧分压,使肺泡扩张到最佳状态,减少了气管插管过程中的风险,更加舒适。
综上所述,HFOV治疗新生儿疗效显著,能够显著改善患儿血气指标,降低患儿CC16、KL-6水平,改善肺部损伤,不良反应较少。
[1] 赖娟,杜立中,熊国强,等.1108例新生儿呼吸衰竭的临床流行病学特征[J].中国当代儿科杂志,2016,18(1):10-14.
[2] Ruggeri P,Calcaterra S,Bottari A,et al. Successful management of acute respiratory failure with noninvasive mechanical ventilation after drowning,in an epileptic-patient[J]. Respir Med Case Rep,2016,17:90-92.
[3] Rémond C,Alliana C,Jonckheer K,et al. Ventilation for thoracic surgery in the newborn: don't forget high frequency oscillatory ventilation[J]. Anaesth Crit Care Pain Med,2018,37(5):467-468.
[4] 张学城,陈东.围急性呼吸窘迫综合征血清CC16蛋白水平的预警意义[J].罕少疾病杂志,2016,23(5):11-12.
[5] 任登华,丁晶晶,蔡后荣,等.血清KL-6水平在间质性肺疾病诊断中的价值研究[J].中国呼吸与危重监护杂志,2015,14(5):468-473.
[6] 邵肖梅,叶鸿瑁,邱小汕.实用新生儿学[M].4版.北京:人民卫生出版社,2011:395-398.
[7] 马景斌.经鼻持续正压通气配合肺表面活性物质治疗新生儿急性呼吸衰竭疗效观察[J].现代中西医结合杂志,2015,24(8):835-837.
[8] 康利娜,成芳,安红,等.雾化吸入重组人干扰素α1b治疗小儿毛细支气管炎的临床观察[J].中国药房,2016,27(6):758-759,760.
[9] Martín-Gonz lez F,Gonz
lez F,Gonz lez-Robledo J,S
lez-Robledo J,S nchez-Hern
nchez-Hern ndez F,et al. Effectiveness and predictors of failure of noninvasive mechanical ventilation in acute respiratory failure[J]. Med Intensiva,2016,40(1):9-17.
ndez F,et al. Effectiveness and predictors of failure of noninvasive mechanical ventilation in acute respiratory failure[J]. Med Intensiva,2016,40(1):9-17.
[10] Mat Nor MB,Md Ralib A,Ibrahim NA,et al. High frequency oscillatory ventilation in leptospirosis pulmonary hemorrhage syndrome:a case series study[J]. Indian J Crit Care Med,2016,20(6):342-348.
[11] Li QJ,Yuan Y,Li YM,et al. Effect of high frequency oscillatory ventilation on EVLW and lung capillary permeability of piglets with acute respiratory distress syndrome caused by pulmonary and extrapulmonary insults[J]. J Huazhong Univ Sci Technology Med Sci,2015,35(1):93-98.
[12] 刘兴安,冯秀华.BiPAP呼吸机在COPD呼吸衰竭治疗中的应用[J].医学动物防制,2005,21(3):162-163.
[13] 陈晓雪,宋德刚,孙立娟.Tei指数评价双水平正压通气治疗COPD并发呼吸衰竭患者的右心功能[J].河北医科大学学报,2017,38(4):450-453,457.
[14] 盛艳玲,李红,田涛,等.目标潮气量无创机械通气治疗慢性阻塞性肺疾病Ⅱ型呼吸衰竭的疗效观察[J].河北医科大学学报,2015,36(9):1006-1009.
[15] 黄佳.新生儿无创高频振荡通气的研究进展[J].中国当代儿科杂志,2017,19(5):607-611.
[16] 杜立中.新生儿高频机械通气[J].中国实用儿科杂志,2016,31(2):99-103.
[17] 王冉冉,朱剑,张江林.KL-6在间质性肺疾病诊治中的研究进展[J].解放军医学杂志,2017,42(4):354-357.