血液肿瘤亦称血液恶性肿瘤,虽然在儿童期的发生率较低,但呈逐年上升的趋势,是造成儿童死亡的原因之一[1]。由于儿童时期肿瘤代谢应激与生长发育等因素,患儿出现营养消耗与进行性体重降低的情况极为常见[2]。营养不良会对患儿组织器官产生直接损害,免疫功能减弱,增加感染风险及病死率,延长住院时间,升高医疗费用。因此,及早发现营养不良,给予营养支持,对改善血液肿瘤患儿预后具有重要意义。本研究应用中文版儿童营养不良风险评分表(Chinese Version Paediatric Yorkhill Malnutrition Score,CVPYMS)筛查血液肿瘤住院患儿营养风险及营养不良发生状况,并分析其影响因素,旨在为临床开展营养风险初筛项目、合理评估营养状况提供依据,报告如下。
1 资料与方法
1.1 一般资料 采用便利抽样方法选取2015年1—10月石家庄地区3所综合医院儿童血液内科住院血液肿瘤患儿350例。男性219例(62.57%),女性131例(37.43%);年龄1~16岁,中位年龄5岁;急性淋巴细胞白血病199例(56.86%),非霍奇金淋巴瘤27例(7.71%),急性非淋巴细胞白血病98例(28.00%),霍奇金淋巴瘤16例(4.57%),淋巴肉瘤白血病2例(0.57%),其他8例(2.29%)。纳入标准:符合血液肿瘤诊断标准的非ICU住院患儿;住院时间>24 h;年龄1~16岁;患儿家属知情同意。排除标准:胸腔积液、腹腔积液、水肿等不能准确获得体重者;刻意减肥患儿。
1.2 研究工具
1.2.1 调查表 自行设计调查表,调查住院患儿基本情况,由4个部分组成:①导读语,解释本次调查的目的、内容、填写要求及注意事项;②患儿一般资料及疾病情况,包括性别、年龄、居住地、医疗缴费方式、疾病主要诊断、化疗次数、肿瘤分期等;③住院患儿家庭情况,包括家庭人均月收入、带养人与患儿的关系、带养人的文化水平等;④住院患儿喂养情况,包括喂养方式、饮食习惯等。
1.2.2 CVPYMS[3] 各条目得分与总分之间的相关系数在0.438~0.756之间(P<0.01),评价结果的一致性Kappa系数为0.827。CVPYMS适用于1~16岁住院儿童,用于检测蛋白质-能量营养不良。评分表由4项指标组成,包括体重指数、近3个月内体重变化、1周内膳食摄入情况、疾病严重程度。总评分为4项指标的得分之和,总评分0分提示无/低度营养不良风险;1分提示中度营养不良风险;≥2分提示存在高度营养不良风险。
1.2.3 营养不良体格诊断标准 参照WHO 生长标准:①体重/年龄 1.2.4 营养不良分级标准 按照中国儿科肠内肠外营养支持临床应用指南营养不良分级标准[4]:身高/体重在80%~90%为轻度营养不良,70%~79%为中度营养不良,<70%为重度营养不良。 1.3 资料收集方法 1.3.1 预调查 研究者提前与郑显兰教授取得联系,获得CVPYMS并授权使用。于2014年9—12月,选取符合标准的100例患儿进行预调查。结果显示CVPYMS接受率为100%,其评估时间在6 min以内,表明CVPYMS可行性较好。 1.3.2 正式调查 本研究为横断面调查研究。对符合纳入标准的血液肿瘤住院患儿,由经过培训的责任护士于入院48 h内进行基本情况调查、营养风险筛查及营养状况评估。筛查前征得患儿家长同意,向家长说明目的及意义。 1.3.3 质量控制 ①体重测量应用RGZ-50型儿童专用坐式体重秤(1~3岁)和RGZ-120-RT型站式体重计(3岁以上),患儿体重精确到0.1 kg;②身高用SH-8093型婴儿量床(1~3岁)和RGZ-120-RT型身高计(3岁以上),患儿身高精确到0.1 cm;③各患儿必须重复测量2次,并选取平均值;④无法活动或者昏迷患儿需要由父母先抱患儿一同称重,并对父母体重单独测量,取两者的差值;⑤不能准确获得身高者,测量人员在生长曲线图上标注体重值,如果低于第2百分位,则第一项指标中评为2分,并记录不能准确获得身高的原因。 1.4 统计学方法 应用SPSS 19.0统计软件分析数据。等级资料比较采用秩和检验;影响因素确定采用多因素Logistic回归分析。P<0.05为差异有统计学意义。 2.1 患儿营养风险及营养不良发生情况 依据CVPYMS,总评分≥2分的存在高度营养风险患儿69例(19.72%),总评分1分的存在中度营养风险患儿249例(71.14%),总评分0分的存在低度营养风险患儿32例(9.14%)。根据中国儿科肠内肠外营养支持临床应用指南营养养不良分级标准,350例患儿营养风险检出率为90.85%,其中69例高度营养风险患儿中轻度营养不良患儿49例(71.01%)、中度18例(26.09%)、重度2例(2.90%),249例中度营养风险患儿中轻度营养不良12例(4.82%),其余无营养不良发生。350例患儿营养不良检出率是5.71%,其中中度营养不良18例(5.14%),重度营养不良2例(0.57%)。 2.2 不同特征患儿营养风险状况比较 随年龄增加营养风险减少,随化疗次数增加、肿瘤分期加重营养风险增加,差异均有统计学意义(P<0.05);不同性别、居住地、缴费方式、肿瘤类型、患儿带养人、带养人文化程度、家庭月收入间营养风险差异均无统计学意义(P>0.05)。见表1。 表1 不同特征血液肿瘤住院患儿营养风险状况比较 指标例数低度营养风险(n=32)中度营养风险(n=249)高度营养风险(n=69)Z/Hc值P值性别 男性 女性21913120(9.13)12(9.16)152(69.41)97(74.05)47(21.46)22(16.79)-0.8400.401年龄 1~3岁 4~6岁 7~11岁 12~16岁1699847369(5.33)13(13.26)7(14.89)3(8.33)118(69.82)70(71.43)34(72.34)27(75.00)42(24.85)15(15.31)6(12.77)6(16.67)16.2910.000居住地 农村14013(9.29) 97(69.28)30(21.43) 乡镇859(10.59)56(65.88)20(23.53)0.9520.621 地级市12510(8.00) 96(76.80)19(15.20)缴费方式 自费 医保/新农合10924111(10.09)21(8.71)76(69.73)173(71.79)22(20.18)47(19.50)0.0080.927肿瘤类型 急性淋巴细胞白血病 急性非淋巴细胞白血病 非霍奇金淋巴瘤 淋巴肉瘤白血病 霍奇金淋巴瘤 其他1999827 216 8 18(8.94) 8(8.22) 3(11.11) 1(50.00)1(6.25)0(0.00)135(68.16)75(76.71)19(70.37)0(0.00)13(82.64) 5(62.50)46(22.90)15(15.07)5(18.52)1(50.00)2(11.11)4.5990.467化疗次数 首诊7513(17.33)56(74.67)6(8.00) <5次13511(8.15)96(71.11)28(20.74)12.3820.002 ≥5次1408(5.71)96(68.57)36(25.72)肿瘤分期 早期1239(7.32)96(78.05)18(14.63) 中期19818(9.09)138(69.70)42(21.21)7.0340.030 晚期29 5(17.24)15(51.72)9(31.04)患儿带养人 父亲/母亲 爷爷奶奶/外公外婆22512519(8.44)13(10.40)160(71.11)89(71.20)46(20.45)23(18.40)0.4470.504 表1 (续) 带养人文化程度 初中23124(10.39)158(68.40)49(21.21) 高中755(6.67)56(74.67)14(18.66)2.8460.241 大专443(6.81)35(79.55)6(13.64)家庭收入 >3 000元/月 917(7.69)71(78.02)13(14.29) 1 000~3 000元/月71 8(11.27)51(71.83)12(16.90)3.8530.146 <1 000元/月18817(9.05)127(67.55)44(23.40) 2.3 患儿营养风险状况影响因素的多因素Logistic回归分析 以营养风险为自变量,以年龄、化疗次数、肿瘤分期为因变量,进行多因素Logistic回归分析,结果显示年龄、化疗次数和肿瘤分期是血液肿瘤患儿发生营养不良风险的影响因素。在控制其他影响因素的前提下,年龄每提高一个年龄段,营养风险提高一个或一个以上等级的可能性就降低50.9%;化疗次数每提高一个等级,营养风险提高一个或一个以上等级的可能性增加73.2%;肿瘤分期每提高一个等级,营养风险提高一个或一个以上等级的可能性增加85.0%。年龄越小、化疗次数越长、肿瘤分期越高,发生营养风险的概率越大。见表2,3。 表2 变量赋值 变量 赋值年龄 1~3岁=1,4~6岁=2,7~11岁=3,12~16岁=4肿瘤分期早期=1,中期=2,晚期=3化疗次数首诊=1,<5次=2,≥5次=3 营养风险低度=1,中度=2,高度=3 表3 血液肿瘤住院患儿营养风险状况影响因素的Logistic回归分析 自变量回归系数标准误Wald χ2值P值OR值95%可信区间下限上限常数项 1.0991.154 0.9060.340年龄 -0.7050.2975.6350.0370.4910.2760.884化疗次数0.5490.275 3.9860.0461.7321.0102.968肿瘤分期0.6150.263 5.4680.0421.8501.1053.097 3.1 血液肿瘤住院患儿营养风险及营养不良状况不容忽视 营养不良可导致患儿生长发育落后,影响疾病预后,延长住院时间。血液肿瘤患儿由于疾病本身的原因和临床上应用特殊的治疗方法(如化疗),使机体对各种营养素的需求量、排出量产生明显变化;同时由于化疗药物的不良反应,如食欲不振、恶心、呕吐、腹泻等使患儿难以正常进食,导致患儿产生不同程度的营养不良。Antillon等[5]研究显示,营养不良患儿在确诊后的前6个月改善营养状况,其生存概率可能显著提高,接近于无营养不良患儿。为此,临床医生与护理人员应当提高对肿瘤住院患儿营养状态的重视程度,并作好相应的营养支持工作。考虑到不同肿瘤住院患儿的病情和营养状况各不相同,是否需要进行营养支持以及如何给予营养支持也存在较大的差异。因此,患儿进行营养支持前,首先需要对患儿进行全面细致的营养筛查,给出科学的营养指导意见,改善临床疾病结局,节省医疗开支。本研究采用CVPYMS调查350例血液肿瘤住院患儿,发现350例患儿高度营养风险率为19.72%,中度营养风险率为71.14%,低度营养风险率为9.14%;350例患儿中营养不良率为5.17%,69例高度营养风险患儿中,轻度营养不良49例、中度营养不良18例、重度营养不良2例;中度营养风险患儿中轻度营养不良12例。与国内外多项研究结果一致[6-9]。随着机体应激状态和肿瘤组织不断增殖,机体营养不断消耗,其中45%~80%恶性肿瘤患儿并发营养不良[10],初诊时有6%~50%患儿出现急性营养不良,在长期治疗过程中有8%~32%患儿发生营养不良[11]。由此可见,血液肿瘤住院患儿具有较差的营养状况。临床医护人员需高度重视该疾病患儿营养问题,积极实施营养风险筛查,及时发现潜在营养风险或营养不良患儿,及早制定相应的营养策略[12-13]。 3.2 血液肿瘤住院患儿当中不同年龄阶段发生营养不良风险不同 本研究结果显示,1~3岁患儿营养风险构成比例最高,12~16岁患儿其次,而且各年龄组患儿营养风险程度也有所不同(P<0.05)。1~3岁患儿处在幼儿阶段,该时期患儿体格发育与生长速度相对婴儿阶段较为缓慢,由于消化功能不成熟,不恰当的饮食结构会影响到患儿的营养状况,如锌等微量元素及蛋白质摄入不足造成营养不良。同时,幼儿阶段患儿活动量明显增加,对外界事物探索欲强,活泼好动,易注意力不集中造成进食量减少。婴幼儿住院期间相比大年龄儿童更易发生营养状况恶化,这也是3岁以下患儿营养不良发生率最高的原因。其次,12~16岁患儿逐渐向青春期过渡,所需营养素相应增加,易导致营养缺失。此外,心理因素对患儿营养不良的发生也产生一定影响[14]:逐步进入青春期的患儿内心十分敏感,对疾病已有较明确的认识,恐惧、焦虑、抑郁等情绪均会影响患儿的食欲及食物摄入,从而降低能量摄入。因此,血液肿瘤住院患儿在生长发育高峰期具有较高的营养风险程度,易发生营养不良。 3.3 化疗≥5次患儿发生营养不良风险较高 本研究结果表明,化疗≥5次的患儿高度营养风险构成比最高,其次是化疗<5次的患儿,不同化疗次数患儿的营养风险状况差异有统计学意义(P<0.05)。Higashiyama等[15]曾对多例肿瘤患儿进行调查研究发现,随着化疗次数的增多出现营养不良的概率越高,且化疗强度越大,化疗后骨髓抑制越重,营养不良发生率越高。化疗导致患儿营养风险高的原因主要包括:①化疗可导致严重胃肠道反应,由于食欲不振、恶心、呕吐、腹泻等造成摄入量减少;②个别药物可引起肠梗阻等;③化疗药物对机体代谢产生影响,不同程度地扰乱糖、蛋白质、脂质代谢,使得机体对各种营养素的需求量、排出量均产生明显变化。 3.4 晚期肿瘤患儿发生营养不良风险较高 本研究结果显示,晚期肿瘤患儿营养风险发生率明显高于早期者(P<0.05)。可能与晚期肿瘤已发生转移,肿瘤细胞快速无抑制性生长,对化疗不敏感,造成体内负荷超载,对营养素的消耗过大有关[16]。晚期肿瘤患儿的营养不良是临床上难以解决的常见问题,会影响肿瘤患儿免疫功能、造血功能,增加患儿感染风险,使其对化疗的耐受性降低,并导致复发率增高、生存率降低等不良预后。护理人员在营养筛查、干预及教育等营养支持方面发挥着重要作用。应建立营养筛查和评估的相应护理标准。通过营养筛查或风险评估尽早预测出营养不良高危人群,及时实施营养支持等干预,从而减少营养不良并发症及危害。 综上所述,血液肿瘤住院患儿营养风险发生率较高,高度营养风险患儿是极易出现营养不良的群体。年龄、化疗次数、肿瘤分期是对患儿营养风险程度产生影响的关键因素。由于对血液肿瘤患儿营养风险产生影响的因素本身存在复杂性,故本研究未涉及到所有因素,对血液肿瘤患儿营养风险产生影响的因素尚需进一步探讨。 [1] Paviglianiti A,Dalle JH,Ayas M,et al. Low Body Mass Index Is Associated with Increased Risk of Acute GVHD after UmbilicalCord Blood Transplantation in Children and Young Adults with Acute Leukemia:a Study on Behalf of Eurocord and the EBMT Pediatric Disease Working Party[J]. Biol Blood Marrow Transplant,2017,24(4):799-805. [2] Han Y,Zhang F,Wang J,et al. Application of Glutamine-enriched nutrition therapy in childhood acute lymphoblastic leukemia[J]. Nutr J,2016,15(1):65. [3] 于圣娟.住院患儿营养风险筛查及影响因素分析[D].重庆:重庆医科大学,2013. [4] 中华医学会肠外肠内营养学分会儿科协作组.中国儿科肠内肠外营养支持临床应用指南[J].中华儿科杂志,2010,48(6):436-441. [5] Antillon F,Rossi E,Molina AL,et al. Nutritional status of children during treatment for acute lymphoblastic 1eukemia in Guatemala[J]. Pediatr Blood Cancer,2013,60(6):911-915. [6] 洪莉.住院患儿营养风险筛查工具介绍[J].中国小儿急救医学,2015,23(2):77-81. [7] Barr RD,Gomez-Almaguer D,Jaime-Perez JC,et al. Importance of nutrition in the treatment of leukemia in children and adolescents[J]. Arch Med Res,2016,47(8):585-592. [8] 陈冯秀.住院患儿营养风险筛查及影响因素分析[D].福州:福建医科大学,2015. [9] 于圣娟,郑显兰,郭蓉.住院患儿营养风险筛查及影响因素分析[J].护士进修杂志,2013,28(10):872-874. [10] 李荣,彭璐婷,赵卫华,等.先天性心脏病住院患儿营养风险筛查及其临床意义[J].中华小儿外科杂志,2013,34(2):101-104. [11] 何冰洁.住院患儿营养风险筛查及营养评估的临床应用研究[D].广州:南方医科大学,2015. [12] 杜红珍.恶性肿瘤患者营养状况及食欲评价研究[D].石家庄:河北医科大学,2017. [13] Collins L,Beaumont L,Cranston A,et al. Anthropometry in long-term survivors of acute lymphoblastic leukemia in childhood and adolescence[J]. J Adolesc Young Adult Oncol,2017,6(2):294-298. [14] 熊琴,段丽,雷辉,等.150例住院患儿的营养风险筛查结果及分析[J].中国医药科学,2014,4(12):44-46. [15] Higashiyama Y,Kojima C,Kubota M,et a1.Longitudinal nutritional assessment in acute lymphoblastic leukemia during treatment[J]. Pediatr Int,2014,56(4):541-546. [16] 张晓峰,苏宁,贾若苹,等.营养干预对老年肿瘤患者营养状况及生活质量的影响[J].河北医科大学学报,2014,35(3):297-300.2 结 果
Table 1 Comparison of nutritional risk among hospitalized children with different characteristics of hematological tumors (例数,%)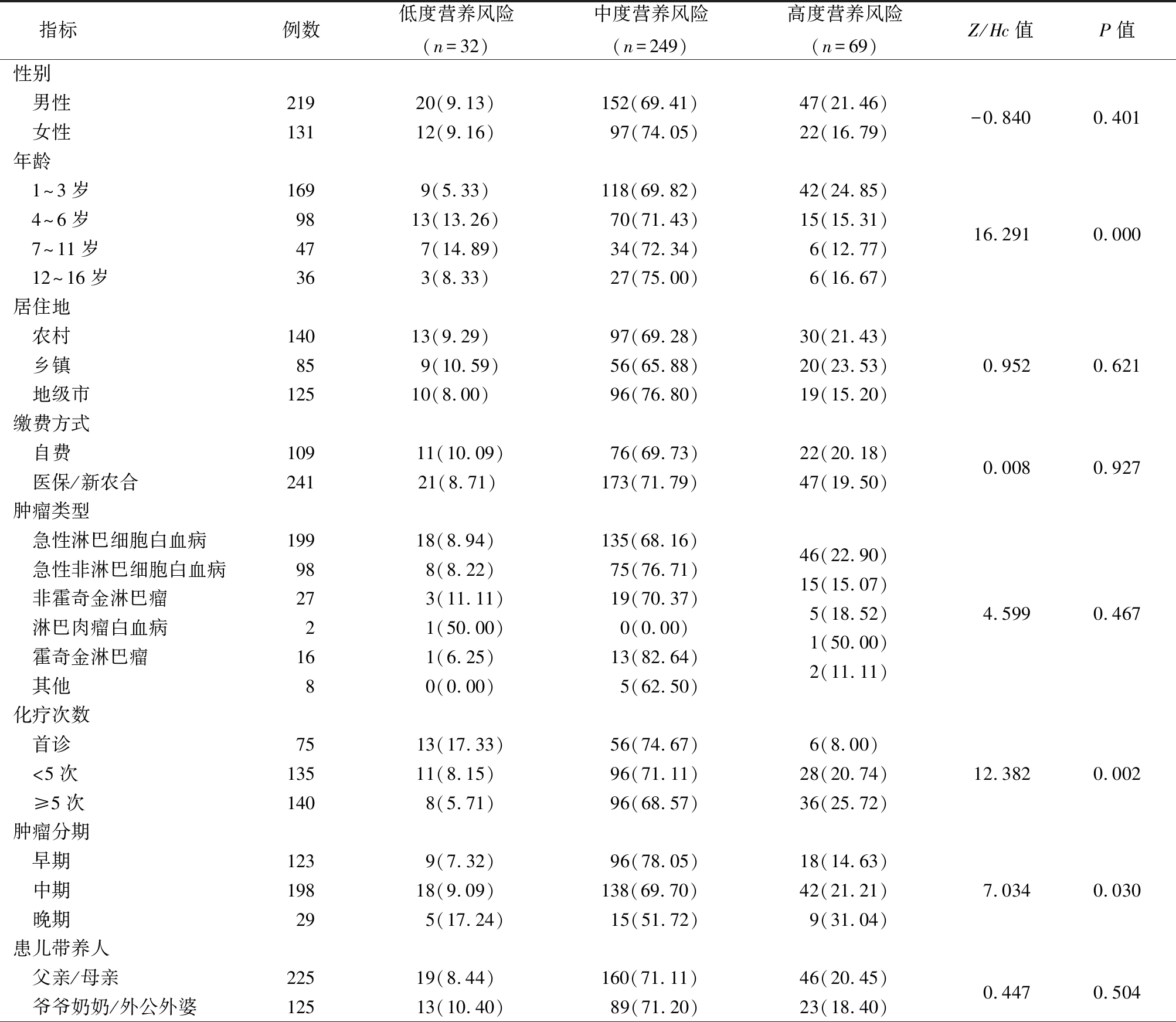
Table 2 Variable assignment
Table 3 Logistic regressionanalysis of factors affecting the nutrition risks in hospitalized children withhematological tumor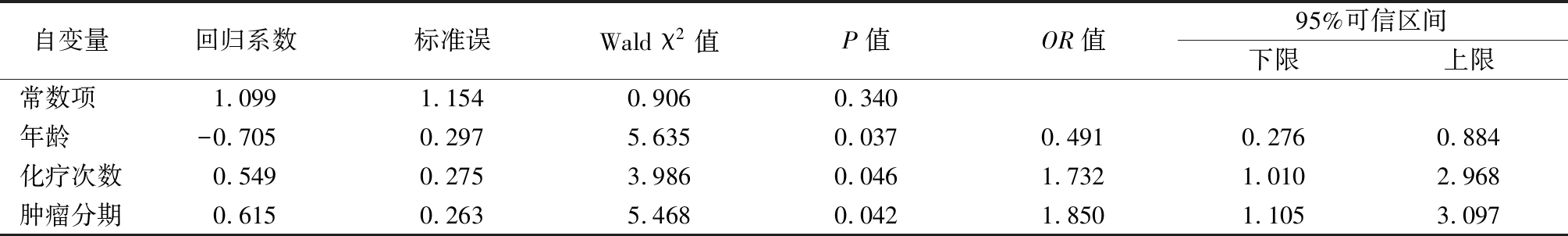
3 讨 论