孤立性肺结节( solitary pulmonary nodule,SPN)是指单个、边界清楚的直径≤3 cm的肺部实质性结节病变,不伴肺炎、淋巴结肿大、肺不张等,是肺癌病变早期的重要影像学表现。SPN的影像学表现较为复杂多样化,恶性率较高,但也可见于部分良性病变,故其临床诊断具有一定难度,较难定性[1]。随着影像学技术的发展,与常规CT相比,高分辨率CT(high resolution CT,HRCT)能够显示更多的影像学细节,但鉴于SPN病灶的复杂性,其临床诊断仍然存在一定的局限性。血清肿瘤标记物检测可以辅助影像学诊断,对鉴别肺部结节良恶性诊断有重要价值,由于早期肺癌切除术后5年的生存率可达60%以上,故提高对SPN的临床诊断具有重大意义[2]。本研究采用HRCT联合肺癌肿瘤标志物4项[癌胚抗原(carcino-embryonic antigen,CEA)、鳞状上皮细胞癌抗原(squamous cell carcinoma antigen,SCC)、神经元特异性烯醇化酶(neuron-specific enolase,NSE)、细胞角蛋白19 片段抗原21-1(cytokeratin-19-fragment 21-1,CYFRA21-1)]诊断SPN,旨在探讨其临床诊断价值。
1 资料与方法
1.1 一般资料 选择2012年8月—2016年8月在北京市健宫医院就诊的SPN患者224例。其中良性病变组98例(经穿刺活检确诊64例,经临床随访证实34例),男性61例,女性37例,年龄52~78岁,平均(64.5±3.2)岁;恶性病变组126例(经过穿刺活检确诊75例,经手术病理组织确诊51例),男性82例,女性44例,年龄60~79岁,平均(63.4±2.8)岁。2组性别、年龄差异均无统计学意义(P>0.05),具有可比性。
1.2 纳入和排除标准 纳入标准:①所有患者经病理组织学或针刺细胞学活检,符合SPN相关诊断标准[3],良性患者在手术或活检后进行了17个月以上的随访证实;②结节直径≤3 cm;③所有患者为首次发现肿瘤或结节,术前未进行过手术、射频消融、放疗或者化疗等相关治疗;④患者临床、影像学及实验室检查资料完整;⑤患者或家属均签署知情同意书。 排除标准:①同时并发其他腹部肿瘤的患者;②伴有全身免疫性疾病的患者;③合并严重心脏、肾脏疾病功能障碍的患者;④病理资料不完整的患者。
1.3 方法
1.3.1 CT检查 应用SOMATOM Definition Flash CT,患者取仰卧位,扫描范围包括胸廓入口至膈肌。采用高分辨率模式,参数设定:120 kV,CARE DOSE-4D调节电流,常规重建层厚5 mm,靶重建层厚1.0 mm,层厚间隔1.0 mm。采用双盲法由3位高年资放射科医师对上述CT片进行分析,观察记录SPN病灶特征并对其良恶性作出判断,对于意见不一致的CT片,以多数诊断结果为准。
1.3.2 血清肿瘤标志物检测[4-5] 在进行HRCT扫描的前后1周之内,清晨空腹采取外周静脉血5 mL,3 500 r/min离心10 min,取上清,采用酶联免疫吸附测定法进行血清肺肿瘤标志物检测,试剂盒购自罗氏试剂,所有操作按照说明书严格执行。CEA、SCC、NSE、CYFRA21-1的阳性临界值分别为5 μg/L、1.5 μg/L、16.3 μg/L和3.3 μg/L。诊断:上述4项中任意1项或1项以上阳性即判断为血清肿瘤标志物检测阳性,上述4项均为阴性则判断为血清肿瘤标志物检测阴性。以病理检测结果为准,计算诊断准确率。
1.3.3 联合检测 以HRCT检查结果阳性或者血清肿瘤标志物检测阳性为联合检测阳性。以病理诊断结果为金标准,分别判断HRCT检测、血清肿瘤标志物检测和联合检测的诊断价值。
1.4 统计学方法 应用SPSS 19.0统计软件分析数据。计量资料比较采用两独立样本的t检验;计数资料比较采用χ2检验;敏感度、特异度等采用四格表诊断性试验分析。P<0.05为差异有统计学意义。
2 结 果
2.1 SPN病理检测结果 恶性组结节直径0.22~2.96 cm,平均(1.53±0.34) cm;118例获得HRCT清晰征象;腺癌59例,鳞癌42例,细支气管肺泡癌16例,小细胞癌9例。良性组结节直径0.24~3.00 cm,平均(1.45±0.36) cm;92例获得HRCT清晰征象;良性组病理证实结核球28例,非特异性炎症16例,炎性假瘤12例,支气管囊肿6例,错构瘤2例;良性组经随访证实结节未发生明显变化(包括直径、形态、密度等)20例,给予抗结核治疗后结节明显缩小6例,给予抗感染治疗后结节病灶明显缩小8例。
2.2 2组HRCT征象比较 恶性组在典型结节并深分叶、胸膜凹陷、短细毛刺、空泡征、支气管血管集束征、棘状突起征象上的检出率高于良性组,良性组在相邻胸膜增厚和卫星灶的检出率高于恶性组,差异均有统计学意义(P<0.05),见表1。
表1 2 组HRCT征象比较
Table 1 Comparison of HRCT symptom between two groups (例数,%)
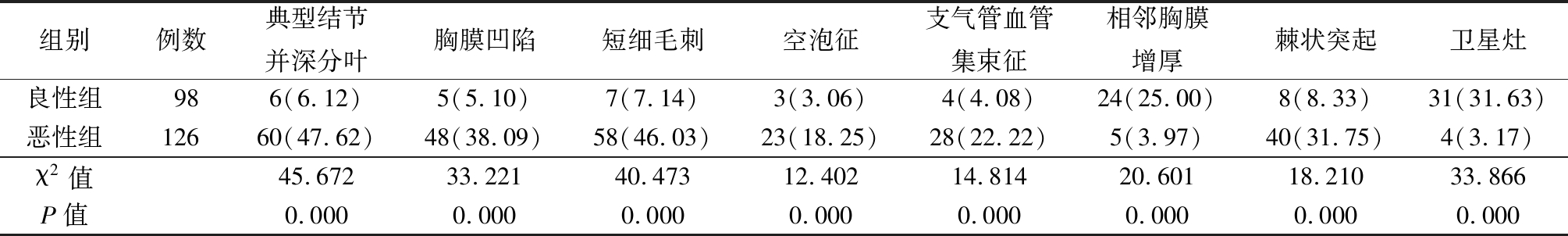
组别例数典型结节并深分叶胸膜凹陷短细毛刺空泡征支气管血管集束征相邻胸膜增厚棘状突起卫星灶良性组986(6.12)5(5.10)7(7.14)3(3.06)4(4.08)24(25.00)8(8.33)31(31.63)恶性组12660(47.62)48(38.09)58(46.03)23(18.25)28(22.22)5(3.97)40(31.75)4(3.17)χ2值45.67233.22140.47312.40214.81420.60118.21033.866P值0.0000.0000.0000.0000.0000.0000.0000.000
2.3 HRCT典型影像及诊断结果 126例恶性SPN中有27例(21.4%)漏诊;98例良性SPN中有10例(10.2%)误诊。HRCT诊断SPN良恶性的典型影像见图1。
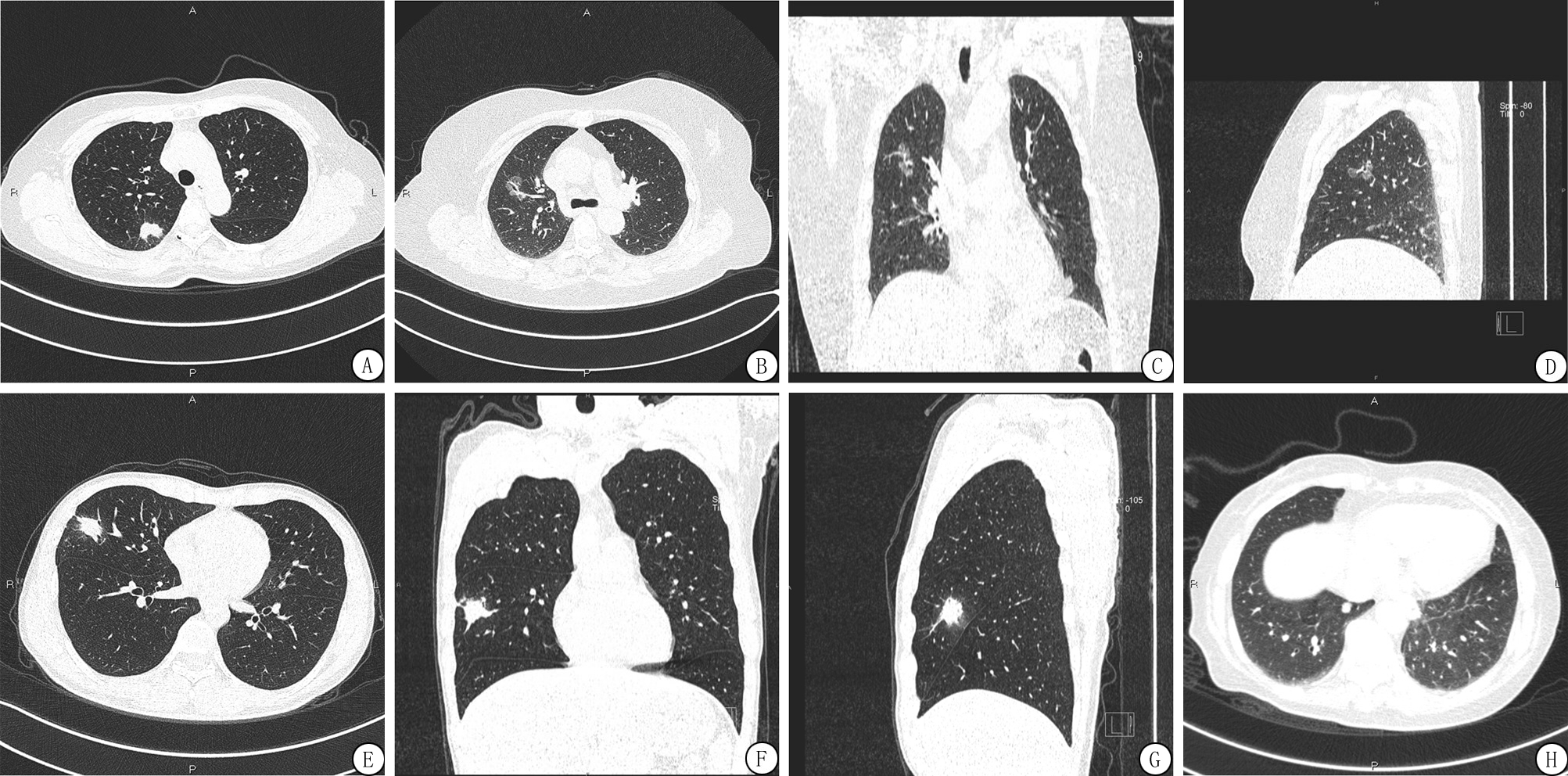
图1 恶性和良性SPN结节HRCT影像
A.病理诊断为肺癌:结节周围可见短毛刺征、深分叶征和血管集束征;B.病理诊断为腺癌:血管集束征;C,D.分别为腺癌冠状位和矢状位;E.炎性假瘤:结节边缘较光整,未见短毛刺、深分叶或血管集束征;F,G.分别为炎性假瘤冠状位和矢状位;H.病理诊断为良性结节,随访24个月未发生明显变化:结节边缘光整,未见短毛刺、深分叶或血管集束征
Figure 1 Typical cases of benign/malignant HRCT image
2.4 2组血清肿瘤标志物检测结果比较 恶性组血清CEA、SCC、NSE、CYFRA21-1浓度均高于良性组,差异有统计学意义(P<0.05),见表2。
Table 2 Comparison of serum tumor markers concentration between two groups
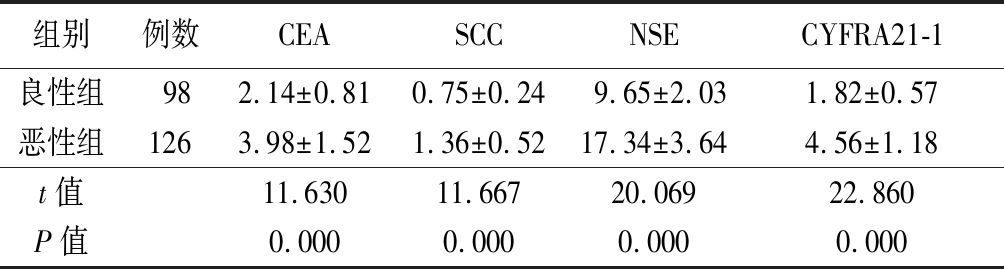
组别例数CEASCCNSECYFRA21-1良性组982.14±0.810.75±0.249.65±2.031.82±0.57恶性组1263.98±1.521.36±0.5217.34±3.644.56±1.18t值11.63011.66720.06922.860P值0.0000.0000.0000.000
2.5 对HRCT、肿瘤标志物和联合检查的评价 以病理检查为金标准,分别评价HRCT、肿瘤标志物和联合检查恶性肿瘤的检出率以及敏感度、特异度和准确度等。病理检出恶性肿瘤126例(100.0%),HRCT检出恶性肿瘤109例(86.5%),肿瘤标志物检出恶生肿瘤78例(61.9%),而联合检查检出恶性肿瘤144例(114.3%)。3种方法阳性检出率差异均有统计学意义(P<0.05)。肿瘤标志物联合HRCT检查方法敏感度最高,但其特异度最低;准确度以血清肿瘤标志物检测方法最低,HRCT与标志物联合HRCT检查相近;阳性预测值以HRCT最高,阴性预测值以肿瘤标志物检测方法最低。见表3。
表3 单项检测和联合检测比较
Table 3 Comparison of single detection and join-detection (例数)
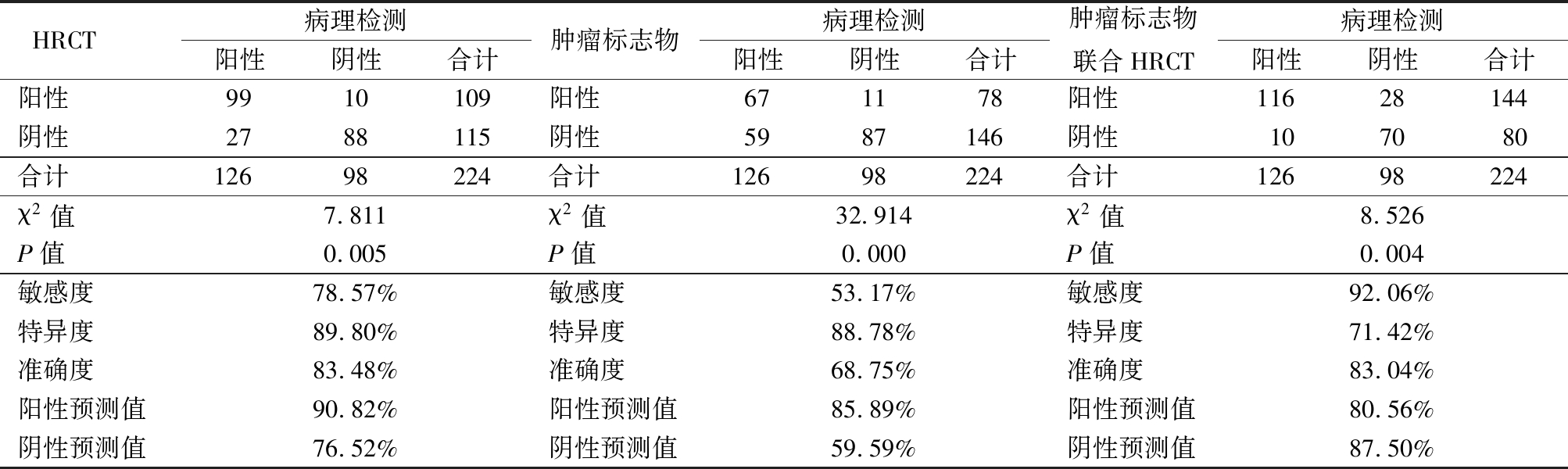
HRCT 病理检测阳性阴性合计肿瘤标志物病理检测阳性阴性合计肿瘤标志物联合HRCT病理检测阳性阴性合计阳性99 10 109阳性671178阳性11628144阴性27 88 115阴性5987146阴性107080合计12698224合计12698224合计12698224χ2值7.811χ2值32.914χ2值8.526P值0.005P值0.000P值0.004敏感度78.57%敏感度53.17%敏感度92.06%特异度89.80%特异度88.78%特异度71.42%准确度83.48%准确度68.75%准确度83.04%阳性预测值90.82%阳性预测值85.89%阳性预测值80.56%阴性预测值76.52%阴性预测值59.59%阴性预测值87.50%
3 讨 论
SPN是一种直径≤3 cm的单发结节,近年来随着人们健康意识的加强和医学技术的发展,SPN的临床检出率越来越高。SPN分为良性和恶性,多数SPN为良性结节,20%~40%为恶性病变,恶性病变一般为原发性肺癌或转移性肿瘤[6]。目前认为,SPN是肺癌病变早期的唯一的影像学特征,而早期确诊并切除能显著提高肺癌患者5年生存率,故准确诊断SPN的良恶性在临床治疗中具有重大意义[7]。SPN病理复杂,目前通过外科手术获取病理组织进行检查仍然是诊断SPN的金标准,但是该法对患者的创伤大,许多患者难以接受。因此,寻找一种能够显著提高临床诊断效能的检测方法对SPN的鉴别及后续治疗至关重要。
与常规CT相比,HRCT采用1~2 mm薄层,具有更高的密度分辨率,临床主要用于观察胸部小病灶及其细微结构,能清晰显示肺部的结节内部细微结构和形态学特征,可以通过后期重建和容积扫描获得清晰的高质量影像图,对SPN内部和周围征象具有较高的敏感度和检出率[8]。本研究采用HRCT诊断SPN,其敏感度和特异度分别为78.57%、89.80%。通过比较良性组和恶性组的HRCT征象发现,差异最为显著的是恶性SPN多表现为支气管血管集束征、深分叶征和短细毛刺,一般认为恶性肿瘤生长迅速需要更多的血液供应,因而血管增粗出现支气管血管集束征,深分叶是由于恶性肿瘤生长迅速受到周围正常组织的制约而形成的特征,而短刺毛是恶性肿瘤向周围浸润的表现[9],这三者对SPN的良恶性鉴别诊断具有重要价值。恶性SPN多伴有胸膜凹陷、空泡征、棘状突起,而良性SPN部分可见相邻胸膜增厚和卫星灶征象。但并非所有恶性结节都伴有上述征象,根据病理基础不同,其影像表现不同,部分结节仅伴有其中1种或2种征象,甚至有部分恶性结节不伴有其中任何1种征象或者特征不明显,因而出现漏诊[10]。部分良性病变如发生长期慢性炎症反应或霉菌感染也有可能出现短毛刺征或者是胸膜凹陷征,导致误诊[11]。
在肿瘤发病早期,肿瘤标志物的浓度即发生显著变化,肿瘤标志物释放入血,其血清浓度可以反映肿瘤的发生发展、浸润转移,可以作为早期筛查诊断和预后判断的指标,弥补HRCT影像学诊断的不足[12]。CEA、SCC、NSE、CYFRA21-1是常用的4种肺癌标志物。CEA是广谱性非特异性肿瘤标记物,在肺癌及消化道恶性肿瘤患者体内异常表达,恶性SPN患者血清CEA显著升高,且腺癌患者表达显著高于其他类型;SCC是一种糖蛋白,25%~75%的肺鳞状细胞癌SCC升高;NSE是糖酵解的关键酶,是小细胞肺癌的首选标记;CYFRA21-1在鳞癌中的表达显著高于其他类型的肺癌,是非小细胞癌分型和分期的辅助指标,且与肿瘤恶化程度呈正相关关系[13-14]。本研究中恶性组血清CEA、SCC、NSE、CYFRA21-1浓度均高于良性组(P<0.05)。这与文献报道一致[15]。 研究认为血清肿瘤标志物可作为预测SPN的独立因素[16],但血清肿瘤标志物检测全阴性并不能完全排除恶性肿瘤的可能性,对于SPN较微小结节,采用肿瘤标志物与HRCT联合检测有利于提高诊断准确度。本研究以4项标志物中任意1项阳性即判定为血清标志物检测阳性,确实提高了检出阳性率和敏感度。本研究中肿瘤标志物与HRCT联合检测检出阳性率甚至高于病理检查,但其中存在假阳性,应注意鉴别。HRCT、肿瘤标志物和两者联合检查3种方法中:肿瘤标志物联合HRCT检查方法敏感度最高,但是其特异度是最低的;准确度以血清肿瘤标志物检测方法最低,HRCT与联合检查方法相近;阳性预测值以HRCT最高,阴性预测值以肿瘤标志物检测方法最低。综合评价,HRCT检查仍有较高的诊断价值,HRCT与血清肿瘤标志物联合检查将有助于提高敏感度和准确度。
综上所述,HRCT检查联合肿瘤标志物检测对于SPN诊断具有较高的诊断效能,能显著提高敏感度,具有较高的准确度和预测价值,值得临床推广应用。
[1] 周清华,范亚光,王颖,等.中国肺部结节分类、诊断与治疗指南(2016年版)[J].中国肺癌杂志,2016,19(12):793-798.
[2] 王琳,吴传勇,娄加陶.肿瘤标记物检测在肺部孤立性结节鉴别诊断中的价值[J].现代免疫学,2016,36(5):405-409.
[3] 中华医学会呼吸病学分会肺癌学组,中国肺癌防治联盟专家组.肺部结节诊治中国专家共识[J].中华结核和呼吸杂志,2015,38(4):249-254.
[4] 朱涛,林岩,孙海斌.血清THS、NSE、CEA联合检测与小细胞肺癌的临床关系[J].河北医科大学学报,2012,33(9):1035-1038.
[5] Pang L,Wang J,Jiang Y,et al. Decreased levels of serum cytokeratin 19 fragment CYFRA 21-1 predict objective response to chemotherapy inpatients with non-small cell lung cancer[J]. Exp Ther Med,2013,6(2):355-360.
[6] Soubani AO. The evaluation and management of the solitary pulmonary nodule[J]. Postgrad Med J,2008,84(995):459-466.
[7] Slatore CG,Horeweg N,Jett JR,et al. An official American Thoracic Society research statement: a research framework for pulmonary nodule evaluation and management[J]. Am J Respir Crit Care Med,2015,192(4):500-514.
[8] Naidich DP,Bankier AA,MacMahon H,et al. Recommendations for the management of subsolid pulmonary nodules detected at CT:a statement from the fleischner society[J]. Radiology,2013,266(1):304-317.
[9] 张怀信,周伟,蒋雪峰.良恶性肺部孤立局灶性磨玻璃密度结节CT征象及其临床诊断价值[J].河北医科大学学报,2016,37(12):1458-1461.
[10] Mao H,Labh K,Han F,et al. Diagnosis of the invasiveness of lung adenocarcinoma manifesting as ground glass opacities on high-resolution computed tomography[J]. Thoracic Cancer,2016,7(1):129-135.
[11] 陈颖,胡春洪,林盪,等.多排螺旋CT薄层重组和高分辨率CT靶扫对肺微小结节的价值比较[J].临床放射学杂志,2017,36(11):1617-1622.
[12] 李笑莹,刘芳,车海杰,等.肿瘤标志物预测孤立性肺结节恶性概率模型的建立与初步评价[J].山东大学学报:医学版,2017,55(4):60-64.
[13] 刘晓飞,李鹏程,何宝明,等.18F-FDG ET/CT显像联合血清肿瘤标志物组合在孤立性肺结节诊断中的价值[J].现代肿瘤医学,2017,25(8):1230-1234.
[14] Chen F,Wang XY,Han XH,et al. Diagnostic value of Cyfra21-1,SCC and CEA for differentiation of early-stage NSCLC from benign lung disease[J]. Int J Clin Exp Med,2015,8(7):11295-11300.
[15] Wang H,Zhang X,Liu X,et al. Diagnostic value of bronchoalveolar lavage fluid and serum tumor markers for lung cancer[J]. J Cancer Res Ther,2016,12(1):355-358.
[16] 奚小祥,吕必宏,何光明,等.孤立性肺结节早期诊治的临床策略[J].中国胸心血管外科临床杂志,2014,21(6):793-798.