尼可地尔,化学名称为N-(2-羟乙基)烟酰胺硝酸酯,临床上作为三磷酸腺苷敏感钾离子通道开放剂,适用于冠心病及各类心绞痛的治疗,能显著减少心血管事件发生风险,改善预后[1-3]。配置前尼可地尔要求的储存条件为2~10 ℃,用0.9%氯化钠注射液或5%葡萄糖注射液溶解稀释后供临床应用。配制好的成品输液的稳定性直接影响治疗效果,如果出现微粒析出、沉淀、变色、产生气泡、酸碱度改变等问题,可造成药物失效,甚至可威胁患者生命安全[3]。药物稳定性是评价药物质量、有效性和安全性的重要指标,试验结果能够为实际药物使用过程带来更多理论依据[4]。研究证明,药物在稀释剂中的稳定性需要考察后才能放心使用[5-9]。本研究旨在探讨冷藏药品注射用尼可地尔配制溶液的稳定性,观察该药品在不同载体溶媒中溶解后存放于不同温度条件下的浓度、pH值及颗粒度的变化,以便为药物临床正确配置和输注提供实验依据。
1 材料与仪器
1.1 药品与试剂 尼可地尔对照品(中国食品药品检定研究院,100 mg,批号101079-201502,纯度99.6%),注射用尼可地尔(北京四环科宝制药有限公司,批号17102023),甲醇(Fishr Chemical,批号175167),0.9%氯化钠注射液(石家庄四药有限公司,100 mL,批号1801253701,250 mL,批号1801173701),5%葡萄糖注射液(石家庄四药有限公司,100 mL,批号1801243701,250 mL,批号1801183701)。
1.2 仪器 Waters H-Class UPLC(包括四元溶剂管理器、样品管理器、紫外检测器),CPA2250电子分析天平(德国Sartorius公司),XW-80A涡旋混合器(上海精科实业有限公司),KQ-300超声波清洗器(昆山市超声仪器有限公司),GWF-8JA微粒分析仪(天津天河医疗仪器有限公司),微处理pH计(HANNA仪器)。
2 方法与结果
2.1 色谱条件 色谱柱 ACE-C18(50 mm×2.1 mm,2.5 μm)柱;柱温40 ℃;流动相 甲醇-水(42∶58);流速0.4 mL/min;紫外检测波长 254 nm;进样量 2 μL。
2.2 溶液的制备
2.2.1 对照品溶液的制备 精密称取尼可地尔对照品16 mg于100 mL棕色容量瓶中, 50%甲醇超声溶解定容,制成浓度为0.01658 g/L的尼可地尔对照品溶液。
2.2.2 供试品溶液的制备 室温条件下(23±1)℃,取注射用尼可地尔12 mg溶解加入0.9%氯化钠注射液100 mL中得供试品溶液1,取注射用尼可地尔12 mg溶解加入5%葡萄糖注射液100 mL中得供试品溶液2,取注射用尼可地尔30 mg溶解加入到0.9%氯化钠注射液250 mL中得供试品溶液3,取注射用尼可地尔30 mg溶解加入到5%葡萄糖注射液250 mL中得供试品溶液4。
2.3 方法学研究
2.3.1 专属性考察 分别取对照品溶液、0.9%氯化钠注射液、供试品溶液1、5%葡萄糖注射液、供试品溶液2各2 μL进样,按“2.1”中方法测定尼可地尔色谱峰峰形良好,保留时间约0.41 min;2种溶媒在尼可地尔峰位置无干扰;供试品溶液中,尼可地尔峰与其他组分基线分离,分离度良好,理论踏板数在正常范围内(图1)。
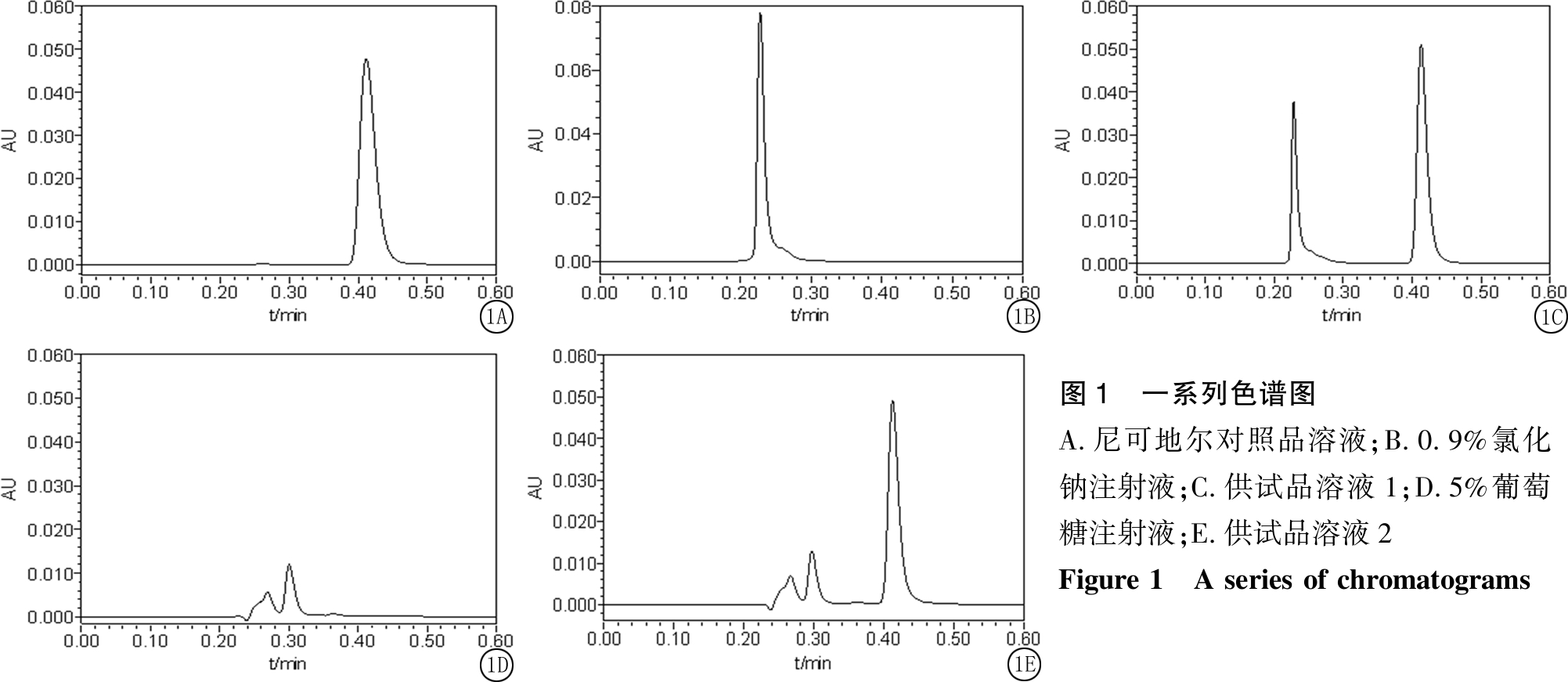
图1 一系列色谱图A.尼可地尔对照品溶液;B.0.9%氯化钠注射液;C.供试品溶液1;D.5%葡萄糖注射液;E.供试品溶液2Figure 1 A series of chromatograms
2.3.2 线性关系 精密吸取对照品溶液1,2,3,4,5,6 mL分别于50 mL容量瓶中,50%甲醇定容,得系列浓度的对照品溶液。按“2.1”中方法进样测定,记录尼可地尔色谱峰面积。以色谱峰面积(A)为纵坐标,尼可地尔浓度(mg/L)为横坐标进行线性回归,得线性回归方程为A=4 818C-899.5(r=0.999)。结果表明尼可地尔在3.316~18.896 mg/L浓度范围内呈良好的线性关系。
2.3.3 精密度试验 精密吸取对照品溶液3,4,5 mL分别置于50 mL容量瓶中,用50%甲醇稀释近刻度,定容,配制成低、中、高3种浓度(9.948 mg/L、13.264 mg/L、16.58 mg/L)的溶液,按“2.1”中方法日内重复进样5次,测定峰面积。结果显示低、中、高3种浓度的相对标准偏差(relative standard deviation,RSD)分别为0.056%、0.1%、0.18%;按“2.1”中方法3种浓度溶液重复进样3 d,测定峰面积。统计结果表明低、中、高3种浓度的RSD分别为0.3%、0.7%、1.0%,说明精密度良好。
2.3.4 重复性试验 取批号为17102023的药品,按供试品制备方法,重新制备2种不同溶媒的尼可地尔溶液。按“2.1”中方法分别重复进样3次,测定峰面积。结果显示以0.9%氯化钠注射液做溶媒的尼可地尔溶液的RSD为0.02%,以5%葡萄糖注射液做溶媒的尼可地尔溶液的RSD为0.09%,表明此实验重复性良好。
2.3.5 回收率试验 按“2.3.3”中操作配置高、中、低3个浓度的溶液,按“2.1”中方法进样测定。结果显示高、中、低3个浓度溶液的回收率分别为99.3%、99.4%、101.2%,说明回收率良好。
2.4 室温保存条件下尼可地尔与不同载体溶媒配伍后溶液的稳定性
2.4.1 尼可地尔与不同载体溶媒配伍后溶液浓度相对百分含量变化 按“2.2.2”中供试品溶液1,2的制备方法各制备3份溶液,依次编号为NC1、NC2、NC3、GC1、GC2、GC3(N:溶媒为0.9%氯化钠注射液,G:溶媒为5%葡萄糖注射液,C:常温)。按“2.1”中方法依次进样,间隔1 h重复进样,连续测定8 h。统计RSD依次为0.87%、1.00%、0.66%、0.66%、0.45%、0.39%。结果变化趋势见图2。
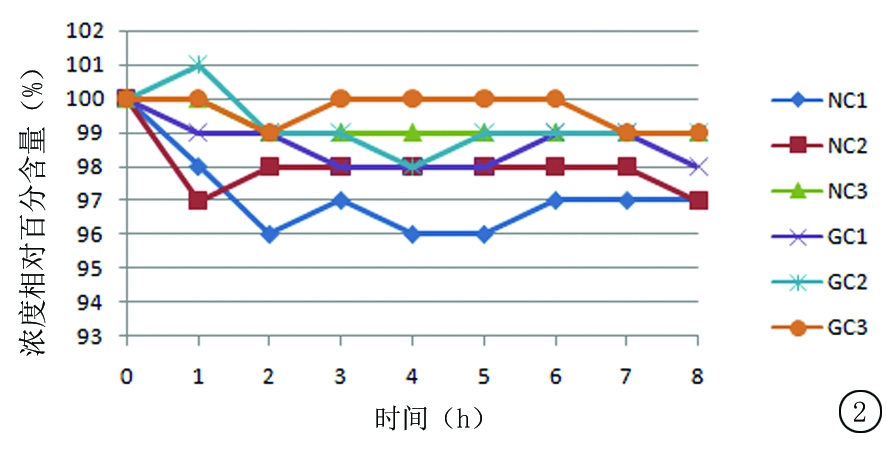
图2 室温保存条件下,尼可地尔与不同载体溶媒配伍后溶液浓度相对百分含量变化
Figure 2 The change in concentration relative percentage of nicorandil in different carrier solvents at room temperature
2.4.2 尼可地尔与不同载体溶媒配伍后溶液pH值的变化 在“2.4.1”操作基础上,每个时间点,每份供试品溶液测量pH值, 统计RSD依次为0.87%、1.00%、0.66%、0.66%、0.45%、0.39%。结果变化趋势见图3。
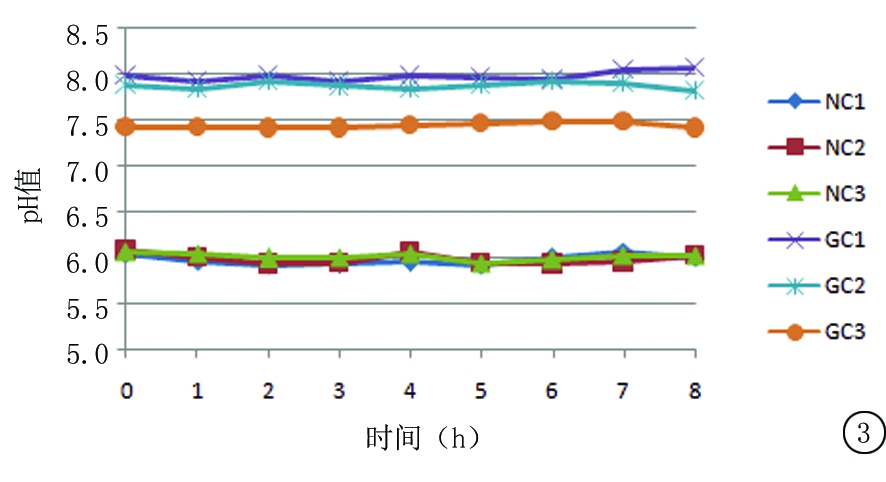
图3 室温保存条件下,尼可地尔与不同载体溶媒配伍后溶液pH值变化
Figure 3 The changes in the solution pH value of nicorandil in different carrier solvents at room temperature
2.4.3 尼可地尔与不同载体溶媒配伍后溶液微粒数量的变化 按“2.2.2”中供试品溶液3,4的制备方法各制备3份溶液,依次编号为NC1、NC2、NC3、GC1、GC2、GC3(N:溶媒为0.9%氯化钠注射液,G:溶媒为5%葡萄糖注射液,C:室温)。通过微粒分析仪分析测定,在0~8 h内各供试品溶液每毫升微粒数目变化见图4,5。
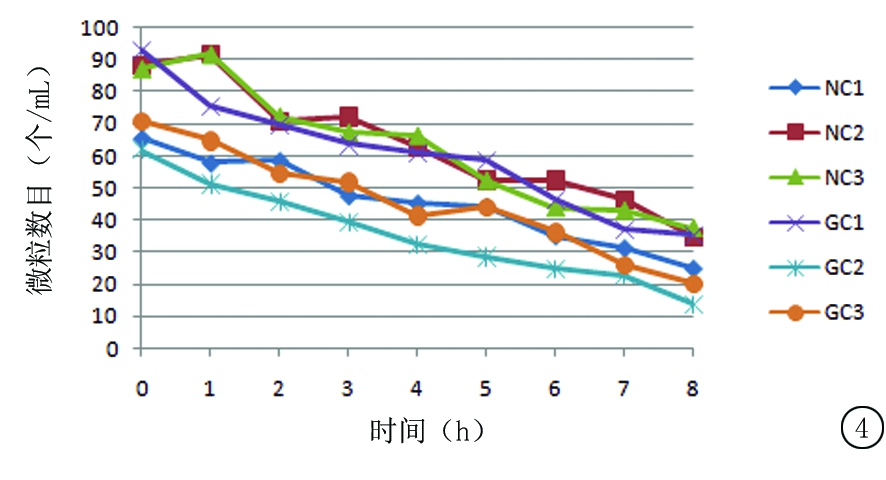
图4 室温保存条件下尼可地尔与不同载体溶媒配伍后每毫升溶液中≥10 μm微粒数目变化
Figure 4 The changes in the amount of solution particles(≥10 μm) in per ml at room temperature when nicorandil is mixed with different carrier solvent
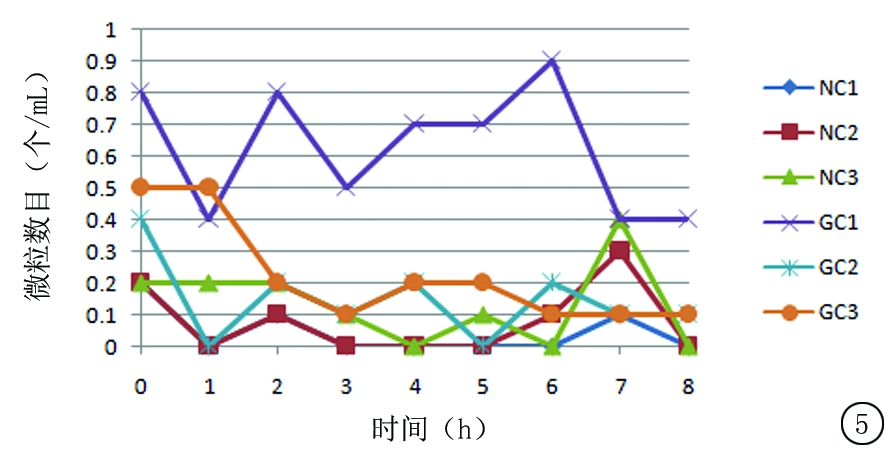
图5 室温保存条件下尼可地尔与不同载体溶媒配伍后每毫升溶液中≥25 μm微粒数目变化
Figure 5 The changes in the amount of solution particles(≥25 μm) in per ml at room temperature when nicorandil is mixed with different carrier solvents
2.5 冷藏保存条件下(7±1) ℃,尼可地尔与不同载体溶媒配伍后溶液的稳定性考察
2.5.1 尼可地尔与不同载体溶媒配伍后溶液浓度相对百分含量变化 按“2.2.2”中供试品溶液1,2的制备方法各制备3份溶液,依次编号为NB1、NB2、NB3、GB1、GB2、GB3(N:溶媒为0.9%氯化钠注射液,G:溶媒为5%葡萄糖注射液,B:冷藏)。按“2.1”中方法依次进样,间隔1 h重复进样,连续测定8 h。统计RSD依次为1.21%、0.81%、0.48%、0.62%、0.72%、0.43%。结果变化趋势见图6。
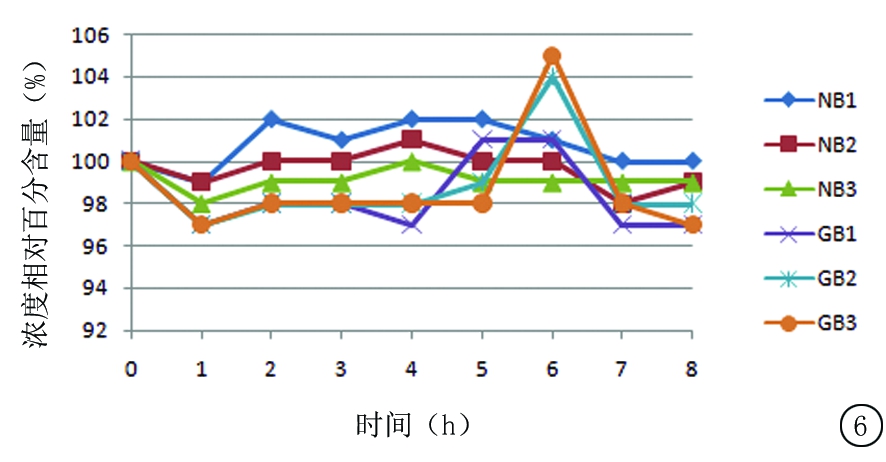
图6 冷藏保存条件下尼可地尔与不同载体溶媒配伍后溶液浓度相对百分含量变化
Figure 6 The change in concentration relative percentage of nicorandil in different carrier solvents under refrigerated conditions
2.5.2 尼可地尔与不同载体溶媒配伍后溶液pH值变化 在“2.5.1”操作基础上,每个时间点,每份供试品测量pH值,统计RSD依次为0.93%、0.79%、0.57%、0.87%、0.79%、0.78%。结果变化趋势见图7。
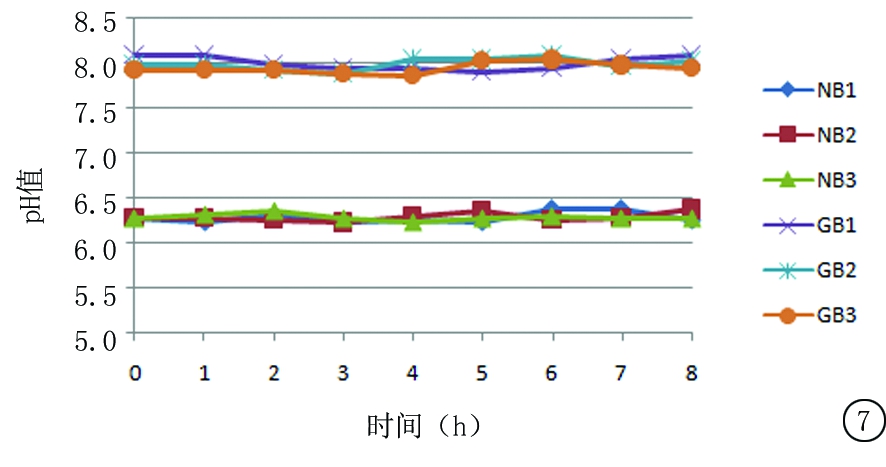
图7 冷藏保存条件下尼可地尔与不同载体溶媒配伍后溶液pH值变化
Figure 7 The changes in the solution pH value of nicorandil in different carrier solvents under refrigerated conditions
2.5.3 尼可地尔与不同载体溶媒配伍后溶液颗粒数量变化 按“2.2.2”中供试品溶液3,4的制备方法各制备3份溶液,依次编号为NB1、NB2、NB3、GB1、GB2、GB3(N:溶媒为0.9%氯化钠注射液,G:溶媒为5%葡萄糖注射液,B:冷藏)。通过微粒分析仪分析测定,在0~8 h内各供试品溶液每毫升微粒数目变化见图8,9。
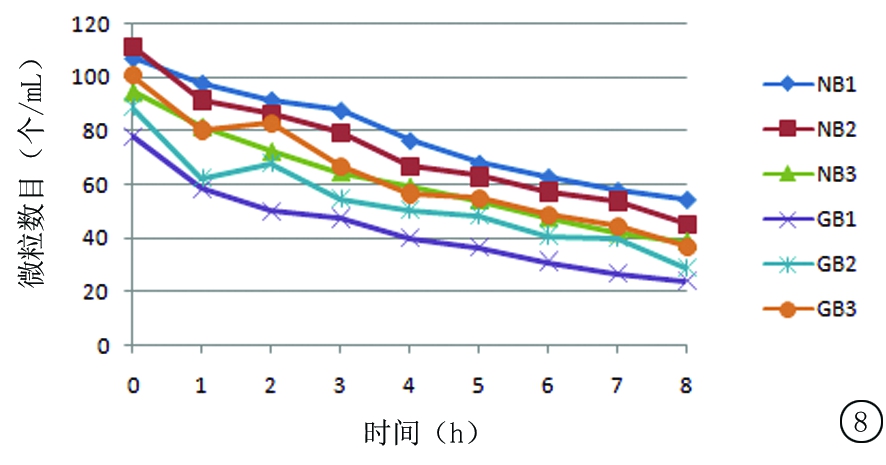
图8 冷藏保存条件下尼可地尔与不同载体溶媒配伍后每毫升溶液中≥10 μm微粒数目变化
Figure 8 The changes in the amount of solution particles(≥10 μm)of nicorandil in different carrier solvents under refrigerated conditions
图9 冷藏保存条件下尼可地尔与不同载体溶媒配伍后每毫升溶液中≥25 μm微粒数目变化
Figure 9 The changes in the amount of solution particles(≥25 μm) of nicorandil in different carrier solvents under refrigerated conditions
3 讨 论
尼可地尔作为新型抗心律失常、抗心绞痛药物的代表之一,近年来使用受到越来越多的关注[10]。本研究模拟临床使用前的配制操作和存放方式,参考药物稳定性实验方法[11]进行考察。有资料显示,尼可地尔测定的紫外检测波长为254 nm,柱温为40 ℃,流动相甲醇-水(48∶52)[12]。实验过程中,由于5%葡萄糖注射液中杂质峰对尼可地尔吸收峰略有干扰,故调整流动相比例为甲醇-水(42:58)。本研究测定的是非生物样本,所以选择使用超高效液相色谱法,保留时间短,效率高,保证了结果的准确度和可信度。
根据2015药典规定,标示装量>100 mL的静脉注射液,除另有规定外,每毫升中>25 μm的微粒不得超过3个,>10 μm的微粒不得超过25个。本研究结果显示,尼可地尔与2种不同载体溶媒配伍后,每毫升溶液中>25 μm的微粒数目正常,但>10 μm的微粒数目偏大;8 h内药物浓度没有明显变化,同时以对照品代替供试品进行颗粒检测,结果均在正常范围,故考虑10 μm微粒数目超标的原因可能与药物辅料有关;另外,>10 μm微粒数目在室温保存条件下比冷藏保存条件下降低更快。因此,配制好的溶液室温下放置对其颗粒数的降低是有好处的。微粒数目增多,临床使用过程中可能引发的热原反应就会增多,对血管壁及血流带来的不利影响就会增加。成品输液颗粒度的变化应该引起重视。
溶媒的种类和pH值对药物溶液的稳定性也存在一定的影响[13]。有文献报道不同的溶媒对药物稳定性会带来不同影响,在不同溶媒中的稳定性也会有所差别[14]。配伍后溶液pH 值的改变可导致不溶性微粒增多,药品有效成分的含量逐渐降低,从而影响到成品输液的稳定性与质量[15]。本研究结果显示,尼可地尔在与0.9%氯化钠注射液和5%葡萄糖注射液2种不同载体溶媒配伍后,无论在室温还是冷藏保存条件下,8 h内的含量和pH值均在正常范围内,稳定性良好,临床可以放心使用。
[1] 彭艳玲,黄洁,贺治民,等.尼可地尔对不稳定型心绞痛治疗效果[J].贵州医科大学学报,2018,43(6):678-681.
[2] 周建清.尼可地尔治疗冠心病心肌缺血的临床效果评价[J].中国实用医药,2018,13(17):121-122.
[3] 孟作文,翟凤琴,康彩丽.参麦注射液与常用药物配伍稳定性研究[J].临床合理用药,2016,9(21):44-45.
[4] 吴嘉玲.药物稳定性的试验方法及统计处理[J].生物化工,2018,4(1):105-107.
[5] 刘丽利,张建民,姬志强,等.临时配制的对乙酰氨基酚混悬液的稳定性与分剂量研究[J].中国医院用药评价与分析,2016,16(7):899-901.
[6] 陈晓梅.盐酸安妥沙星原料药的稳定性研究[J].健康之路,2016,15(1):254-255.
[7] 罗媛.中药静脉注射剂集中配制的稳定性[J].基层医学论坛,2016,20(1):101-102.
[8] 王静,王钦,高捷,等.注射用二丁酰环磷腺苷钙与转化糖电解质注射液的配伍稳定性及辅助用药管理对策研究[J].重庆医学,2018,47(26):3431-3435,3444.
[9] 茹艺.热毒宁注射液与溶媒配伍稳定性的探讨[J].中国医药指南,2018,16(25):15.
[10] 孟婷婷,贾国栋,王靖玺.尼可地尔在心律失常中的研究进展[J].中外医学研究,2018,16(18):177-179.
[11] 杜欢欢,管庆霞,朱婷,等.提高水溶性药物稳定性的新型技术研究进展[J].中国药房,2017,28(7):994-997.
[12] 罗平,冯敏,林宁.高效液相色谱法测定尼可地尔缓释片的含量[J].湖北中医药大学学报,2015,17(1):42-44.
[13] 伊丽.注射液奥扎格雷钠与不同大输液的配伍稳定性考察[J].海峡药学,2018,30(2):9-10.
[14] 孟作文,翟凤琴,康彩丽.银杏叶提取物在5种溶液中的稳定性考察[J].中国药师,2016,9(30):100-102.
[15] 吴妍,耿魁魁,史天陆,等.注射用丹参多酚酸盐成品输液的稳定性[J].安徽医药,2018,22(6):1203-1206.