急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)是一种起源于淋巴祖细胞的血液恶性肿瘤,约占所有成人急性白血病的15%~20%[1]。目前成人ALL疗效较差,5年无病生存率仅为30%~40%[2]。在白血病细胞生长、增殖和侵袭过程中会发生多种脂质改变,如低密度脂蛋白(low density lipoprotein,LDL)在活性氧作用下发生氧化反应,形成氧化型LDL(oxidized low density lipoprotein,oxLDL)并释放入血[3]。oxLDL具有免疫原性,可诱导机体形成oxLDL抗体[4]。动物实验及临床试验均表明,过度的脂质过氧化在肿瘤形成的病理过程中起重要作用[5],且oxLDL抗体与乳腺癌[6]、食管癌[7]及急性髓系白血病[8]等恶性肿瘤的发生密切相关。oxLDL及oxLDL抗体是否与成人ALL的发生有关,目前国内尚未见报道。本研究采用酶联免疫吸附测定法检测成人ALL患者血清oxLDL、oxLDL-IgG抗体及oxLDL-IgM抗体水平,旨在探讨oxLDL及oxLDL抗体与成人ALL发生的相关性。
1 资料与方法
1.1 一般资料 选取2016年3月—2018年5月就诊于河北医科大学第二医院的成人ALL患者57例。所有ALL患者均有感染、出血、贫血表现,无发生中枢神经系统白血病或其他髓外白血病者, 男性34例,女性23例,年龄15~84岁,平均(51.2±15.8)岁。另选50例健康体检者为对照组, 男性26例,女24例,年龄28~83岁,平均(52.4±14.3)岁。 2组性别、年龄、三酰甘油、高密度脂蛋白(high density lipoprotein,HDL)、IgA、IgG和IgM水平差异均无统计学意义(P>0.05);ALL组总蛋白、胆固醇、低密度脂蛋白( low density lipoprotein,LDL)低于对照组,白蛋白高于对照组,差异均有统计学意义(P<0.05)。见表1。
表1 ALL组与对照组基础资料比较
Table 1 Comparison of basic data between ALL group and control group
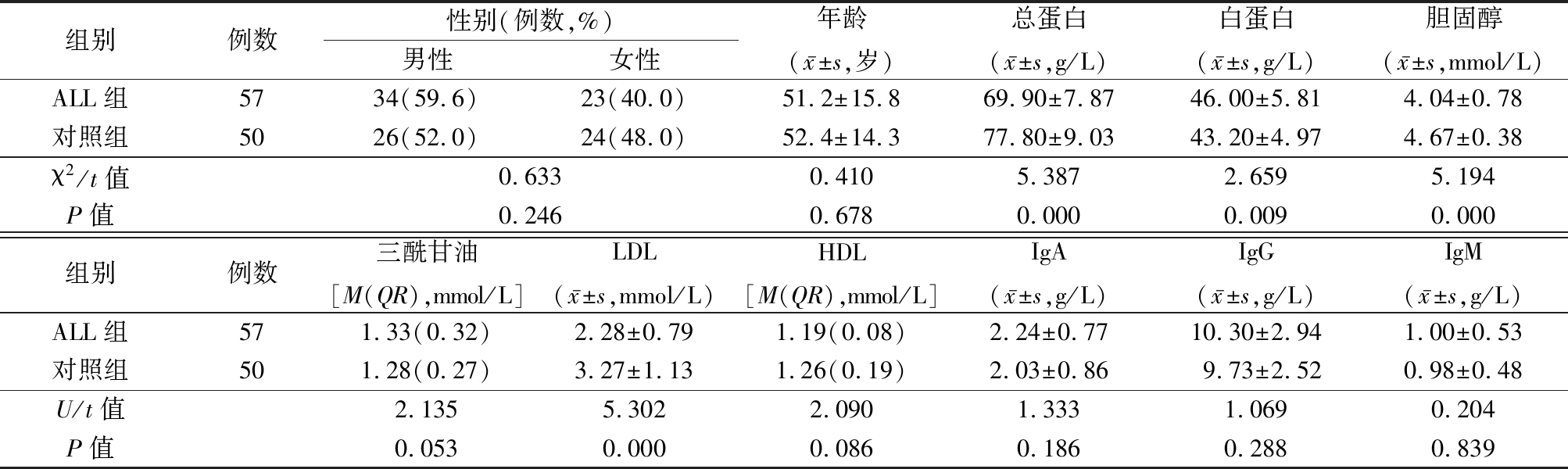
组别例数性别(例数,%)男性女性年龄(x-±s,岁)总蛋白(x-±s,g/L)白蛋白(x-±s,g/L)胆固醇(x-±s,mmol/L)ALL组5734(59.6)23(40.0)51.2±15.869.90±7.8746.00±5.814.04±0.78对照组5026(52.0)24(48.0)52.4±14.377.80±9.0343.20±4.974.67±0.38χ2/t值0.6330.4105.3872.659 5.194P值0.2460.6780.0000.0090.000组别例数三酰甘油[M(QR),mmol/L]LDL(x-±s,mmol/L)HDL[M(QR),mmol/L]IgA(x-±s,g/L)IgG(x-±s,g/L)IgM(x-±s,g/L)ALL组571.33(0.32)2.28±0.791.19(0.08)2.24±0.7710.30±2.941.00±0.53对照组501.28(0.27)3.27±1.131.26(0.19)2.03±0.869.73±2.520.98±0.48U/t值2.1355.3022.0901.3331.0690.204P值0.0530.0000.0860.1860.2880.839
1.2 ALL纳入标准和排除标准 ALL纳入标准:①患者年龄>14岁;②临床资料完整;③符合成人ALL诊断标准[9]的初发患者;④入组前未经化疗或其他治疗。ALL排除标准:①合并其他肿瘤者;②合并其他血液系统疾病者;③严重肝病、糖尿病、心血管疾病及肾功能不全者;④不配合研究者。
1.3 方法
1.3.1 标本采集 采集57例ALL患者及50例健康对照者空腹静脉血2 mL,所有血标本于采集后1 h内离心分离血清,血清于-70 ℃冰箱中保存备用。
1.3.2 常规指标检测 应用罗氏Cobas 6000全自动生化分析仪及配套试剂检测血清总蛋白、白蛋白、胆固醇、三酰甘油、 HDL及 LDL,总蛋白测定采用双缩脲法,白蛋白测定采用溴甲酚绿法,胆固醇、 TG、HDL及LDL测定均采用酶比色法。应用西门子BNP特种蛋白分析仪及配套试剂测定血清IgG、IgA及IgM,IgG、IgA及IgM测定均采用散射免疫比浊法。
1.3.3 血清oxLDL-IgG抗体、oxLDL-IgM抗体及oxLDL测定 采用酶联免疫吸附测定法检测血清oxLDL-IgG抗体、oxLDL-IgM抗体及oxLDL,试剂均购自美国ADL公司,按试剂说明书进行操作,用伯乐iMark酶标仪450 nm波长读取吸光度。
1.4 统计学方法 应用SPSS 24.0统计软件分析数据。正态分布计量资料比较采用成组设计的t检验,非正态分布数据以中位数与四分位数间距(M,QR)表示,组间比较采用秩和检验;计数资料比较采用χ2检验;危险因素确定采用Logistic回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1 2组血清oxLDL、oxLDL-IgG抗体及oxLDL-IgM抗体水平比较 ALL患者与正常对照组比较,血清oxLDL-IgG(t=12.032,P<0.001)显著降低,oxLDL(t=26.419,P<0.001)、oxLDL-IgM(t=19.475,P<0.001)显著升高。考虑总蛋白(F=4.032,P=0.047)、LDL(F=59.094,P<0.001)、IgA(F=7.004,P=0.009)、oxLDL-IgG(F=73.995,P<0.001)及oxLDL-IgM(F=55.325,P<0.001)对2组间oxLDL差异有影响,胆固醇(F=18.035,P<0.001)、LDL(F=273.925,P<0.001)、oxLDL(F=73.995,P<0.001)及oxLDL-IgM(F=221.327,P<0.001)对2组间oxLDL-IgG差异有影响,总蛋白(F=6.672,P=0.011)、胆固醇(F=17.223,P<0.001)、LDL(F=183.964,P<0.001)、oxLDL(F=55.325,P<0.001)及oxLDL-IgG(F=221.327,P<0.001)对2组间oxLDL-IgM差异有影响,采用多因素协方差分析比较oxLDL、oxLDL-IgG及oxLDL-IgM2组间差异,结果显示在消除协变量影响后,ALL组与对照组间修正的血清oxLDL、oxLDL-IgG及oxLDL-IgM水平差异有统计学意义。见表2。
Table 2 Covariance analysis results for differences of oxLDL,oxLDL-IgG and oxLDL-IgM levels between ALL and control group
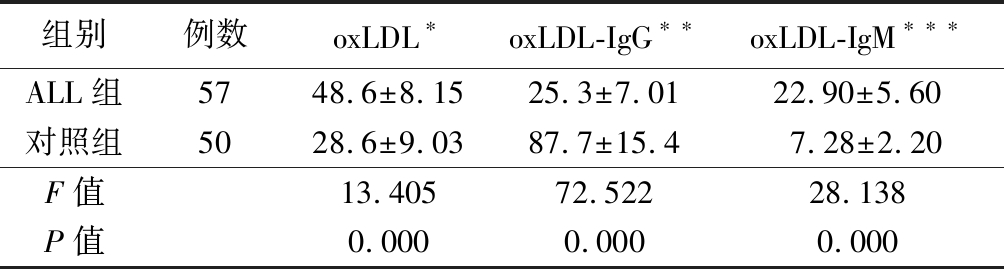
组别例数oxLDL∗oxLDL-IgG∗∗oxLDL-IgM∗∗∗ALL组5748.6±8.1525.3±7.0122.90±5.60对照组5028.6±9.0387.7±15.47.28±2.20F值13.40572.52228.138P值0.0000.0000.000
*表示总蛋白、LDL、IgA、oxLDL-IgG及oxLDL-IgM为协变量;**表示胆固醇、LDL、oxLDL及oxLDL-IgM为协变量;***表示总蛋白、胆固醇、LDL、oxLDL及oxLDL-IgG为协变量
2.2 相关性分析 成人ALL患者血清oxLDL-IgG水平与总蛋白、胆固醇和LDL呈直线正相关,与oxLDL呈直线负相关,oxLDL-IgM水平与总蛋白、胆固醇及LDL呈直线负相关,差异均有统计学意义(P<0.05),见表3。
表3 ALL组血清oxLDL抗体水平与常规指标的相关性
Table 3 Correlation between serum oxLDL antibody and biochemistry parameters
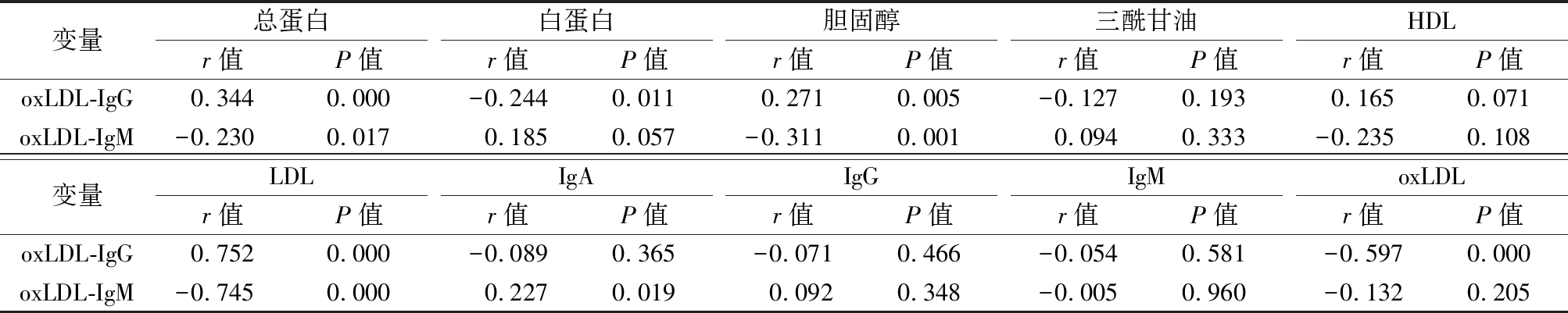
变量总蛋白r值P值白蛋白r值P值胆固醇r值P值三酰甘油r值P值HDLr值P值oxLDL-IgG0.3440.000-0.2440.0110.2710.005-0.1270.1930.1650.071oxLDL-IgM-0.2300.0170.1850.057-0.3110.0010.0940.333-0.2350.108变量LDLr值P值IgAr值P值IgGr值P值IgMr值P值oxLDLr值P值oxLDL-IgG0.7520.000-0.0890.365-0.0710.466-0.0540.581-0.5970.000oxLDL-IgM-0.7450.0000.2270.0190.0920.348-0.0050.960-0.1320.205
2.3 Logistic回归分析 为研究成人ALL发病的危险因素,以总蛋白、白蛋白、胆固醇、三酰甘油、HDL、LDL、IgA、IgG、IgM、oxLDL、oxLDL-IgG及oxLDL-IgM为自变量先采用二元Logistic回归分析对单因素进行分析,结果中P<0.2的变量进行多因素二元Logistic回归分析。以ALL发病(否=0,是=1)为因变量,采用基于偏最大似然估计的前进法进行单因素Logistic回归,纳入的自变量有总蛋白、胆固醇、LDL、oxLDL、oxLDL-IgG及oxLDL-IgM。分别将这些自变量纳入多因素Logistic回归分析,结果显示oxLDL-IgG升高(OR=0.311,95%CI=0.071~0.817,P=0.018)是成人ALL发病的保护因素,oxLDL-IgM升高(OR=2.274,95%CI=1.312~3.941,P=0.003)是成人ALL发病的危险因素。见表4,5。
表4 变量及赋值
Table 4 Variables and assignments

变量 赋值总蛋白<67.8=1,67.8~78.4=2,≥78.5=3白蛋白<40.9=1,40.9~47.8=2,≥47.9=3胆固醇<4.13=1,4.13~4.82=2,≥4.83=3三酰甘油<1.19=1,1.19~1.39=2,≥1.40=3HDL<1.15=1,1.15~1.26=2,≥1.27=3LDL<2.41=1,2.41~3.16=2,≥3.17=3IgA<1.70=1,1.70~2.49=2,≥2.50=3IgG<4.67=1,4.67~6.58=2,≥6.59=3IgM<0.73=1,0.73~1.05=2,≥1.06=3oxLDL<34.7=1,34.7~44.4=2,≥44.5=3oxLDL-IgG<26.8=1,26.8~79.0=2,≥79.1=3oxLDL-IgM<8.25=1,8.25~20.1=2,≥20.2=3
表5 成人ALL发病危险因素的Logistic回归分析
Table 5 Logistic regression analysis of risk factors for onset of adult ALL
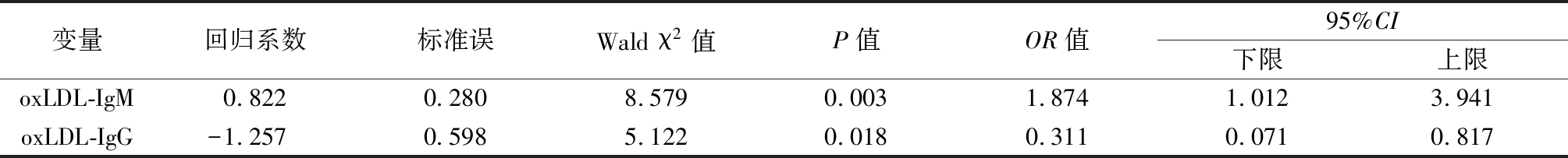
变量回归系数标准误Wald χ2值P值OR值95%CI下限上限oxLDL-IgM0.8220.2808.5790.0031.8741.0123.941oxLDL-IgG-1.2570.5985.1220.0180.3110.0710.817
3 讨 论
LDL主要由三酰甘油和胆固醇脂组成,因其含多不饱和脂肪酸较多,在吸烟、缺血、药物、高血压、糖尿病等因素作用下,可产生大量氧自由基。氧自由基可在血管内皮下被氧化成oxLDL并释放入血。现已证实,oxLDL是较LDL更重要的致动脉粥样硬化脂蛋白,oxLDL升高是动脉粥样硬化的独立危险因素,在动脉粥样硬化的病理过程中发挥了重要作用[10]。oxLDL可通过细胞毒作用直接损伤血管内皮细胞,造成血管内皮下脂质沉积而引发动脉粥样硬化[11]。此外,oxLDL可抑制内皮细胞产生一氧化氮,引起内皮细胞功能障碍。oxLDL还可通过增强单核细胞及内皮细胞的趋化、黏附能力,与血管平滑肌细胞及巨噬细胞表面的清道夫受体A结合,导致纤维帽溶解,影响斑块的稳定性,引起急性心脑血管事件[12]。肿瘤的发生也与机体脂质过氧化密切相关[5],但其病理过程与oxLDL导致的动脉粥样硬化过程不同[13]。肿瘤患者体内脂质过氧化增强使LDL氧化形成oxLDL过程中大量释放活性氧、炎症蛋白及其他生物活性物质,该类物质可通过改变细胞膜流动性、降低跨膜电位、抑制细胞凋亡、引起DNA损伤、抑制DNA修复等途径促进肿瘤的发生[14-15]。脂质过氧化产生的高浓度oxLDL与乳腺癌[6]、胰腺癌[16]、食管癌[17]及肾细胞癌[12,18]等实体瘤发生的相关性已得到证实。ALL属于血液系统肿瘤,其病理过程与实体瘤有较大差异。成人ALL发生是否与脂质过氧化异常有关,国内尚未见报道。本研究结果显示成人ALL患者血清oxLDL较对照组显著升高,表明ALL患者体内脂质过氧化增强。至于脂质过氧化增强是否是ALL肿瘤细胞形成的原因以及其发病机制是否与实体瘤相同,尚有待进一步研究证实。
肿瘤患者可出现脂质代谢异常及蛋白质过度消耗,这与乳腺癌、卵巢癌、肝癌、肺癌及胃癌发生相关[19]。其病理机制与肿瘤细胞过度增殖需要消耗大量能量,机体脂肪大量动员,导致血清三酰甘油水平升高有关。胆固醇合成限速酶HMG-CoA还原酶的活性增高,使三酰甘油能提供类戊二烯产物参与DNA复制。而作为三酰甘油的重要载体,血清LDL水平相应增高。另外,高水平LDL可抑制T细胞增殖,机体出现的免疫抑制状态有助于肿瘤细胞浸润与转移[20]。与实体瘤脂代谢水平增强不同,Li等[21]证实淋巴细胞白血病患者血清三酰甘油、HDL水平与对照组无显著差异,胆固醇及LDL显著低于对照组。本研究结果显示,成人ALL患者总蛋白、白蛋白、胆固醇及LDL水平显著降低,降低程度与oxLDL-IgG呈正相关,与oxLDL-IgM呈负相关。这表明ALL患者病理过程中脂代谢异常与实体瘤不同,并未出现脂质合成增强,而出现血清脂质水平减低及蛋白质过度消耗,且脂质代谢减低程度与oxLDL抗体水平相关。这可能是由于白血病细胞可产生大量白细胞介素6、肿瘤坏死因子α等细胞因子,细胞因子的增加可抑制脂质的合成[22]。另外,ALL患者血清脂质水平降低也可能与肿瘤细胞脂质消耗增加有关[23]。
oxLDL在形成过程中发生抗原表位的改变,刺激机体淋巴细胞产生oxLDL自身抗体[13]。oxLDL抗体在各年龄人群中均可检出[24],且与oxLDL水平呈负相关[25]。现已证实,oxLDL抗体与肿瘤的发生有关。有研究发现食管癌的发生与血清oxLDL水平呈正相关,但与oxLDL抗体水平呈负相关;Logistic回归分析表明,oxLDL-Ab水平增高是食管癌的保护因素[7]。Li等[8]证实成人急性粒细胞白血病患者血清oxLDL-IgG水平较正常对照显著降低、oxLDL-IgM显著升高。本研究结果证实成人ALL患者血清oxLDL-IgG抗体水平较正常组显著降低,而oxLDL-IgM抗体水平显著升高;Logistic回归分析结果显示oxLDL-IgG升高是成人ALL发病的保护因素,oxLDL-IgM升高是ALL发病的危险因素。这表明oxLDL抗体与ALL等肿瘤的发生发展过程相关,其具体机制尚未完全阐明。研究表明,细胞内oxLDL沉积可促进细胞凋亡的发生,oxLDL抗体可与oxLDL形成可溶性免疫复合物,促进血液中oxLDL的清除[13]。ALL患者血清oxLDL-IgG降低可保持机体oxLDL不被清除,有利于肿瘤细胞的清除。因而,笔者推测成人ALL患者血清oxLDL升高、oxLDL-IgG降低可能是机体清除肿瘤细胞的一种保护性反应。血清oxLDL-IgM抗体也可起到清除oxLDL的作用,但ALL患者oxLDL-IgM水平却出现升高,其原因及作用机制目前尚不清楚。动物实验表明,血清oxLDL的升高可刺激脾脏滤泡外oxLDL-IgM+浆细胞增值并产生oxLDL-IgM,oxLDL-IgM可抑制巨噬细胞表面清道夫受体与oxLDL结合,并且oxLDL-IgM可与凋亡细胞的氧化表位结合,进而通过激活补体清除氧化损伤细胞[26]。因而,笔者推测ALL患者血清oxLDL-IgM升高可能是机体降低过氧化损伤的一种保护机制。
综上所述,本研究表明成人ALL患者可出现脂质代谢障碍及脂质过氧化作用增强,ALL的发生与oxLDL-IgG降低及oxLDL-IgM升高有关。但本研究结果并未阐明ALL患者oxLDL及oxLDL抗体变化是否是ALL发生的直接原因,尚不能排除该变化是ALL发生后机体的适应性改变。关于ALL患者血清oxLDL-IgG及oxLDL-IgM抗体在疾病中的具体作用机制尚有待进一步阐明。
[1] Aldoss IT,Marcucci G,Pullarkat V. Treatment of acute lymphoblastic leukemia in adults:applying lessons learned in Children[J]. Oncology(Williston Park),2016,30(12):1080-1091.
[2] 张孝平,陈宝安,葛峥,等.61例成人急性淋巴细胞白血病患者的临床特征和疗效分析[J].中国实验血液学杂志,2017,25(3):711-717.
[3] Yang HQ,Qiu FQ,Jin KE,et al. High plasma levels of oxidatively modified low-density lipoproteins are associated with the suppressed expression of immunomodulatory molecules in patients with hematological malignancies[J]. Exp Ther Med,2015,9(6):2394-2400.
[4] Lankin VZ,Tikhaze AK. Role of oxidative stress in the genesis of atherosclerosis and diabetes mellitus:a personal look back on 50 years of research[J]. Curr Aging Sci,2017,10(1):18-25.
[5] Leone A,Roca MS,Ciardiello C,et al. Oxidative Stress Gene Expression Profile Correlates with Cancer Patient Poor Prognosis:Identification of Crucial Pathways Might Select Novel Therapeutic Approaches[J]. Oxid Med Cell Longev,2017,2017:2597581.
[6] Belskaya LV,Kosenok VK,Massard Z,et al. Status indicators of lipid peroxidation and endogenous intoxication in lung cancer patients[J]. Vestn Ross Akad Med Nauk,2016,71(4):313-322.
[7] Zhang H,Xia J,Wang K,et al. Serum autoantibodies in the early detection of esophageal cancer:a systematic review[J]. Tumour Biol,2015,36(1):95-109.
[8] Li H,Diao YT,Li HQ,et al. The association between serum levels of oxLDL-IgG and oxLDL-IgM autoantibody with adult acute myeloblastic leukaemia[J]. Lipids Health Dis,2010,9:11.
[9] 中国抗癌协会血液肿瘤专业委员会,中华医学会血液学分会白血病淋巴瘤学组.中国成人急性淋巴细胞白血病诊断与治疗指南(2016年版)[J].中华血液学杂志,2016,37(10):837-845.
[10] 郝秋艳,宋晴,杨素静,等.复发性脑梗死与UA、ox-LDL、MMP-9水平及颈动脉斑块的相关性分析[J].河北医科大学学报,2015,36(9):1097-1099.
[11] 周礼圆,蓝娇,李燕华,等.急性脑梗死患者血清脂联素、过氧化物酶体增殖物活化受体γ、氧化型低密度脂蛋白及单核细胞CD36、CD54表达的关系[J].河北医科大学学报,2013,34(11):1368-1371.
[12] 侯卫红,刘晓华.肾细胞癌患者血浆氧化型低密度脂蛋白水平的变化[J].检验医学,2017,32(12):1121-1123.
[13] Balzan S,Lubrano V. LOX-1 receptor:A potential link in atherosclerosis and cancer[J]. Life Sci,2018,198:79-86.
[14] Diakowska D,Grabowski K,Nienartowicz M,et al. Circulating oxidized low-density lipoproteins and antibodies against oxidized low-density lipoproteins as potential biomarkers of colorectal cancer[J]. Gastroenterol Res Pract,2015,2015:146819.
[15] Guaraldi F,Deon V,Del Bo C,et al. Effect of short-term hazelnut consumption on DNA damage and oxidized LDL in children and adolescents with primary hyperlipidemia:a randomized controlled trial[J]. J Nutr Biochem,2018,57:206-211.
[16] Kodydkova J,Vavrova L,Stankova B,et al. Antioxidant status and oxidative stress markers in pancreatic cancer and chronic pancreatitis[J]. Pancreas,2013,42(4):614-621.
[17] Lin Y,Ness-Jensen E,Hveem K,et al. Metabolic syndrome and esophageal and gastric cancer[J]. Cancer Causes Control,2015,26(12):1825-1834.
[18] 陈祝俊,张拥黎,卢仁泉,等.血浆氧化型低密度脂蛋白检测在肾细胞癌诊治中的临床意义[J].中国肿瘤,2016,25(5):400-403.
[19] Kuzu OF,Noory MA,Robertson GP. The Role of Cholesterol in Cancer[J]. Cancer Res,2016,76(8):2063-2070.
[20] 方征宇,潘志芸,李乾元,等.结肠癌患者脂代谢特征及其临床价值[J].浙江医学,2018,40(12):1316-1319.
[21] Li H,Li DQ,Li XX,et al. The association between oxidized low-density lipoprotein antibodies and hematological diseases[J]. Lipids Health Dis,2016,15(1):190.
[22] Newman WC,Amankulor NA. Control of glioblastoma tumorigenesis by feed-forward cytokine signaling[J]. Neurosurgery,2016,79(4):N9-10.
[23] Rozovski U,Hazan-Halevy I,Barzilai M,et al. Metabolism pathways in chronic lymphocytic leukemia[J]. Leuk Lymphoma,2016,57(4):758-765.
[24] Garoufi A,Marmarinos A,Vraila VM,et al. Influence of hypercholesterolemia on serum antibodies against oxidized LDL in children and adolescents[J]. Pediatr Int,2018,60(3):287-293.
[25] Zhang J,Wang D,He S. Roles of antibody against oxygenized low density lipoprotein in atherosclerosis:recent advances[J]. Int J Clin Exp Med,2015,8(8):11922-11929.
[26] Khoo LH,Thiam CH,Soh SY,et al. Splenic extrafollicular reactions and BM plasma cells sustain IgM response associated with hypercholesterolemia[J]. Eur J Immunol,2015,45(5):1300-1312.