口腔癌每年在世界范围内发病为300 400例,每年造成145 400例患者死亡[1],且有逐年增长趋势。在头颈癌当中,口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是最为常见的种类,并且是口腔癌的主要组织学类型,约占90%以上,具有发病率高、侵袭性高、患者预后差等特点[2-3]。尽管多模式治疗取得了相当大的进展,但OSCC患者的总生存率并未显著提高[4]。因此,迫切需要深入了解OSCC的分子致癌机制并寻找新的诊断生物标志物或治疗靶标,以提高患者总体生存率。微小RNA(microRNA,miRNA)是非编码RNA的小片段,许多细胞代谢过程,包括分化、发育、增殖和凋亡,是由miRNA控制的[5]。它通过与靶mRNA的3′-非翻译区中的互补序列结合调节蛋白质编码基因表达[6],通过影响mRNAs的转录和稳定性在基因表达转录后的调控中发挥作用。迄今已报道超过2 500种人类miRNA,并且预测超过30%的人类基因受这些miRNA的调节。越来越多的证据表明,miRNA在多种人类肿瘤中异常表达,并参与肿瘤发生的关键过程,如细胞增殖、分化、迁移和侵袭[7],由miRNAs介导的转录后基因调控是一种重要的基因调控方式。研究发现,miRNA的失调与OSCC的进展和预后密切相关[8]。已有实验数据证实miR-214在几种类型的人类恶性肿瘤中失调[9-11]。然而,miR-214在不同类型的癌症中扮演各种角色,甚至可能是相反的角色。目前关于miR-214在口腔癌发生中的生物学功能及其作用的分子机制尚不明确,通过生物学信息预测Ras受体RASSF5基因可能是miR-214作用的靶基因。本研究观察miR-214表达水平对口腔癌细胞系生物学特性及对RASSF5蛋白表达水平的影响,旨在为探明口腔癌发病的分子机制提供理论基础。
1 资料与方法
1.1 细胞株与试剂 人口腔癌细胞株SCC-15和CAL-27来源于中国医学科学院基础医学研究所基础医学细胞中心;高糖DMEM培养基和RPMI 1640培养基购于GIBCO公司;胎牛血清(fetal bovine serum,FBS)购于以色列Biological Industries,Lipofectamine 2000购于美国Invitrogen公司;Trizol购于美国Invitrogen公司,逆转录试剂盒、荧光定量PCR试剂盒购于QIAGEN公司;小干扰RNA(small interfering RNA,siRNA)是由上海吉玛公司设计提供,逆转录PCR(reverse transcrition-polymerase chain reaction,RT-PCR)引物是由上海生工合成;CCK-8细胞增殖-毒性检测试剂盒购于日本DOJINDO公司;Transwell小室(8 μm,24孔)购于美国康宁公司;Metrigel胶购于BD公司;anti-RASSF5 mAb和goat anti mouse-AF488购自Abcam公司。
1.2 细胞培养 将SCC-15和CAL-27细胞复苏后,分别接种于对应的完全培养液中,SCC-15使用含10% FBS和1%非必需氨基酸的高糖DMEM培养液;CAL-27细胞使用含10%胎牛血清的RPMI 1640培养液。置于37 ℃、5%CO2培养箱中培养,镜检细胞汇合度达到80%以上时胰酶消化传代。
1.3 小干扰RNA 引物设计及转染 根据miR-214的基因序列(NC_000001.11),通过特异性siRNA引物设计网站(http://sidirect2.rnai.jp)设计并筛选出了一条靶向miR-214基因的siRNA(miR-214-siRNA,上游序列 5′-AUGUUCUGCACAGCAAG-UGUA-3′,下游序列5′-CACUUGCUGUGCAGA-ACAUCC-3′),这部分工作已于课题前期完成。同时设计不针对任何基因的随机序列(siRNA-NC,5′-UUCUCCGAACGUGUCACGUTT-3′,5′-ACGU-GACACGUUCGGAGAATT-3′),以上序列均由上海生工生物工程有限公司合成。按照Lipofectamine 2000的操作步骤转染各组细胞株,转染后48 h,用荧光定量PCR方法检测各组中miR-214的干扰效率。
1.4 qRT-PCR 检测miR-214 mRNA水平 取对数生长期的SCC-15和CAL-27细胞,用Trizol裂解液抽提细胞总的RNA。使用NanoDrop 2000紫外分光光度计初步判断样品的浓度和质量。经逆转录试剂盒转录成cDNA,使用SYBR Green I染料进行RT-PCR扩增,反应体系为20 μL,反应条件为94 ℃变性30 s,预处理;94 ℃、20 s,58 ℃、20 s,共32个循环扩增,72 ℃、3 min延伸。miR-214在各组细胞中的表达变化倍数通过公式2-△△Ct进行相对定量分析。ΔCt=Ct(待检样品的miR-214)-Ct(内参),△△Ct值=实验组△Ct值-对照组△Ct值。将2种细胞均分为miR-214-siRNA组和siRNA-NC组,同时每种细胞均设置仅加入转染试剂的空白对照组。
1.5 细胞增殖、迁移和侵袭能力检测实验
1.5.1 WST-8增殖实验 将转染后的SCC-15和CAL-27细胞各组接种于96孔培养板,每个时间点对应的实验组设置3个复孔。分别于转染后0,24,48,72 h后在孔中加入WST-8试剂,继续孵育3 h后,检测450 nm波长下各孔的吸光度(A)。计算RNA靶向干扰miRNA-214的相对增殖抑制率[抑制率(%) = (A对照组-A实验组)/A对照组×100%]。每组实验重复3次。
1.5.2 划痕实验 在6孔板底部用记号笔等间距画5条横线,消化处于对数生长期的细胞接种于6孔板,每孔接种数量约为 5×105个。细胞达到汇合度70%时进行转染,细胞汇合度超过90%后进行划痕实验。将经灭菌的直尺与孔板底部的横线垂直放置,用200 μL枪头沿着直尺在单层细胞上划痕并保持直立。然后用PBS冲洗3次,尽量将漂浮细胞清洗干净,加入无血清培养液,5%CO2、37 ℃培孵箱培养。于0,24,48,72 h观察划痕愈合情况并拍照。每组设置3个复孔。
1.5.3 Transwell小室考察细胞侵袭能力 将转染后的SCC-15和CAL-27各3组细胞接种于经Matrigel胶包被的Transwell上室,在Transwell下室加入RPMI 1640完全培养液(含10%胎牛血清),24 h和48 h后将上室未穿膜的细胞以及基质胶轻轻擦去,下层侵袭的细胞用2~8 ℃预冷的甲醇固定10 min,晾干后用1%结晶紫染色,400倍放大下随机选择5个有代表性的视野计数。实验设置重复3次。
1.6 免疫组织化学染色 考察RASSF5蛋白表达在12孔板中接种2种细胞,每种分为2组,miR-214-siRNA组和siRNA-NC组。生长至50%时弃上清,PBS清洗1次,加冰甲醇固定5 min,然后进行封闭染色,其中RASSF5一抗(1∶500)作用2~8 ℃避光过夜,山羊抗鼠二抗-AF488(1∶2 000)室温孵育2 h。染色结束后比较2组细胞的平均荧光强度。
1.7 统计学方法 应用SPSS 18.0统计软件分析数据。计量资料比较分别采用两独立样本的t检验、F检验和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 RNA干扰后SCC-15和CAL-27细胞miR-214水平变化 siRNA-NC组在SCC-15细胞的表达低于空白对照组,miR-214-siRNA组在SCC-15 细胞株的表达水平明显低于空白对照组和siRNA-NC组(P<0.05);miR-214-siRNA组在CAL-27细胞株中的表达低于空白对照组和siRNA-NC组(P<0.05),而siRNA-NC组与空白对照组差异无统计学意义(P>0.05)。 见表1。
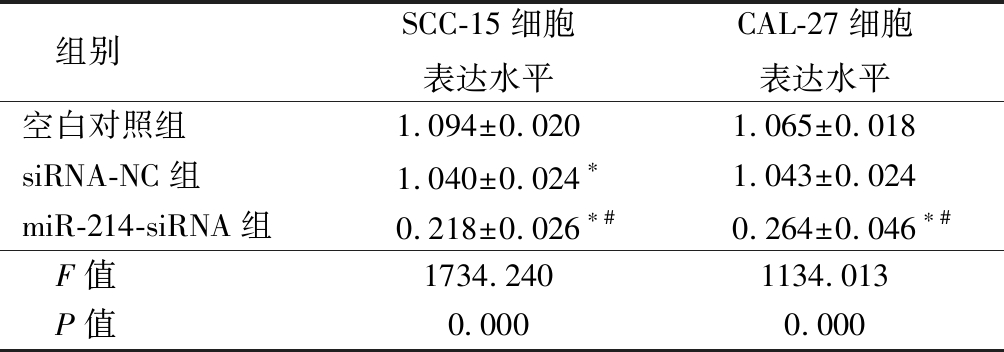
组别SCC-15细胞表达水平CAL-27细胞表达水平空白对照组1.094±0.0201.065±0.018siRNA-NC组1.040±0.024∗1.043±0.024miR-214-siRNA组0.218±0.026∗#0.264±0.046∗# F值1734.2401134.013 P值0.0000.000
*P值<0.05与空白对照组比较 #P值<0.05与siRNA-NC组比较(SNK-q检验)
2.2 WST-8检测增殖 各组在SCC-15细胞株中培养48 h 和72 h增殖能力高于24 h,培养72 h增殖能力高于48 h(P<0.05);培养24 h、48 h和72 h 后,siRNA-NC组增殖能力低于空白对照组, miR-214-siRNA组增殖能力低于siRNA-NC组和空白对照组(P<0.05)。各组在CAL-27细胞株中培养48 h 和72 h增殖能力高于24 h,培养72 h增殖能力高于48 h(P<0.05);培养24 h后, miR-214-siRNA组低于空白对照组(P<0.05),而与siRNA-NC组差异无统计学意义(P>0.05),培养 48 h和 72 h后,siRNA-NC组和miR-214-siRNA组增殖能力低于空白对照组, miR-214-siRNA组又低于siRNA-NC组(P<0.05)。见表2。
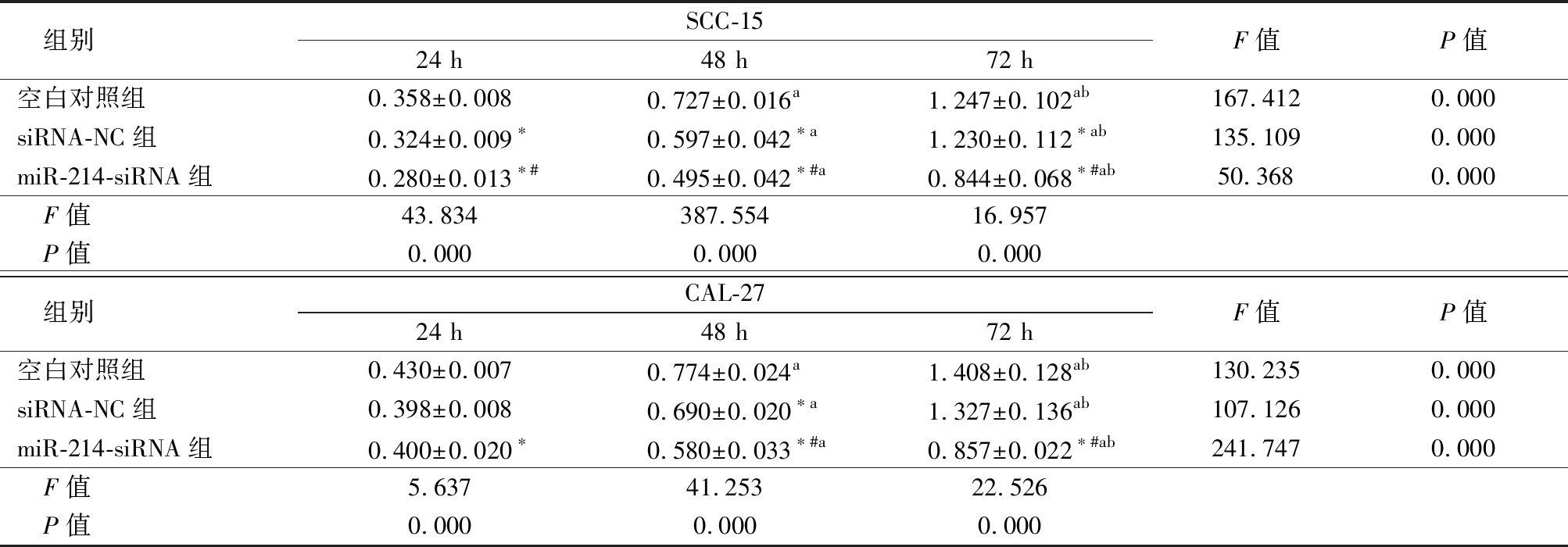
组别SCC-1524 h48 h72 hF值P值空白对照组0.358±0.0080.727±0.016a1.247±0.102ab167.4120.000siRNA-NC组0.324±0.009∗0.597±0.042∗a1.230±0.112∗ab135.1090.000miR-214-siRNA组0.280±0.013∗#0.495±0.042∗#a0.844±0.068∗#ab50.3680.000 F值43.834387.55416.957 P值0.0000.0000.000 组别CAL-2724 h48 h72 hF值P值空白对照组0.430±0.0070.774±0.024a1.408±0.128ab130.2350.000siRNA-NC组0.398±0.0080.690±0.020∗a1.327±0.136ab107.1260.000miR-214-siRNA组0.400±0.020∗0.580±0.033∗#a0.857±0.022∗#ab241.7470.000 F值5.63741.25322.526 P值0.0000.0000.000
*P值<0.05与空白对照组比较 #P值<0.05与siRNA-NC组比较 aP值<0.05与24 h比较 bP值<0.05 与48 h比较(SNK-q检验)
2.3 迁移能力变化 用划痕实验观察miR-214敲低表达对细胞迁移能力的影响,结果显示miR-214的敲低表达降低了口腔癌细胞株SSC-15和CAL-27的愈合能力,延长了愈合时间,见图1,2。
2.4 侵袭能力变化 用Transwell侵袭实验观察miR-214敲低表达对细胞侵袭功能的影响,结果显示SCC15 细胞和CAL-27细胞的miR-214-siRNA组在培养24 h和48 h穿膜细胞数差异均无统计学意义(P>0.05),见表3。
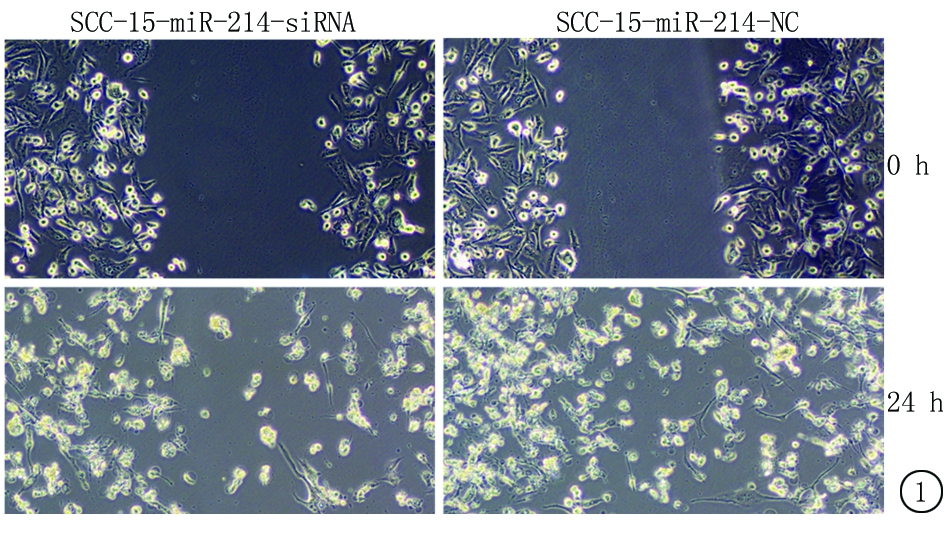
图1 SCC-15各组细胞迁移能力比较
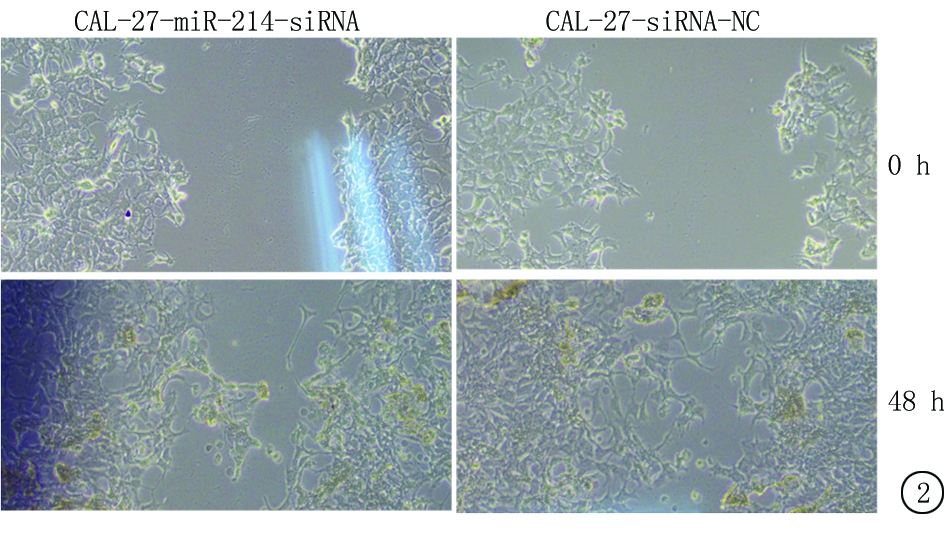
图2 CAL-27各组细胞迁移能力比较
表3 RNA干扰miR-214后SSC15细胞和CAL-27细胞穿膜细胞数量变化 ![]() 个数)
个数)
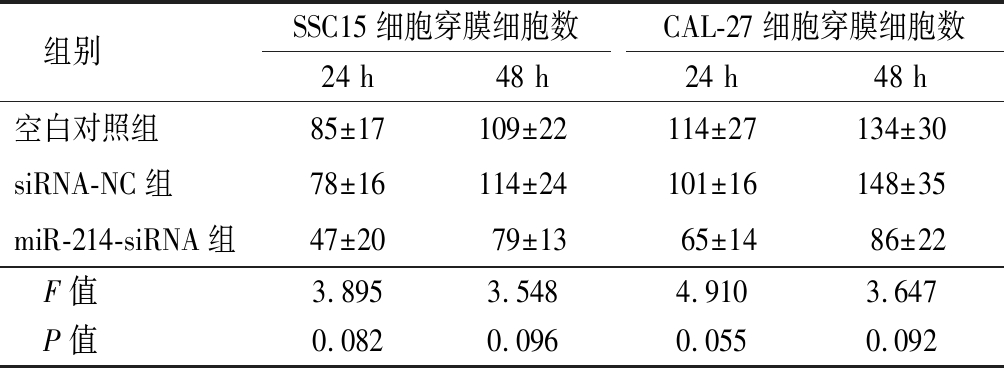
组别SSC15细胞穿膜细胞数24 h48 hCAL-27细胞穿膜细胞数24 h48 h空白对照组85±17109±22114±27134±30siRNA-NC组78±16114±24101±16148±35miR-214-siRNA组47±2079±1365±1486±22 F值3.8953.5484.9103.647 P值0.0820.0960.0550.092
2.5 miR-214敲低后RASSF5蛋白表达水平的变化 SCC-15细胞和CAL-27细胞分别转染miR-214-siRNA组和siRNA-NC组,生长至50%终止培养并进行免疫荧光染色。用DAPI染料使细胞核着蓝色,用A-488染料使RASSF5蛋白着绿色。SCC-15细胞转染miR-214-siRNA组绿色信号比转染siRNA-NC组高,表明SCC-15细胞经miR-214表达水平敲低后RASSF5表达水平高于对照组。同理,CAL-27细胞转染miR-214-siRNA组绿色信号比转染siRNA-NC组高,表明CAL-27细胞经miR-214表达水平敲低后RASSF5的表达水平高于对照组。
应用图像处理软件对细胞的平均荧光强度进行量化后,可见敲低后的细胞RASSF5表达水平高于敲低前(P<0.05),见表4。
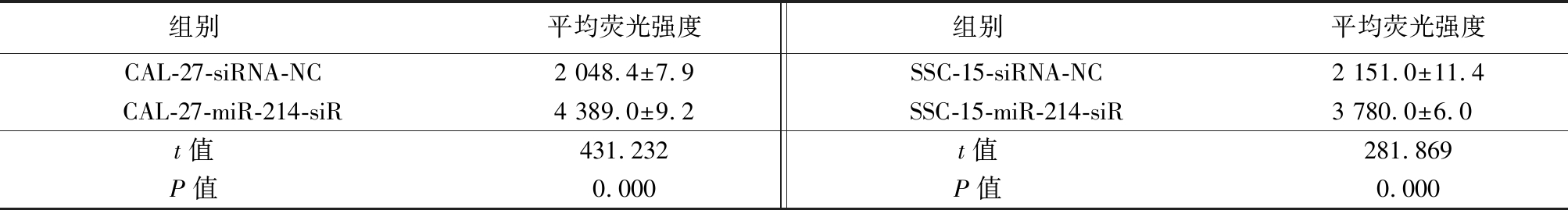
组别 平均荧光强度组别 平均荧光强度CAL-27-siRNA-NC 2 048.4±7.9SSC-15-siRNA-NC 2 151.0±11.4CAL-27-miR-214-siR4 389.0±9.2SSC-15-miR-214-siR3 780.0±6.0 t值 431.232t值 281.869P值 0.000P值 0.000
3 讨 论
miRNA通常作为肿瘤抑制因子或癌基因发挥作用,在某些类型的癌症中经常失调和异常表达,并且它们在致癌过程中起着重要作用。癌症相关miRNA表达改变可成为有价值的诊断标志物,该途径也可能代表多种癌症的新治疗靶点。miR-214由于其在不同类型癌症发展中的关键作用而引起越来越多的关注。在结肠直肠癌中,下调miR-214表达可以减少结肠直肠癌细胞的增殖[9]。在肺癌组织中miR-214被认为显著下调,且功能试验结果证实miR-214在肺癌细胞系中显著抑制细胞生长[10]。然而,miR-214在口腔癌中的作用及潜在的机制仍不清楚。本研究首先用RNA干扰敲低口腔癌细胞株SCC-15和CAL-27中miR-214的表达,在验证RNA干扰实验成功后继续设计细胞功能实验,结果显示miR-214的敲低不仅使细胞的增殖能力降低,并且也降低了口腔癌细胞的迁移和侵袭能力。表明miR-214在口腔癌的发展和进展中可能起着癌基因的作用。
RASSF包含10个成员,RASSF1至RASSF10,并且涉及各种细胞机制,包括细胞凋亡、细胞周期分布和转移。其在多种肿瘤如食管癌、肺癌、乳腺癌等中启动子发生甲基化或表达缺失,导致肿瘤发生发展,并且与肿瘤严重程度及不良预后密切相关[11]。此家族经典子集中RASSF5是鼠类Ras受体Nore1的人类同系物,是唯一同时具有RA和SARAH结构域的RASSF家族成员,目前发现RASFF5在正常组织细胞中广泛表达。体外实验显示,RASSF5在食管鳞状细胞癌[12]和胃贲门腺癌[13]中表达失活,并发生异常高甲基化。说明RASSF5可能是抑癌基因。RASSF5可通过激活MST1信号通路,抑制骨肉瘤细胞增殖、迁移、侵袭并促进细胞凋亡。然而,目前关于口腔癌中RASSF5表达的数据有限。由于RASSF5在多种肿瘤中可发生异常甲基化而导致表达沉默[14-15],故本研究拟探讨其与口腔癌的相关性。通过生物学信息预测Ras受体RASSF5基因可能是miR-214作用的靶基因。免疫荧光染色结果显示,在OSCC细胞系中miR-214和RASSF5水平之间发生显著的负调节。表明口腔癌中miR-214表达水平敲低确实导致抑癌基因RASSF5的改变,这一改变的具体调控途径有待于进一步研究,其可为OSCC的治疗提供新思路。
总之,miR-214在OSCC中可能作为癌基因起作用,本研究提示RASSF5可能参与口腔肿瘤的发生发展。
[1] Ferlay J,Soerjomataram I,Dikshit R,et al. Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer,2015,136(5):E359-386.
[2] Nagai H,Hasegawa S,Uchida F,et al. MicroRNA-205-5p suppresses the invasiveness of oral squamous cell carcinoma by inhibiting TIMP-2 expression[J]. Int J Oncol,2018,52(3):841-850.
[3] Ahn H,Yang JM,Kim H,et al. Clinicopathologic implications of the miR197/PD-L1 axis in oral squamous cell carcinoma[J]. Oncotarget,2017,8(39):66178-66194.
[4] Fukumoto I,Hanazawa T,Kinoshita T,et al. MicroRNA expression signature of oral squamous cell carcinoma:functional role of microRNA-26a/b in the modulation of novel cancer pathways[J]. Br J Cancer,2015,112(5):891-900.
[5] Arunkumar G,Deva Magendhra Rao AK,Manikandan M,et al. Dysregulation of miR-200 family microRNAs and epithelial-mesenchymal transition markers in oral squamous cell carcinoma[J].Oncol Lett,2018,15(1):649-657.
[6] Lin S,Gregory RI. MicroRNA biogenesis pathways in cancer[J]. NatRev Cancer,2015,15(6):321-333.
[7] Lai YH,Liu H,Chiang WF,et al. MiR-31-5p-ACOX1 axis enhances tumorigenic fitness in oral squamous cell carcinoma via the promigratory prostaglandin E2[J]. Theranostics,2018,8(2):486-504.
[8] 牛巍巍,杨春春,段志英,等.微小RNA92a联合胃蛋白酶原在胃癌中的诊断价值[J].河北医科大学学报,2017,38(6):638-641,671.
[9] Zhou Y,Yang C,Wang K,et al. MicroRNA-33b inhibits the proliferation and migration of osteosarcoma cells via targeting hypoxia-inducible factor-1α[J]. Oncol Res,2017,25(3):397-405.
[10] Wu K,Ma J,Zhan Y,et al. Down-regulation of MicroRNA-214 contributed to the enhanced mitochondrial transcription factor a and inhibited proliferation of colorectal cancer cells[J]. Cell Physiol Biochem,2018,49(2):545-554.
[11] Chen X,Du J,Jiang R,et al. MicroRNA-214 inhibits the proliferation and invasion of lung carcinoma cells by targeting JAK1[J]. Am J Transl Res,2018,10(4):1164-1171.
[12] Iwasa H,Hossain S,Hata Y. Tumor suppressor C-RASSF proteins[J]. Cell Mol Life Sci,2018,75(10):1773-1787.
[13] 王博,李永才,齐蕾,等.甲基化修饰对结直肠癌细胞生物学行为的影响及临床应用意义[J].河北医科大学学报,2018,39(1):91-96.
[14] Han L,Dong Z,Wang C,et al. Decreased expression and aberrant methylation of RASSF5A correlates with malignant progression of gastric cardiaadenocaroinoma[J]. Mol Carcinog,2015,54(12):1722-1733.
[15] Zhou XH,Yang CQ,Zhang CL,et al. RASSF5 inhibits growth and invasion and induces apoptosis in osteosarcoma cells through activation of MST1/LATS1 signaling[J]. Oncol Rep,2014,32(4):1505-1512.