内皮和平滑肌细胞来源的neuropilin样分子(endothelial and smooth muscle cell-derived neuropilin-like molecule,ESDN)是一类Ⅰ型跨膜蛋白,其分子内含有一个CUB结构域、一个LCCL结构域和一个凝血因子Ⅴ/Ⅷ同源结构,与Neuropilins结构相似,而Neuropilins可以调控多种生长因子受体的信号途径,推测ESDN可能具有类似的功能。越来越多的研究表明,ESDN在调节血管细胞生长方面起着重要作用[1-3]。Nie等[1]研究发现,ESDN能够通过调节血管内皮生长因子(vascular endothelial growth factor,VEGF)信号途径进而诱导血管内皮细胞增殖、迁移过程,从而促进血管生成;在离体培养的血管平滑肌细胞(vascular smooth muscle cell,VSMC)中,处于增殖状态时ESDN表达显著高于生长抑制的细胞,而ESDN的过度表达则抑制VSMC生长,其分子机制可能与ESDN对血小板衍生因子(platelet-derived growth factor,PDGF)及其受体调控有关。VEGF和PDGF作为一类强效促有丝分裂剂,是介导VSMC增殖和内膜增生的关键因素[4]。ESDN能够调控这2种生长因子的信号途径,表明ESDN的表达可能与血管增生密切相关[1-3]。血管增生是动脉粥样硬化、高血压、血管成形术后再狭窄等心血管疾病中普遍存在的病理生理表现。其主要特征表现为血管损伤后,位于血管中膜的呈收缩表型的VSMC出现表型转化,转变为合成表型,增殖并迁移至内膜从而导致的一种血管重构现象[1-3]。为进一步研究ESDN表达与血管增生的关系,本研究利用本室保存的Esdn基因敲除小鼠及野生型小鼠构建颈总动脉结扎血管内膜增生模型,比较结扎后不同时间Esdn基因敲除(Esdn-/-)小鼠与野生型小鼠血管内膜增生情况,观察Esdn-/-小鼠及野生型小鼠VSMC分化表型标志蛋白平滑肌α-肌动蛋白(smooth muscle α-actin,SM α-actin)和SM22α,以及VSMC增殖表型标志蛋白——骨桥蛋白(osteopontin,OPN)在血管组织中的表达差异变化。通过探究ESDN表达与血管重构的关系,进一步阐明ESDN的表达在VSMC生物学功能改变中的重要作用,这将有助于加深对血管炎性疾病的病理生理过程的理解,可为心血管疾病的防治和癌症控制提供有力武器,并为临床诊断、治疗血管炎性疾病提供新思路。
1 材料与方法
1.1 实验动物及试剂 Esdn-/-小鼠与野生型小鼠,8~12周龄,来自Dr. Mehran Sadeghi(Yale University)馈赠,保存、繁育并饲养于SPF级动物房,IVC系统,清洁饮水,自由取食。环境采用12 h明暗循环,早7:00至晚7:00照明,晚7:00至次日早7:00无照明。所有动物实验均按照河北医科大学动物管理条例进行,实验过程对动物的处置符合动物伦理学要求。本研究所用SM α-actin兔多克隆抗体(ab5694)、SM22α抗体(ab14106)、OPN兔多克隆抗体(ab8448)购自Abcam公司(1∶1 000稀释),β-Actin兔单克隆抗体(4970)购自Cell signaling公司(1∶1 000稀释),抗兔Alexa488免疫荧光二抗购自Invitrogen公司(A-11034,1∶200稀释)。
1.2 实验仪器 FRESCO 17低温离心机(Thermo公司),Centrifuge 5415D离心机(Eppendorf公司),激光共聚焦显微镜(Leica公司),电泳仪、半干式蛋白质印迹转膜槽和发光显影仪(Bio-Rad公司)。
1.3 方法
1.3.1 动物模型的建立与分组 建立小鼠颈总动脉结扎血管内膜增生模型[5],术后将Esdn-/-小鼠、野生型分别随机分为结扎术后3,7,14,21 d组和假手术组(只分离血管,不结扎),每组6只。术后相应时间处死小鼠,迅速分离结扎侧颈总动脉用于实验。
1.3.2 形态学分析 将结扎侧颈总动脉用OCT包埋,液氮快速冷冻,切片,HE染色。正置显微镜下观察、摄照,进行图像分析,计算内膜/中膜(intima/media,I/M)厚度比。
1.3.3 Western blot分析 血管组织加入适量组织裂解液RIPA buffer(150 mmol/L NaCl,50 mmol/L Tris-HCl,pH 7.5,1% NP-40,0.5%脱氧胆酸钠,0.1% SDS,1 mmol/L EDTA,临用前加入complete proteinase inhibitor(Roche Applied Sciences)和phosphatase inhibitor cocktails (Sigma-Aldrich),匀浆,离心分离上清,改良Lowry法蛋白定量,取等量蛋白提取液进行SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)。电转移至PVDF膜上,应用SM α-actin、SM22α和OPN孵育并与相应的二抗反应,化学发光法检测抗原抗体结合区条带,用Image-J软件进行定量分析。
1.3.4 免疫荧光染色 将冰冻切片置于预冷丙酮酸溶液中固定5 min,TBS缓冲液洗涤3次,5 min。5%山羊血清封闭30 min,随后加入抗体4 ℃湿盒过夜,TBS缓冲液洗涤后加入荧光二抗,避光,室温30 min。TBS缓冲液洗涤后,DAPI染核,80%甘油封片。激光共聚焦显微镜观察和摄照。
1.4 统计学方法 应用SPSS 21.0统计软件分析数据。计量资料比较分别采用两独立样本的t检验、F检验和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 野生型小鼠和Esdn-/-小鼠不同时间血管内膜增生情况比较 HE染色结果显示,假手术组( 0 d)和结扎术后3 d,野生型小鼠和Esdn-/-小鼠血管内膜无明显变化;结扎术后7 d,野生型小鼠和Esdn-/-小鼠镜下可见血管中膜内VSMC排列絮乱,内膜呈弥散性增厚,管腔缩小;结扎术后14 d和21 d,野生型小鼠和Esdn-/-小鼠均呈现出增生内膜逐渐增厚、管腔逐渐狭窄的趋势(图1)。OPN是VSMC的标志基因,应用免疫荧光染色技术,结果呈现类似的变化趋势,与野生型小鼠相比,结扎术后14 d、21 d时,野生型小鼠和Esdn-/-小鼠中膜OPN表达显著增强,但与野生型小鼠相比,Esdn-/-小鼠血管组织中OPN表达显著增高(图2)。对图像分析表明随颈总动脉结扎时间的延长,野生型小鼠和Esdn-/-小鼠I/M厚度比值呈明显升高趋势,结扎术后7 d、14 d和21 d时Esdn-/-小鼠I/M厚度比值明显高于野生型小鼠,差异有统计学意义(P<0.05),见表1。
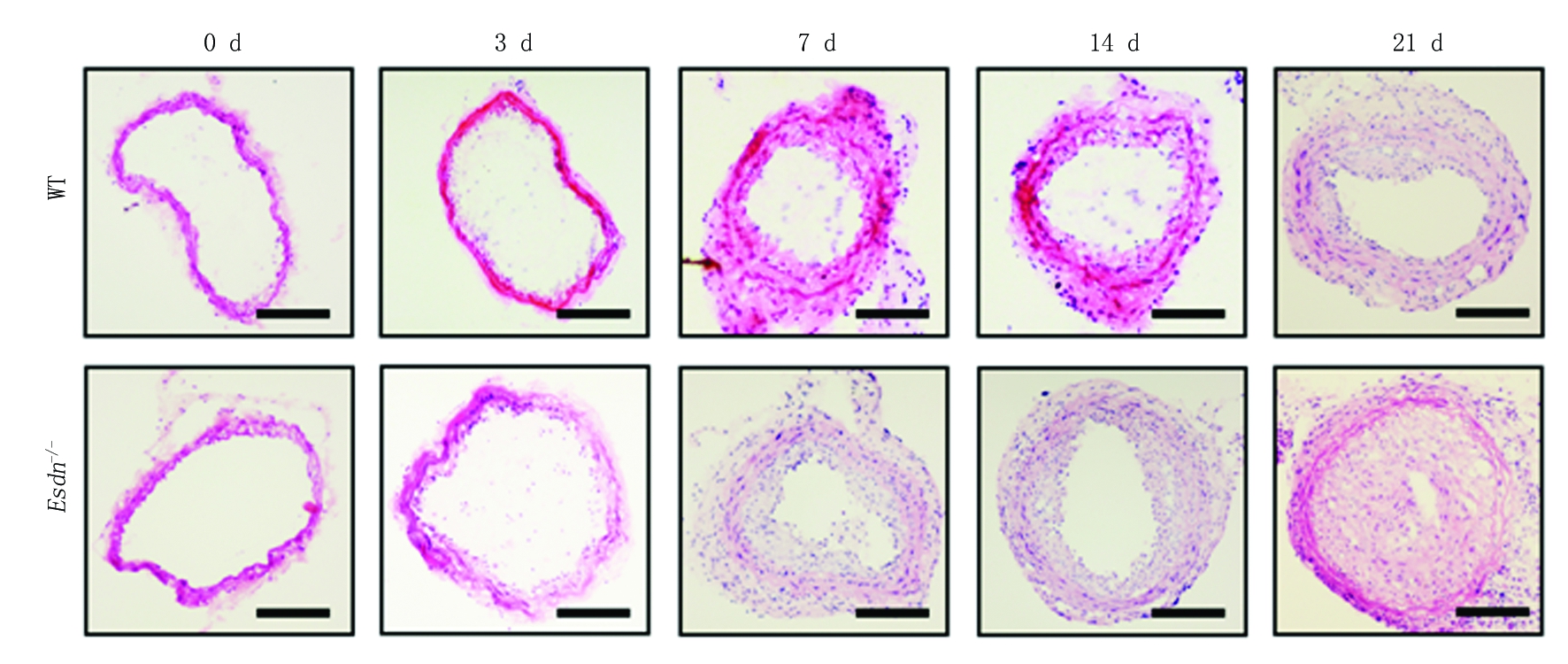
图1 野生型小鼠、Esdn-/-小鼠不同时间血管内膜增生情况(HE染色 ×40)
Figure 1 The vascular hyperplasia in isolated aorta of the WT and Esdn-/-mice at different times after common carotid artery ligatio(HE staining ×40)
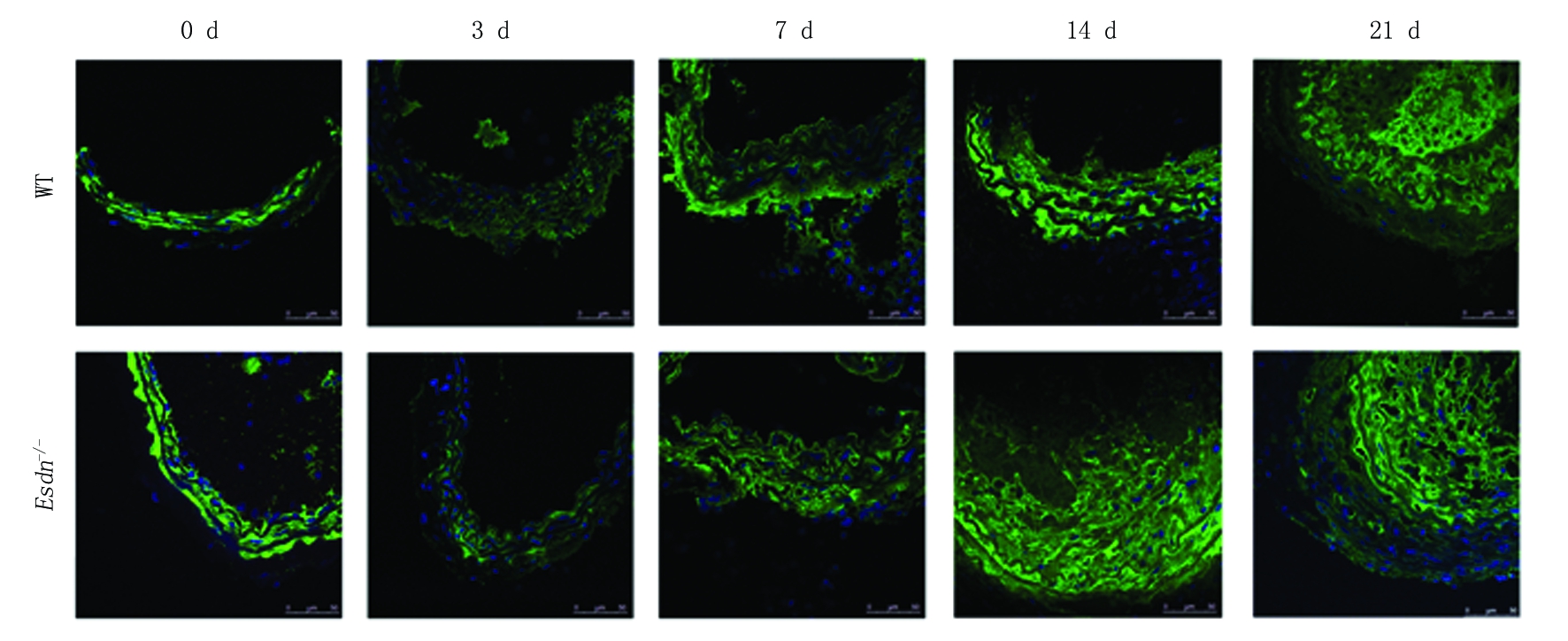
图2 野生型小鼠、Esdn-/-小鼠不同时间表型相关蛋白SM α-actin、SM22α、OPN的表达情况(免疫荧光染色 ×40)
Figure 2 The expression of SM α-actin,SM22α and OPN in the WT and Esdn-/- at different time point after common carotid artery ligation(immunofluorescence staining ×40)
表1 野生型小鼠与Esdn-/-小鼠不同时间I/M厚度比值比较
Table 1 Comparison of I/M ratio in isolated aorta from WT and Esdn-/- mice at different times after common carotid artery ligation![]()
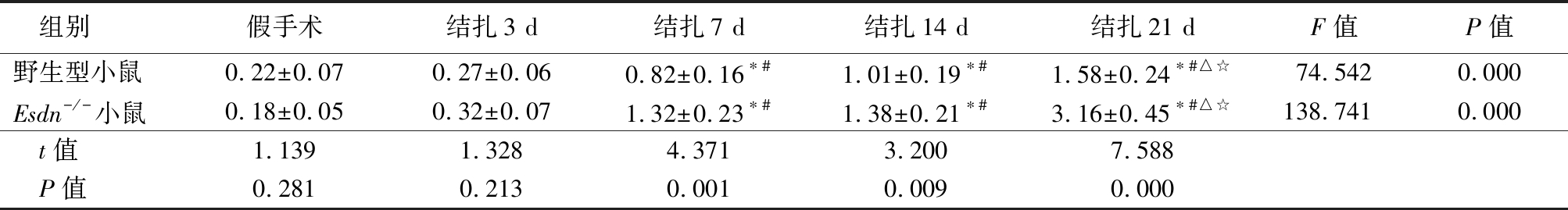
组别假手术结扎3 d结扎7 d结扎14 d结扎21 dF值P值野生型小鼠0.22±0.070.27±0.060.82±0.16∗#1.01±0.19∗#1.58±0.24∗#△☆74.5420.000Esdn-/-小鼠0.18±0.050.32±0.071.32±0.23∗#1.38±0.21∗#3.16±0.45∗#△☆138.7410.000t值1.1391.3284.3713.2007.588P值0.2810.2130.0010.0090.000
*P值<0.05与假手术组比较 #P值<0.05与结扎3 d比较 △P值<0.05与结扎7 d比较 ☆P值<0.05与结扎14 d比较(SNK-q检验)
2.2 ESDN缺失对VSMC表型相关蛋白SM α-actin、SM22α和OPN表达的影响 随小鼠颈总动脉结扎时间延长,与假手术组(0 d)小鼠比较,颈总动脉壁中VSMC收缩表型标志物SM α-actin、SM22α表达逐渐降低,术后3 d,SM α-actin在野生型小鼠和在Esdn-/-小鼠血管组织中的表达显著降低,但术后7 d,与野生型小鼠相比,Esdn-/-小鼠血管组织中SM α-actin的表达显著低于同一时间点的野生型小鼠的表达;血管中SM22α表达呈现类似的变化趋势;增殖型VSMC标志基因OPN的表达与SM α-actin、SM22α表达正好相反,术后3 d,与假手术组(0 d)小鼠比较,颈总动脉壁中该基因的表达在野生型和Esdn-/-小鼠中均显著增高,但术后7 d,Esdn-/-小鼠血管组织中OPN的表达均显著高于同一时间点的野生型小鼠。表明其ESDN可能对维持VSMC处于收缩表型具有重要作用。见图3,表2。
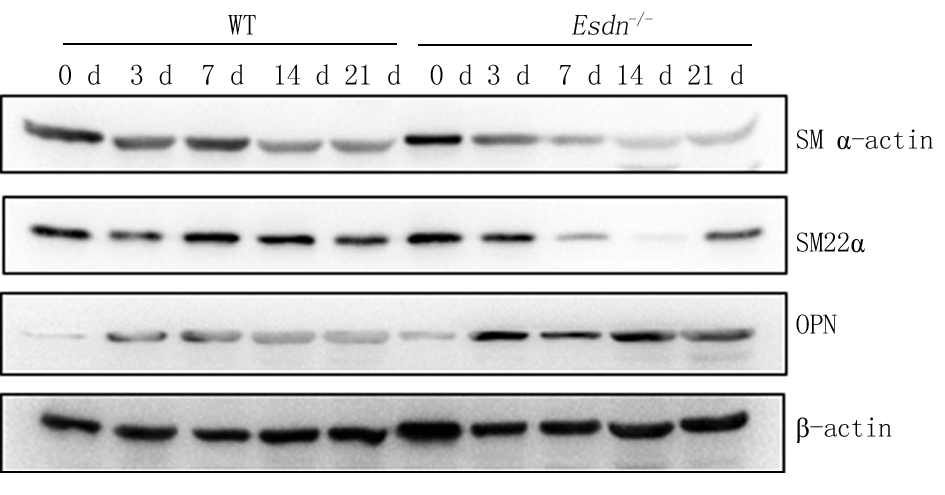
图3 野生型小鼠、Esdn-/-小鼠不同时间表型相关蛋白SM α-actin、SM22α、OPN的表达情况
Figure 3 The expression of SM α-actin,SM22α and OPN in the WT and Esdn-/- mice at different time point after common carotid artery ligation
表2 野生型小鼠与Esdn-/-小鼠不同时间表型相关蛋白SM α-actin、SM22α、OPN表达比较
Table 2 Comparison of SMα-actin,SM22 α and OPN expression in WT and Esdn-/- mice at different times after common carotid artery ligation![]()
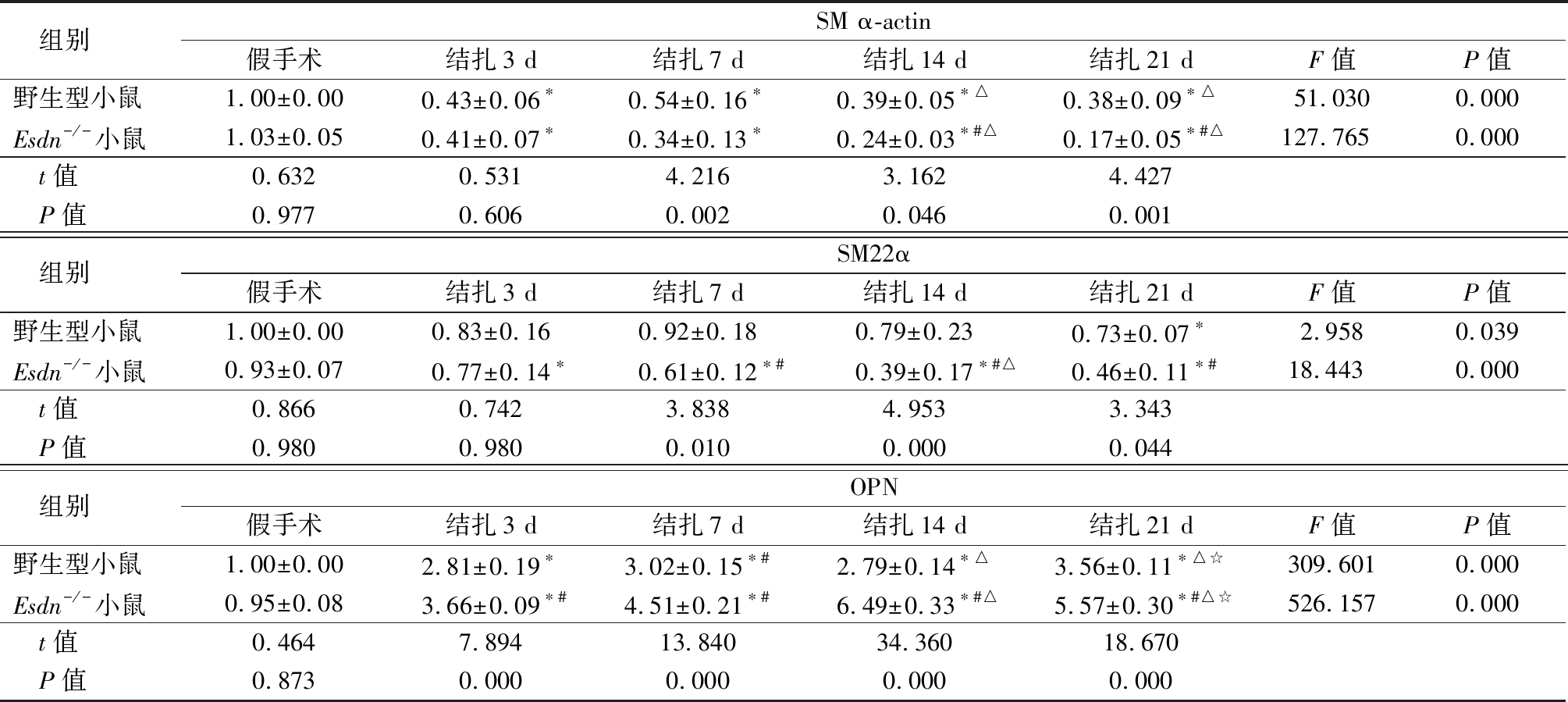
组别SM α-actin假手术结扎3 d结扎7 d结扎14 d结扎21 dF值P值野生型小鼠1.00±0.000.43±0.06∗0.54±0.16∗0.39±0.05∗△0.38±0.09∗△51.0300.000Esdn-/-小鼠1.03±0.050.41±0.07∗0.34±0.13∗0.24±0.03∗#△0.17±0.05∗#△127.7650.000t值0.6320.5314.2163.1624.427P值0.9770.6060.0020.0460.001组别SM22α假手术结扎3 d结扎7 d结扎14 d结扎21 dF值P值野生型小鼠1.00±0.000.83±0.160.92±0.180.79±0.230.73±0.07∗2.9580.039Esdn-/-小鼠0.93±0.070.77±0.14∗0.61±0.12∗#0.39±0.17∗#△0.46±0.11∗#18.4430.000t值0.8660.7423.8384.9533.343P值0.9800.9800.0100.0000.044组别OPN假手术结扎3 d结扎7 d结扎14 d结扎21 dF值P值野生型小鼠1.00±0.002.81±0.19∗3.02±0.15∗#2.79±0.14∗△3.56±0.11∗△☆309.6010.000Esdn-/-小鼠0.95±0.083.66±0.09∗#4.51±0.21∗#6.49±0.33∗#△5.57±0.30∗#△☆526.1570.000t值0.4647.89413.84034.36018.670P值0.8730.0000.0000.0000.000
*P值<0.05与假手术组比较 #P值<0.05与结扎3 d比较 △P值<0.05与结扎7 d比较 ☆P值<0.05与结扎14 d比较(SNK-q检验)
3 讨 论
ESDN是使用改良信号序列捕获技术,从原代培养的人冠状动脉细胞和高转移性肺癌细胞中克隆得到的一种新型跨膜蛋白。Northern印迹研究表明,ESDN在人与胎儿的骨骼肌、胎盘、心脏、结肠、卵巢和前列腺等组织广泛表达,尤其以成人睾丸表达量最高。另外,ESDN在成年大鼠迷走神经,小鼠心脏、肺部、主动脉以及胚胎迷走神经和脑组织也高表达[1]。本研究前期利用cDNA芯片技术发现,正常血管中Esdn、Vegfr-2及Neuropilin-1均为低表达,但它们在动脉粥样硬化血管和发生血管重构的血管(remodeling artery)组织中的表达急剧升高[1-3]。另外,ESDN能够通过调节PDGF、VEGF和表皮生长因子(epidermal growth factor,EGF)信号途径参与血管再生及肿瘤发生发展等病理生理过程[1,3,6-7]。
PDGF信号途径参与对血管重构的调控,而血管重构是血管细胞增殖、坏死、迁移及细胞外基质合成、降解引起血管结构变化的动态过程[7-8]。其中VSMC异常迁移和增殖是新内膜形成过程中的关键因素[9]。作为VSMC表面主要的PDGF受体,PDGFR-β与配体的结合能够调控VSMC表型的可塑性、增殖、迁移、分化、凋亡以及细胞外基质的合成与分泌等生物学功能。研究发现PDGF-BB或者血清可以诱导损伤的人类、小鼠及大鼠内膜中ESDN表达增加[9]。ESDN表达下调一方面促进PDGF与受体的结合,增强PDGFR-β的磷酸化修饰,激活下游一系列相关信号分子;一方面降低配体诱导的PDGFR-β泛素化,与ESDN能够通过抑制胞质泛素连接酶c-Cbl表达,增强PDGFR信号活性有关[10]。
此外,ESDN还参与一些肿瘤发生过程中的EGF信号通路的调控。在神经胶质瘤和肺癌细胞中敲低ESDN,可明显减弱EGF诱导的细胞存活和增殖。其机制为EGFR活化后激活ESDN分子第750位酪氨酸磷酸化,磷酸化的ESDN结合TRAF6,后者激活TRAF6-E3泛素连接酶,进而激活AKT信号通路,促进恶性胶质瘤、肺癌、头颈部肿瘤和黑色素瘤发生发展过程[11]。
本研究利用Esdn-/-小鼠建立颈总动脉结扎血管内膜增生模型,探讨ESDN表达与血管重构的关系。正常生理条件下,血管中膜的VSMC呈收缩表型,但是在某些刺激因子作用下,VSMC发生表型转化,转变为增殖型表型,向内膜迁移并大量增殖。SM α-actin是VSMC的标志蛋白,HE染色和免疫荧光染色结果显示,结扎术后14 d、21 d时,Esdn-/-小鼠内膜增厚程度显著高于野生型小鼠。表明,ESDN表达的缺失可以加剧颈总动脉结扎损伤诱导的血管重构。OPN是VSMC由收缩表型向增殖表型转化的标志基因。SM22α是分化型VSMC特异表达的一种小分子蛋白质,该蛋白的表达活性与VSMC表型状态密切相关[12-15]。近年来研究表明,SM22α的表达通过抑制VSMC表型由收缩型转化成增殖型,从而抑制动脉粥样硬化发生过程中斑块的形成[12]。本研究结果表明,伴随血管重构过程,在Esdn-/-小鼠血管组织中SM α-actin和SM22α表达活性随新生内膜形成逐渐降低,且显著低于同时间点的野生型小鼠;而OPN表达活性随新生内膜形成逐渐增高,且显著高于同时间点的野生型小鼠。由此推断跨膜蛋白ESDN的表达与VSMC表型调控密切相关,可作为一种血管重构的生物标记物。血管重构是血管应对机械应力的一种自我保护模式,血管重塑过度会造成管腔狭窄、血管弹性减退等病理性改变[12]。因此,ESDN可能成为临床治疗血管再狭窄、动脉粥样硬化、高血压等疾病引起的血管重构潜在靶点。
[1] Nie L,Guo X,Esmailzadeh L,et al. Transmembrane protein ESDN promotes endothelial VEGF signaling and regulates angiogenesis[J]. J Clin Invest,2013,123(12):5082-5097.
[2] Li X,Jung JJ,Nie L,et al. The neuropilin-like protein ESDN regulates insulin signaling and sensitivity[J]. Am J Physiol Heart Circ Physiol,2016,310(9):H1184-1193.
[3] Feng H,Lopez GY,Kim CK,et al. EGFR phosphorylation of DCBLD2 recruits TRAF6 and stimulates AKT-promoted tumorigenesis[J]. J Clin Invest,2014,124(9):3741-3756.
[4] Sysol JR,Natarajan V,Machado RF. PDGF induces SphK1 expression via Egr-1 to promote pulmonary artery smooth muscle cell proliferation[J]. Am J Physiol Cell Physiol,2016,310(11):C983-992.
[5] 陈含冰,张雨晴,刘津尧,等.载脂蛋白C1表达与血管内膜増生关系的初步研究[J]. 河北医科大学学报,2017,38(2):125-128.
[6] Aten TM,Redmond MM,Weaver SO,et al. Tyrosine phosphorylation of the orphan receptor ESDN/DCBLD2 serves as a scaffold for the signaling adaptor CrkL[J]. FEBS Lett,2013,587(15):2313-2318.
[7] Liang S,Yu H,Chen X,et al. PDGF-BB/KLF4/VEGF signaling axis in pulmonary artery endothelial cell angiogenesis[J]. Cell Physiol Biochem,2017,41(6):2333-2349.
[8] Lin B,Song X,Yang D,et al. Anlotinib inhibits angiogenesis via suppressing the activation of VEGFR2,PDGFRβ and FGFR1[J]. Gene,2018,654:77-86.
[9] Nurminskaya M,Beazley KE,Smith EP,et al. Transglutaminase 2 promotes PDGF-mediated activation of PDGFR/Akt1 and β-catenin signaling in vascular smooth muscle cells and supports neointima formation[J]. J Vasc Res,2014,51(6):418-428.
[10] Schmoker AM,Weinert JL,Kellett KJ,et al. Dynamic multi-site phosphorylation by Fyn and Abl drives the interaction between CRKL and the novel scaffolding receptors DCBLD1 and DCBLD2[J]. Biochem J,2017,474(23):3963-3984.
[11] Minatsuki S,Miura I,Yao A,et al. Platelet-derived growth factor receptor-tyrosine kinase inhibitor imatinib is effective for treating pulmonary hypertension induced by pulmonary tumor thrombotic microangiopathy[J]. Int Heart J,2015,56(2):245-248.
[12] Lv P,Zhang F,Yin YJ,et al. SM22α inhibits lamellipodium formation and migration via Ras-Arp2/3 signaling in synthetic VSMCs[J]. Am J Physiol Cell Physiol,2016,311(5):C758-767.
[13] Miao SB,Xie XL,Yin YJ,et al. Accumulation of smooth muscle 22α protein accelerates senescence of vascular smooth muscle cells via stabilization of p53 in vitro and in vivo[J]. Arterioscler Thromb Vasc Biol,2017,37(10):1849-1859.
[14] Shu YN,Dong LH,Li H,et al. CKII-SIRT1-SM22α loop evokes a self-limited inflammatory response in vascular smooth muscle cells[J]. Cardiovasc Res,2017,113(10):1198-1207.
[15] Dong LH,Li L,Song Y,et al. TRAF6-mediated SM22α K21 ubiquitination promotes G6PD activation and NADPH production,contributing to GSH homeostasis and VSMC survival in vitro and in vivo[J]. Circ Res,2015,117(8):684-694.