高血压是常见的慢性疾病,同时也是心血管疾病、2型糖尿病和慢性肾病的主要危险因素[1-2]。长期高血压能够改变心脏和血管的结构和功能,是发生高血压靶器官损害和心脑血管并发症的基础。左心室肥厚是高血压的常见并发症,是心力衰竭、急性心肌梗死、卒中和心脏猝死等事件发生的危险因素之一[3],其核心病理改变是心脏组织异常重构[4] 。因此,有效逆转左心室肥厚和延缓心室重塑是治疗高血压的重要目标。微小RNA(miRNA)是一类小的非编码RNA,其在基因表达转录后的调节中起作用。它们是各种细胞活动的强大调节剂,包括细胞生长、分化、发育和细胞凋亡[5]。同样,miRNA在心肌重构、增殖和分化等过程中具有重要的调控作用[6-7],可参与多种器官的纤维化过程[8-10] 。新近研究显示,miRNA-29a-3p与肥厚性心肌病有关,血浆miRNA-29a-3p水平与肥厚性心肌病患者超声心动图和心脏磁共振所测心脏肥厚和纤维化指标相关[11]。因此,本研究探讨miRNA-29a-3p与高血压诱导的心室肥厚和纤维化的关系。
1 资料与方法
1.1 一般资料 选取2014年1月—2015年1月广东省佛山市禅城区中心医院收治的高血压2级以上患者160例,分为单纯高血压组80例和高血压合并左心室肥厚组80例。患者均符合《中国高血压防治指南》[12]中高血压2级诊断标准即收缩压≥160 mmHg,舒张压≥100 mmHg。男性左心室质量指数≥125 g/m2、女性≥110 g/m2确诊为左心室肥厚。排除继发性高血压,中度以上的肝功能不全、肾功能不全和传染性疾病,糖尿病,严重心功能不全。另设年龄性别匹配的90例健康志愿者作为对照组。3组性别、年龄、吸烟、血脂异常、高血压病程(单纯高血压组与高血压合并左心室肥厚组比较)、血糖、体重指数差异均无统计学意义(P>0.05),单纯高血压组和高血压合并左心室肥厚组收缩压、舒张压和左心室质量指数高于对照组,高血压合并左心室肥厚组左心室质量指数高于单纯高血压组,差异有统计学意义(P<0.05),见表1。
表1 3组基础资料比较
Table 1 Comparison of basic data among three groups
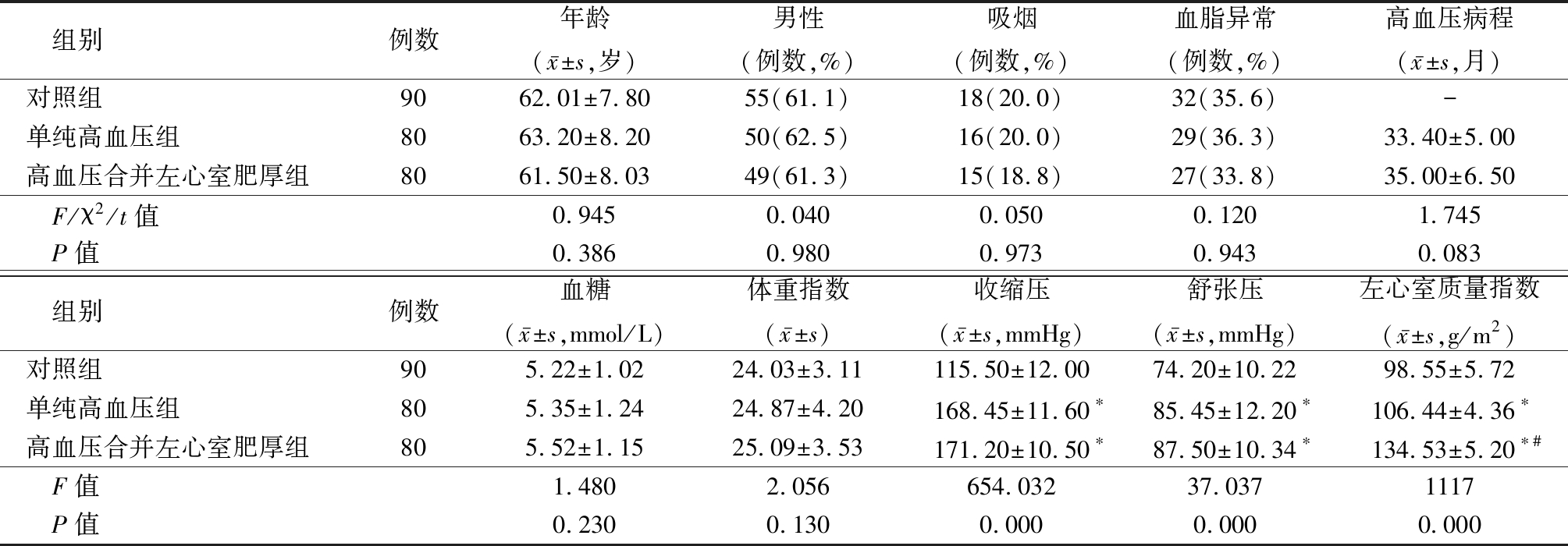
组别例数年龄(x-±s,岁)男性(例数,%)吸烟(例数,%)血脂异常(例数,%)高血压病程(x-±s,月)对照组9062.01±7.8055(61.1)18(20.0)32(35.6)-单纯高血压组8063.20±8.2050(62.5)16(20.0)29(36.3)33.40±5.00高血压合并左心室肥厚组8061.50±8.0349(61.3)15(18.8)27(33.8)35.00±6.50F/χ2/t值0.9450.0400.0500.1201.745P值0.386 0.980 0.973 0.943 0.083组别例数血糖(x-±s,mmol/L)体重指数(x-±s)收缩压(x-±s,mmHg)舒张压(x-±s,mmHg)左心室质量指数(x-±s,g/m2)对照组905.22±1.0224.03±3.11115.50±12.0074.20±10.2298.55±5.72单纯高血压组805.35±1.2424.87±4.20168.45±11.60∗85.45±12.20∗106.44±4.36∗高血压合并左心室肥厚组805.52±1.1525.09±3.53171.20±10.50∗87.50±10.34∗134.53±5.20∗#F值 1.4802.056654.03237.0371117P值0.230 0.130 0.0000.0000.000
*P值<0.05与对照组比较 #P值<0.05与单纯高血压组比较(SNK-q检验)
1.2 方法
1.2.1 超声心动图检查 应用西门子彩色多普勒超声诊断仪,测量患者左心室舒张末期内径、室间隔厚度和左心室后壁厚度,根据公式计算左心室质量指数,重复测量3次,取平均值。
1.2.2 血清miRNA-29a-3p检测 抽取晨空腹时静脉血3 mL,3 000 r/min离心10 min,取上清用miRNeasy Serum/Plasma kit(美国,Qiagen)提取miRNA,并置于-80 ℃超低温冰箱保存。提取出的RNA模板选用(Qiagen)逆转录,生成所需的cDNA之后用miScript SYBR Green PCR Kit(Qiagen)和miScript Prime Assay miRNA-29a-3p对样本中的miRNA-29a-3p进行实时定量荧光扩增,反应条件为95 ℃ 15 min,94 ℃ 15 s,55 ℃ 30 s,70 ℃ 34 s,共40个循环。miRNA-29a-3p引物序列:stem-loop5-CTCAACTGGTGTCGTGGAGTC-GGCAATTCAGTTGAGACCCC-TAT-3;Reverse5-ACACTCCAGCTGGGTTAATGCTAATCGTGA-T-3。U6引物序列:stem-loop5-AGCGGGAAA-TCGTGCGTGACA-3;Reverse5-GTGGACTFGG-GAGAGGACTGG-3。通用下游引物:5-CGCCG-CCCAGTGTTCAGA-3。
1.2.3 Ⅰ型胶原、Ⅲ型胶原、基质金属蛋白酶9检测 抽取受试者晨空腹时静脉血3 mL,3 000 r/min离心10 min,取上清置于-70 ℃的超低温冰箱保存待测。采用双抗体酶联免疫吸附法测定血清Ⅰ型胶原、Ⅲ型胶原、基质金属蛋白酶9水平。试剂盒由美国R&D公司提供,操作严格按说明书进行。
1.3 统计学方法 应用SPSS 21.0统计软件分析数据。计量资料比较分别采用单因素方差分析和SNK-q检验;计数资料比较采用χ2检验;相关性采用Pearson相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 3组血清miRNA-29a-3p相对表达量比较 单纯高血压组和高血压合并左心室肥厚组血清miRNA-29a-3p水平高于对照组,高血压合并左心室肥厚组又高于单纯高血压组,差异均有统计学意义(P<0.05),见表2。
表2 3组血清miRNA-29a-3p水平比较
Table 2 Comparison of serum mirna-29a-3p levels among three groups![]()
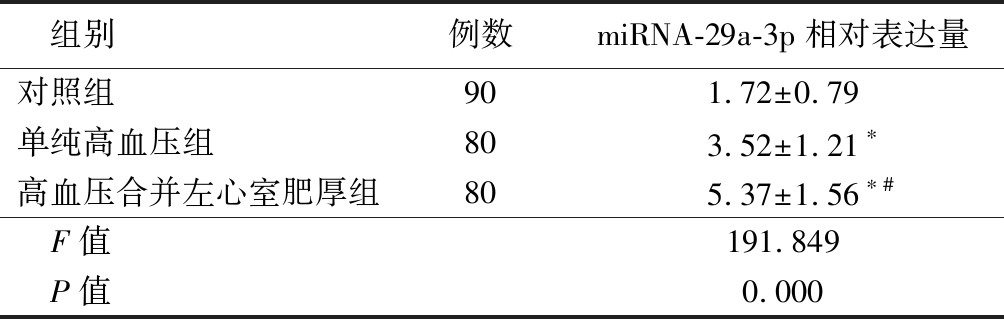
组别例数miRNA-29a-3p相对表达量对照组901.72±0.79单纯高血压组803.52±1.21∗高血压合并左心室肥厚组805.37±1.56∗#F值191.849P值0.000
*P值<0.05与对照组比较 #P值<0.05与单纯高血压组比较(SNK-q检验)
2.2 3组血清纤维化指标比较 单纯高血压组和高血压合并左心室肥厚组血清Ⅰ型胶原、Ⅲ型胶原和基质金属蛋白酶9水平高于对照组,高血压合并左室肥厚组血清Ⅰ型胶原、Ⅲ型胶原和基质金属蛋白酶9水平又高于单纯高血压组,差异均有统计学意义(P<0.05),见表3。
表3 3组血清纤维化指标比较
Table 3 Comparison of serum fibrosis indexes among three groups![]()
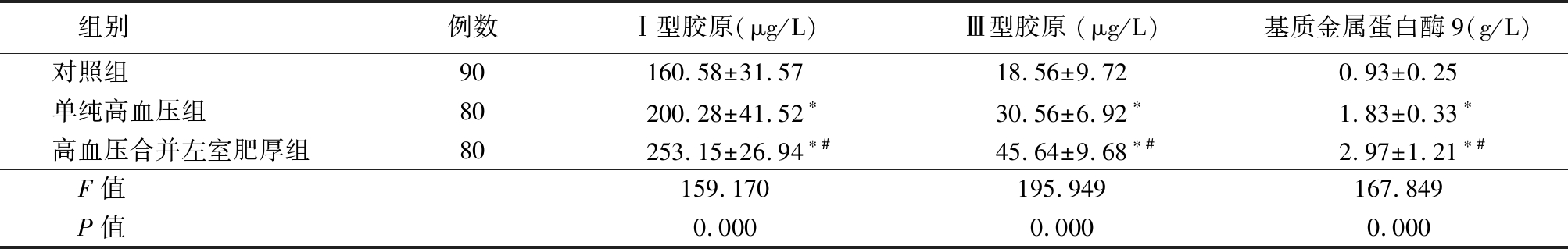
组别例数Ⅰ型胶原(μg/L) Ⅲ型胶原 (μg/L)基质金属蛋白酶9(g/L) 对照组90160.58±31.5718.56±9.720.93±0.25单纯高血压组80200.28±41.52∗30.56±6.92∗1.83±0.33∗高血压合并左室肥厚组80253.15±26.94∗#45.64±9.68∗#2.97±1.21∗#F值159.170195.949167.849P值0.0000.0000.000
*P值<0.05与对照组比较 #P值<0.05与单纯高血压组比较(SNK-q检验)
2.3 相关性分析 高血压合并左心室肥厚组患者血清miRNA-29a-3p的表达水平与心肌纤维化3项指标Ⅰ型胶原、Ⅲ型胶原和基质金属蛋白酶9水平均呈正相关, 见表4。
表4 miRNA-29a-3p水平与心肌纤维化指标的相关性分析
Table 4 Correlation analysis between serum miRNA-29a-3p and fibrosis indices

变量miRNA-29a-3p水平r值P值Ⅰ型胶原(μg/L)0.5820.023Ⅲ型胶原(μg/L)0.4540.041基质金属蛋白酶9(g/L)0.6680.018
3 讨 论
高血压是多种心血管疾病的危险因素,随着高血压病程的进展,特别是长期血压控制不佳,心肌细胞在高压力负荷的刺激下可诱发肥厚性生长应答,主要表现为心肌细胞肥大、心肌纤维化及胞质蛋白合成增强等,这些会引起心脏结构和功能的改变,从而导致左心室心肌肥厚,造成心肌供血、供氧不足,影响心脏收缩及舒张功能,并最终发展为心力衰竭甚至死亡。左心室肥厚是高血压病的常见靶器官损害之一,也是心脑血管事件的独立危险因素[13]。目前对于心肌肥厚的病理生理机制仍未完全阐明。左心室心肌肥厚与神经体液、左心室负荷、内分泌代谢等多种因素相关,心肌肥厚其本身心肌细胞数量并不增多,而是以心肌纤维增粗为主。心肌肥厚对心脏重构起着主要作用,而心脏重构又是心力衰竭发生发展的基本机制,故左心室心肌肥厚的早期诊断和有效防治显得尤其重要。此外,在临床工作中,心肌肥厚多见于高血压性和扩张型心肌病等疾病。高血压左心室肥厚和扩张型心肌病的临床诊断主要依靠心脏彩色超声,但心脏彩色超声对高血压左心室肥厚的检出率并不理想。因此,希望有更好、更简便的方法以提高心肌肥厚的检出率和诊断率。
miRNAs是一类具有高度保守性的非编码小RNA分子,是重要的转录后调控因子,对生物体基因表达发挥精细的调控作用。目前,miRNAs在循环系统、呼吸系统、神经系统、消化系统等疾病中取得了很多的研究进展,miRNAs也成为心血管领域的研究热点。最新研究表明,miRNAs在心血管疾病病理、生理过程中发挥着重要的调节作用,参与了心脏发育、心脏重构、冠状动脉血管病变、心律失常等过程。
近年来的研究证实miRNAs参与了心室肥厚和心脏的纤维化[14-15]。心室肥厚可以是对各种形式的损伤和压力的反应,其在细胞水平上的典型特征是胎儿基因的重新激活、肌节的组装和心肌细胞大小的增加。尽管生理性肥大表明心脏功能有所改善,但对神经体液激活或高血压等病理生理刺激引起的肥厚性生长是病理性的,增加了心力衰竭或猝死的风险[16]。因此,早期筛查和诊断心脏肥大对于改善预后具有重要意义。miRNAs在心肌肥大的发生发展中起着重要的调控作用,如miRNA-1在心肌中呈特异性表达,对心肌肥大具有负性调控作用。在左心室肥厚患者心肌和小鼠肥厚心脏心肌中miRNAs显著下调。表明miRNAs与心肌肥厚存在密切联系。miRNAs可通过调控自噬相关基因Beclin-1激活心肌细胞自噬参与心肌肥厚过程,并发现在左心室肥厚的大鼠中血浆miRNAs升高。患者血浆miRNAs水平与室间隔厚度和舒张末期左心室后壁厚度呈正相关,且血浆中的miRNAs可能是左心室肥厚诊断的重要指标。此外,在细胞层面miRNAs是通过抑制心肌细胞自噬活性和ATG9A蛋白的表达实现其对心肌细胞肥大作用的。miRNA-1对钙/钙调蛋白信号通路具有重要调节功能,而L-型钙通道与心肌肥大发生发展过程密切相关。miRNAs可能通过激活细胞外调节蛋白-丝裂原活化蛋白激酶信号通路导致成纤维细胞的存活和增加生长因子的分泌,促使心肌肥厚和心肌间质纤维化范围的扩大。以上均表明miRNAs在高血压左心室肥厚发病机制中起着重要作用,但这些研究主要集中在动物实验中。
新近研究显示miRNA-29a-3p水平与肥厚性心肌病患者超声心动图和心脏磁共振所测的心脏肥厚和纤维化指标相关。提示miRNA-29a-3p可能参与了心室肥厚和纤维化进程,但具体作用尚不明确。
综上所述,结合本研究结果显示高血压合并心室肥厚患者血清miRNA-29a-3p水平明显高于健康对照组,并与血清纤维化指标Ⅰ型胶原、Ⅲ型胶原、基质金属蛋白酶9水平呈正相关。证实了miRNA-29a-3p与心肌纤维化有关,同时也表明血清miRNA-29a-3p可以作为反映心室肥厚和纤维化的生物标记物用于评估疗效和预后。
[1] Arija V,Villalobos F,Pedret R,et al. Physical activity,cardiovascular health,quality of life and blood pressure control in hypertensive subjects: randomized clinical trial[J]. Health Qual Life Outcomes,2018,16(1):184.
[2] 张玉,吕新湖,林文静,等.H型高血压与冠心病相关性研究[J].河北医科大学学报,2018,39(9):1007-1009,1016.
[3] Park HE,Chon SB,Na SH,et al. Fortified method to screen and detect left ventricular hypertrophy in asymptomatic hypertensive adults: a korean retrospective,cross-sectional study[J]. Int J Hypertens,2018,2018:6072740.
[4] 王晓景,吕仕超,张军平,等.以心肌纤维化为病理基础的高血压病伴左心室肥厚与扩张型心肌病证候学研究[J].中医杂志,2016,57(15):1317-1321.
[5] Saliminejad K,Khorram Khorshid HR,Soleymani Fard S,et al. An overview of microRNAs: Biology,functions,therapeutics,and analysis methods[J].J Cell Physiol,2019,234(5):5451-5465.
[6] Wang Y,Chen S,Gao Y,et al. Serum MicroRNA-27b as a screening biomarker for left ventricular hypertrophy[J]. Tex Heart Inst J,2017,44(6):385-389.
[7] Ming S,Shui-Yun W,Wei Q,et al. miR-139-5p inhibits isoproterenol-induced cardiac hypertrophy by targetting c-Jun[J]. Biosci Rep,2018,38(2):BSR20171430.
[8] Lv W,Fan F,Wang Y,et al. Therapeutic potential of microRNAs for the treatment of renal fibrosis and CKD[J]. Physiol Genomics,2018,50(1):20-34.
[9] Sun J,Li Q,Lian X,et al. MicroRNA-29b mediates lung mesenchymal-epithelial transition and prevents lung fibrosis in the silicosis model[J]. Mol Ther Nucleic Acids,2018,14:20-31.
[10] Sakai M,Spee B,Grinwis GCM,et al. Association of circulating microRNA-122 and microRNA-29a with stage of fibrosis and progression of chronic hepatitis in Labrador Retrievers[J]. J Vet Intern Med,2019,33(1):151-157.
[11] Zhou J,Zhou Y,Wang CX,et al. LncRNA-MIAT regulates fibrosis in hypertrophic cardiomyopathy(HCM) by mediating the expression of miR-29a-3p[J]. J Cell Biochem,2018[Epub ahead of print].
[12] 中国高血压防治指南修订委员会.中国高血压防治指南2010[J].中华心脑血管病杂志,2011,39(7):579-616.
[13] Shenasa M,Shenasa H. Hypertension,left ventricular hypertrophy,and sudden cardiac death[J]. Int J Cardiol,2017,237:60-63.
[14] Ji Y,Qiu M,Shen Y,et al. MicroRNA-327 regulates cardiac hypertrophy and fibrosis induced by pressure overload[J]. Int J Mol Med,2018,41(4):1909-1916.
[15] Bernardo BC,Nguyen SS,Gao XM,et al. Inhibition of miR-154 Protects against cardiac dysfunction and fibrosis in a mouse model of pressure overload[J]. Sci Rep,2016,6:22442.
[16] 肖庆颖,周春霞,赵淑健,等.心肌肥厚的研究进展[J].河北医科大学学报,2015,36(12):1476-1480.