肝细胞肝癌(hepatocellular carcinoma,HCC)是常见的恶性肿瘤之一,也是导致癌症死亡的第二大常见原因。近年来,特别是亚洲国家的发病率和病死率有所增加。虽然手术切除和肝移植是治疗HCC的主要方法,但大多数患者明确诊断时已处于HCC晚期,失去手术机会,导致预后较差。虽然HCC与多种表观遗传学和遗传学改变有关,但其发病的潜在分子机制尚不清楚,缺乏有效的生物标志物,严重制约着HCC的早期诊断、预后评估和治疗。microRNAs(miRNAs) 是一类内源性非编码小RNA分子,由22个核苷酸组成,其主要功能是能够通过与靶mRNAs的3′-UTR结合,抑制靶mRNAs的翻译或剪切,从而对靶基因进行转录后水平的调控。miRNAs与多种人类癌症的发生发展密切相关。研究发现,多种miRNA在肝癌发生发展过程中异常表达,这种异常的表达可以作为肝癌早期诊断、预后评估和治疗的有效靶点[1]。miR-122作为miRNAs家族的重要一员,其在肝癌进程中的作用机制受到人们的关注。有研究表明,miR-122可以通过影响丝氨酸/苏氨酸激酶、细胞周期蛋白G1途径抑制肿瘤进展,但是目前这些研究远远不能解释miR-122抑制肿瘤进展的作用机制,致使对miR-122功能的研究受到了很大的限制。本研究应用生物信息学软件预测miR-122可能的靶基因,并应用双萤光素酶实验及Western blot实验进行验证,确定miR-122在肝癌细胞中的靶基因,进一步行体外细胞实验,验证miR-122及其靶基因对肝癌细胞生物活性的影响,旨在为深入研究miR-122在HCC进程中的作用机制提供研究线索,并为临床探索HCC早期诊断、治疗HCC的有效途径提供可靠依据。
1 材料与方法
1.1 miR-122靶基因的生物信息学分析 应用生物信息学软件microRNA.org(http://www.microrna.org)、TargetScan(http://www.targetscan.org/)和miRanda(http://microrna.sanger.ac.uk/)预测miR-122的可能的靶基因。
1.2 体外细胞实验
1.2.1 肝癌细胞培养 人肝癌细胞株SMMC7721和Hep3B购自中国科学院。肝癌细胞株正常传代并维持于含有 10%胎牛血清的DMEM培养基中,于含有 5% CO2的37 ℃细胞培养箱中培养。
1.2.2 双荧光素酶报告基因实验 将LMNB2 UTR的野生型和突变体插入荧光素酶下游,分别构建pGL3-LMNB2 UTR WT和pGL3-LMNB2 UTR Mut质粒,并转染到SMMC7721细胞中,同时在SMMC7721细胞中转染miR-122 mimics。使用双荧光素酶检测系统检测荧光素酶活性。并应用肾荧光素酶活性对结果进行标准化。
1.2.3 Western blot实验 将对数生长期的人肝癌细胞株Hep3B和SMMC7721接种于6孔板中常规培养,待细胞株生长至80%时,分别转染miR-122 mimics和miR-122 ASO,各组均设立空白对照。继续培养48 h后每孔加入RIPA 裂解液进行细胞裂解,4 ℃环境作用30 min,收集上清定量,然后按比例与上样缓冲液混匀,100 ℃煮5 min后放置10 min,应用10%SDS-PAGE进行电泳,并电转移至硝酸纤维素膜上。应用5%脱脂牛奶封闭2 h,加入LMNB2抗体(1∶1 000)和β-actin抗体(1∶5 000), 4 ℃过夜,应用TBST洗涤。加入抗兔抗体(1∶2 500),室温下孵育1 h,加入发光试剂,于暗室曝光、压片、显影、定影。测定靶基因条带亮度值,绘制柱状。
1.2.4 Transwell细胞侵袭实验 将对数生长期的人肝癌细胞株Hep3B和SMMC7721接种于6孔板中常规培养,待细胞株生长至80%时,分别转染LMNB2质粒和空载体质粒(pCMV6)、LMNB2小干扰RNA(siRNA)和对照质粒,各组均设立空白对照。继续培养48 h,将2×105个细胞与基质胶加入Transwell小室上腔室,下腔室加入含有10%胎牛血清的细胞培养基。24 h后对下腔室中的细胞进行染色。
1.2.5 菌落形成实验 将对数生长期的人肝癌细胞株Hep3B和SMMC7721接种于6孔板中常规培养,待细胞株生长至80%时,分别转染LMNB2质粒和空载体质粒(pCMV6)、LMNB2小干扰RNA(siRNA)和对照质粒。继续培养48 h,将2 mL 含有500个细胞的培养基放入6孔板中,孵育2周。然后用甲醛固定细胞10 min,染色,计数菌落数量。
1.3 统计学方法 应用SPSS 17.0统计软件处理数据。计量资料比较采用两独立样本的t检验。 P<0.05为差异有统计学意义。
2 结 果
2.1 双荧光素酶报告基因实验 野生型转染miR-122 mimics后荧光素酶活性弱于对照组,差异有统计学意义(P<0.05);突变体转染miR-122 mimics后荧光素酶活性与对照组差异无统计学意义(P>0.05)。见表1。
表1 双荧光素酶报告基因实验检测miR-122对LMNB2 UTR的野生型和突变体中荧光素酶活性的影响
Table 1 The effect of mir-122 on luciferase activity in the wild type and mutant of LMNB2 UTR was determined by dual luciferase reporter assay![]()
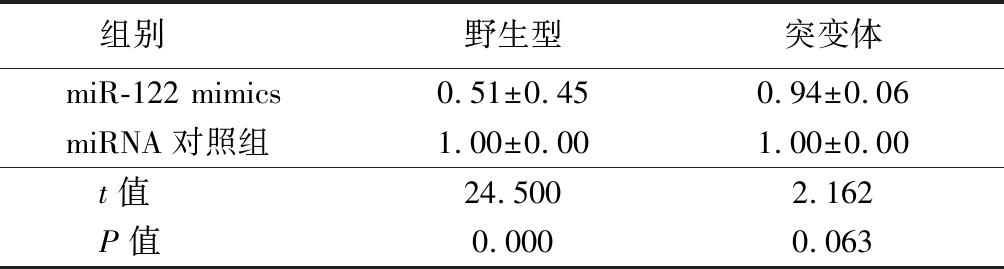
组别野生型突变体miR-122 mimics0.51±0.450.94±0.06miRNA对照组1.00±0.001.00±0.00 t值24.5002.162 P值0.0000.063
2.2 Western blot实验 在肝癌细胞Hep3B中沉默miR-122表达,LMNB2表达水平明显高于对照组,差异有统计学意义(P<0.05),见表2。
表2 Western blot实验检测在Hep3B细胞中miR-122对LMNB2表达的影响
Table 2 Western blot assay was performed to detect the effect of mir-122 on LMNB2 expression in Hep3B cells![]()

组别 LMNB2miR-122 ASO2.29±0.15ASO 对照组 1.00±0.00t值 19.881P值 0.000
2.3 Western blot实验 在肝癌细胞SMMC7721中过表达miR-122后LMNB2表达水平明显低于对照组,差异有统计学意义(P<0.05),见表3。
表 3 Western blot实验检测在SMMC7721细胞中miR-122对LMNB2表达的影响
Table 3 Western blot assay was performed to detect the effect of mir-122 on LMNB2 expression in SMMC7721 cells![]()

组别LMNB2miR-122 mimics0.33±0.02mimics对照组 1.00±0.00 t值70.624 P值0.000
2.4 Transwell细胞侵袭实验 在肝癌细胞Hep3B中过表达LMNB2,肝癌细胞的侵袭及迁移能力明显强于对照组,差异有统计学意义(P<0.05);在肝癌细胞SMMC7721中沉默LMNB2表达,肝癌细胞的侵袭及迁移能力明显低于对照组, 差异有统计学意义(P<0.05)。见表4,5。
表4 Transwell细胞侵袭实验检测LMNB2对Hep3B细胞侵袭、迁移的影响
Table 4 Transwell cell invasion assay was performed to detect the effect of LMNB2 on invasion and migration of Hep3B cells![]()

组别细胞迁移数量Plasmid191.80±10.33对照组83.20±6.42 t值19.968 P值0.000
表5 Transwell细胞侵袭实验检测LMNB2对SMMC7721细胞侵袭、迁移的影响
Table 5 Transwell cell invasion assay was performed to detect the effect of LMNB2 on invasion and migration of SMMC7721 cells![]()

组别细胞迁移数量SiRNA93.20±5.89对照组142.60±8.02 t值11.102 P值0.000
2.5 菌落形成实验 在肝癌细胞Hep3B中过表达LMNB2,肝癌细胞的增殖能力明显强于对照组,差异有统计学意义(P<0.05);在肝癌细胞SMMC7721中沉默LMNB2表达,肝癌细胞的增殖能力明显低于对照组,差异有统计学意义(P<0.05)。见表6,7。
表6 菌落形成实验检测LMNB2对Hep3B细胞增殖的影响Table 6 The effect of LMNB2 on the proliferation of Hep3B cells was detected by colony formation assay![]()

组别菌落数量Plasmid55.60±3.51对照组23.60±2.07 t值17.562 P值0.000
表7 菌落形成实验检测LMNB2对SMMC7721细胞增殖的影响
Table 7 The effect of LMNB2 on the proliferation of SMMC7721 cells was detected by colony formation assay![]()

组别菌落数量siRNA25.40±1.67对照组70.00±3.61 t值25.089 P值0.000
3 讨 论
肝细胞肝癌是常见的恶性肿瘤之一,在我国其发病率远远高于其他国家,严重威胁着我国人民的生命健康。针对HCC的治疗,最有效的方法就是外科手术切除和肝脏移植,然而在我国肝细胞肝癌患者大部分存在肝炎后肝硬化背景,其肝脏功能较差,严重限制了外科手术的应用。另外,部分患者明确诊断时已经处于肿瘤晚期,失去了手术的机会。因此,化疗、靶向治疗等手段对于HCC患者具有重要意义。虽然HCC与多种表观遗传学和遗传学改变有关,但其发病的潜在分子机制尚不清楚,缺乏有效的生物标志物,严重制约着HCC靶向治疗的发展。目前许多研究结果表明,非编码 RNA 分子在肿瘤的发生发展过程中发挥着重要作用。
到目前为止,在对肝癌的研究中发现,多种miRNA在肝癌的发生发展过程中异常表达,这种异常的表达可以作为肝癌早期诊断、预后评估和治疗的有效靶点。miR-122作为miRNAs家族的重要一员,其在许多疾病的进程中发挥着重要作用,特别是在肿瘤发生发展过程中的作用受到了广泛关注[1]。在鼻咽癌细胞株HONE-1中抑制miR-122表达,可以抑制鼻咽癌细胞的凋亡,同时在鼻咽癌细胞中抑制miR-122表达,细胞中磷酸化PI3K及磷酸化Akt的表达明显低于对照组,表明miR-122可以通过激活PI3K/Akt途径抑制鼻咽癌细胞的增殖,其在鼻咽癌的发生发展过程中发挥着重要作用[2]。卵巢癌作为妇科最常见的恶性肿瘤之一,有研究发现在卵巢癌细胞SKOV3 和OVCAR3中过表达miR-122可以明显抑制卵巢癌细胞的增殖、迁移和侵袭能力,在卵巢癌细胞中过表达miR-122可以显著抑制P4HA1表达及上皮间充质转换(epithelial mesenchymal transition,EMT)进程。说明miR-122可以通过抑制P4HA1表达影响EMT进程,从而抑制卵巢癌细胞的增殖、迁移及侵袭[3]。膀胱癌是一类起源于膀胱上皮层的恶性肿瘤,转录因子CREB1在膀胱癌组织及膀胱癌细胞T24、UM-UC-3、J82中的表达明显升高,进一步研究发现在膀胱癌细胞中上调miR-122表达可以抑制CREB1表达,并应用双荧光素酶报告实验证实CREB1为miR-122下游靶点,表明在膀胱癌细胞中miR-122可以通过抑制CREB1表达,抑制膀胱癌细胞的增殖及侵袭能力[4]。胆管癌虽然不是多发肿瘤类型,但其发病隐秘、早期诊断困难,受到广泛关注。在胆管癌组织和胆管癌细胞中ALDOA异常过表达。在胆管癌细胞中抑制ALDOA表达可明显促进肿瘤细胞凋亡、抑制肿瘤细胞增殖和侵袭。进一步深入研究发现ALDOA受miR-122的靶向调控,在胆管癌细胞中过表达miR-122可以明显下调ALDOA,从而促进细胞凋亡、抑制细胞增殖、侵袭[5]。miR-122在肝脏疾病的发生发展过程中发挥着重要作用,如各种原因引起的的肝损伤、脂肪肝、病毒性肝炎及肝癌等。在肝损伤中药物性肝损因发病率高备受关注,有研究表明,miR-122在药物性肝损伤的诊断过程中具有高特异度和敏感度,并可作为药物性肝损伤的治疗靶点[6]。随着生活水平的不断提高,非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)的发病率逐年升高。有研究发现,在NAFLD发病早期肝内miR-122表达明显降低,降低程度与病情严重程度相关,同时发现miR-122表达降低可导致肝脏纤维化失代偿,增加了肝癌的发生风险[7]。病毒性肝炎在我国高发,特别是乙型病毒性肝炎,其也是我国肝细胞肝癌高发的主要因素。在对病毒性肝炎研究的过程中发现,乙型病毒性肝炎患者血清中miR-122的表达变化与乙型肝炎病毒DNA水平呈显著相关性,提示miR-122可能是乙型病毒性肝炎的一个有效治疗靶点[8]。丙型病毒性肝炎在我国发病率虽然较低,但其对肝脏造成的危害更加严重,miR-122在丙型肝炎病毒RNA复制过程中发挥着重要作用,有研究表明miR-122可结合到丙型肝炎病毒RNA的 5′ UTR,使丙型肝炎病毒的复制更加稳定[9-11]。HCC是肝脏疾病中最为严重的疾病,miR-122在HCC中的作用机制也受到了关注。miR-122可以作为HCC早期诊断及预后评估的有效指标。miR-122可以通过抑制耐药基因MDR1提高肝癌细胞对奥沙利铂的敏感性。中药成分黄连素可以通过上调肝癌细胞中miR-122表达,抑制肝癌细胞的增殖、迁移和侵袭。所以,miR-122在肿瘤及肝脏疾病的发生发展过程中发挥着重要作用,为一些肿瘤和肝脏疾病的诊断及治疗提供了一定的分子生物学基础。但是目前针对miR-122在HCC中的具体分子机制尚不明确,不能够为HCC确定一个早期诊断、有效治疗及预后评估的分子靶标。
针对目前的研究现状,本研究应用生物信息学软件预测miR-122的靶基因,并应用荧光素酶报告基因实验和Western blot实验证实miR-122对靶基因的调控作用。然后应用菌落形成试验和Transwell细胞侵袭实验分析靶基因对肝癌细胞生物活性的影响。最终发现LMNB2是miR-122的下游靶基因;miR-122可降低肝癌细胞中LMNB2的表达;在肝癌细胞Hep3B中过表达LMNB2可促进肝癌细胞的增殖、迁移和侵袭;在肝癌细胞SMMC7721中抑制LMNB2表达,可降低肝癌细胞的增殖、迁移和侵袭。总之,miR-122可以通过靶定LMNB2抑制肝癌细胞的生物活性,其可以作为肝细胞肝癌早期诊断指标及治疗靶点。
[1] 李晓明,李胜棉.血清miRNAs检测在肝癌中的临床应用价值[J].河北医科大学学报,2018,39(4):492-496.
[2] Cheng C,Xiaohua W,Ning J,et al. MiR-122 exerts anti-proliferative and apoptotic effects on nasopharyngeal carcinoma cells via the PI3K/AKT signaling pathway[J]. Cell Mol Biol(Noisy-le-grand),2017,64(13):21-25.
[3] Duan Y,Dong Y,Dang R,et al. MiR-122 inhibits epithelial mesenchymal transition by regulating P4HA1 in ovarian cancer cells[J]. Cell Biol Int,2018,42(11):1564-1574.
[4] Guo L,Yin M,Wang Y,et al. CREB1,a direct target of miR-122,promotes cell proliferation and invasion in bladder cancer[J]. Oncol Lett,2018,16(3):3842-3848.
[5] Xu Z,Liu G,Zhang M,et al. miR-122-5p Inhibits the Proliferation,Invasion and Growth of Bile Duct Carcinoma Cells by Targeting ALDOA[J]. Cell Physiol Biochem,2018,48(6):2596-2606.
[6] Howell LS,Ireland L,Park BK,et al. MiR-122 and other microRNAs as potential circulating biomarkers of drug-induced liver injury[J]. Expert Rev Mol Diagn,2018,18(1):47-54.
[7] Baranova A,Maltseva D,Tonevitsky A,et al. Adipose may actively delay progression of NAFLD by releasing tumor-suppressing,anti-fibroticmiR-122 into circulation[J]. Obes Rev,2019,20(1):108-118.
[8] Akuta N,Suzuki F,Kobayashi M,et al. Circulating microRNA-122 levels are important predictor of hepatitis B virus surface antigen seroclearance[J]. J Med Virol,2018,90(10):1586-1592.
[9] Amador-Ca izares Y,Panigrahi M,Huys A,et al. miR-122,small RNA annealing and sequence mutations alter the predicted structure of the Hepatitis C virus 5′ UTR RNA to stabilize and promote viral RNA accumulation[J]. Nucleic Acids Res,2018,46(18):9776-9792.
izares Y,Panigrahi M,Huys A,et al. miR-122,small RNA annealing and sequence mutations alter the predicted structure of the Hepatitis C virus 5′ UTR RNA to stabilize and promote viral RNA accumulation[J]. Nucleic Acids Res,2018,46(18):9776-9792.
[10] Schult P,Roth H,Adams RL,et al. microRNA-122 amplifies hepatitis C virus translation by shaping the structure of the internal ribosomal entry site[J]. Nat Commun,2018,9(1):2613.
[11] Yan Y,Li C,Sun B,et al. DCAF1 is involved in HCV replication through regulation of miR-122[J]. Arch Virol,2018,163(4):977-985.