桥本甲状腺炎(Hashimoto thyroiditis,HT)和Graves病(Graves disease,GD)为自身免疫性甲状腺疾病(autoimmune thyroid disease,AITD)[1] ,两者关系密切,均伴有甲状腺肿大,甲状腺功能均先亢进后减退,二维超声均表现为甲状腺增大、回声分布不均匀、 血流丰富[2], 且两者可因促甲状腺激素受体抗体(thyrotropin receptor antibody,TRAb)、甲状腺球蛋白抗体(thyroglobulin antibody,TGAb)等自身抗体的消长而相互转变。另有研究表明,维生素D部分通过旁分泌方式调节免疫细胞发挥免疫调节作用,低浓度维生素D可促进自身免疫性炎症发生[3-5],是甲状腺自身免疫发展的重要危险因素。血清25羟维生素D(25 hydroxyvitamin D,25-OHD)水平相对稳定,是评价维生素D状况的理想指标。因此,本研究对初诊HT和GD患儿血清25-OHD水平以及甲状腺功能等相关指标进行分析,旨在探讨HT和GD患儿维生素D状况以及维生素D是否在HT和GD内在联系中发挥作用,报告如下。
1 资料与方法
1.1 一般资料 收集2016年1月—2017年12月初诊于河北医科大学第二医院儿科的石家庄汉族HT患儿40例和GD患儿37例。所有患儿均无抗甲状腺药物治疗史,无肝、肾、心血管及遗传性疾病史,无骨骼发育异常,无肝炎、结核等传染性疾病史;采血前6个月内均未应用糖皮质激素、抗癫痫药等影响维生素D代谢的药物。HT组男性9例,女性31例,年龄5.0~13.8岁,平均(9.73±2.12)岁,冬春季(12月—次年5月)初诊发病16例,夏秋季(6—11月)初诊发病24例;GD组男性4例,女性33例,年龄6.5~12.9岁,平均(10.43±1.67)岁,冬春季初诊发病15例,夏秋季初诊发病22例。2组性别、年龄、初诊发病时间差异均无统计学意义(P>0.05),具有可比性。
1.2 样本采集及检测 所有患儿于初诊时采集清晨空腹静脉血4 mL,置不抗凝管,待血液充分凝固后,以3 000 r/min离心5 min,留取血清,化学发光法(Siemens Advia Centaur XP )测定促甲状腺激素(thyrotropin,TSH)、总甲状腺素(total thyroxin,TT4)、总三碘甲腺原氨酸(total triiodothyronine,TT3)、游离甲状腺素(free thyroxine,FT4)、游离三碘甲腺原氨酸(free triiodothyronine,FT3),电化学发光法(Roche Cobas e601)测定TRAb、TGAb,酶联免疫吸附测定法检测 25-OHD(IDS,英国),电化学法(SR-I-100尿碘专用型检测仪)测定晨起中段尿尿碘。同一医师超声(西门子s2000检测仪)测定甲状腺左右叶长、宽、厚度,每个变量测3次,取平均值,计算甲状腺体积=0.479×(左叶长×宽×厚十右叶长×宽×厚)。
1.3 统计学方法 应用SPSS 21.0统计软件分析数据。正态分布计量资料比较采用两独立样本的t检验,非正态分布计量资料比较采用秩和检验;计数资料比较采用χ2检验;正态资料相关性采用Pearson相关分析,非正态资料相关性采用Spearman秩相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 HT与GD患儿血清25-OHD及甲状腺相关参数比较 HT组FT3、FT4、TT3、TT4、TRAb显著低于GD组,TSH、TGAb显著高于GD组,差异均有统计学意义(P<0.05);2组25-OHD、TPOAb差异无统计学意义(P>0.05)。见表1。
表1 HT与GD组 25-OHD及甲状腺相关参数比较
Table 1 Comparison of 25-OHD and thyroid related parameters between HT and GD groups![]()
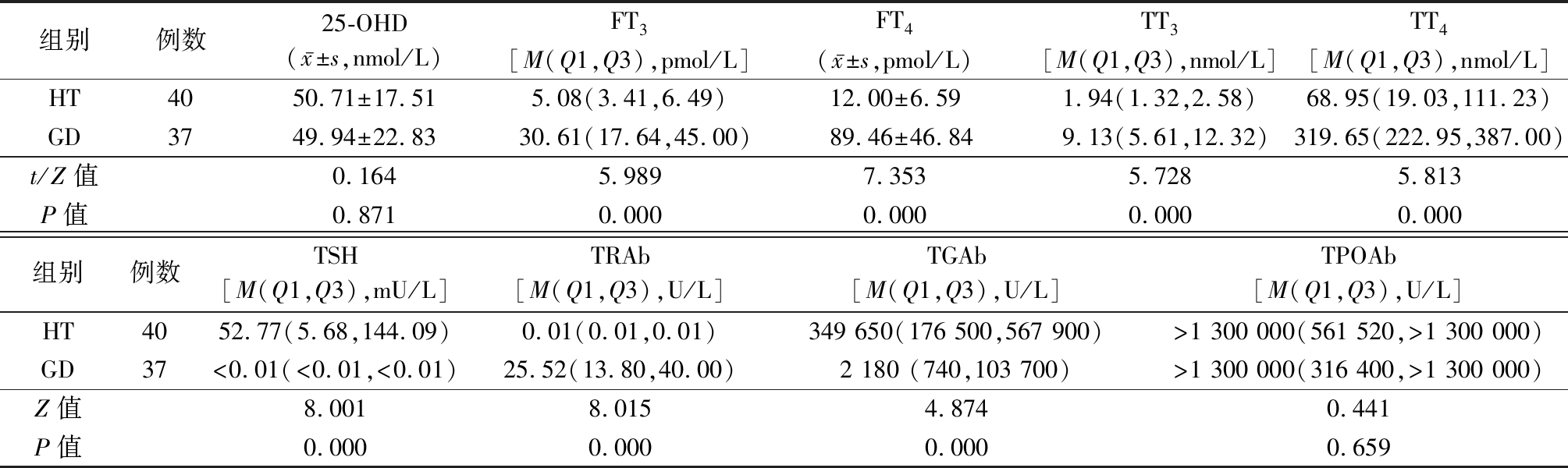
组别例数25-OHD(x-±s,nmol/L)FT3[M(Q1,Q3),pmol/L]FT4(x-±s,pmol/L)TT3[M(Q1,Q3),nmol/L]TT4[M(Q1,Q3),nmol/L]HT4050.71±17.515.08(3.41,6.49)12.00±6.591.94(1.32,2.58)68.95(19.03,111.23)GD3749.94±22.8330.61(17.64,45.00)89.46±46.849.13(5.61,12.32)319.65(222.95,387.00)t/Z值0.1645.9897.3535.7285.813P值0.8710.0000.0000.0000.000组别例数TSH[M(Q1,Q3),mU/L]TRAb[M(Q1,Q3),U/L]TGAb[M(Q1,Q3),U/L]TPOAb[M(Q1,Q3),U/L]HT4052.77(5.68,144.09)0.01(0.01,0.01)349 650(176 500,567 900)>1 300 000(561 520,>1 300 000)GD37<0.01(<0.01,<0.01)25.52(13.80,40.00)2 180 (740,103 700)>1 300 000(316 400,>1 300 000)Z值8.0018.0154.8740.441P值0.0000.0000.0000.659
2.2 有甲状腺体积结果的34例HT与20例GD患儿甲状腺体积、25-OHD和相关抗体比较 HT组TGAb显著高于GD组, TRAb显著低于GD组,差异均有统计学意义(P<0.05);2组甲状腺体积、25-OHD和TPOAb差异均无统计学意义(P>0.05)。见表2。
表2 HT与GD组25-OHD、甲状腺体积及相关抗体比较
Table 2 Comparison of 25-OHD,thyroid volume and related antibodies between HT and GD groups
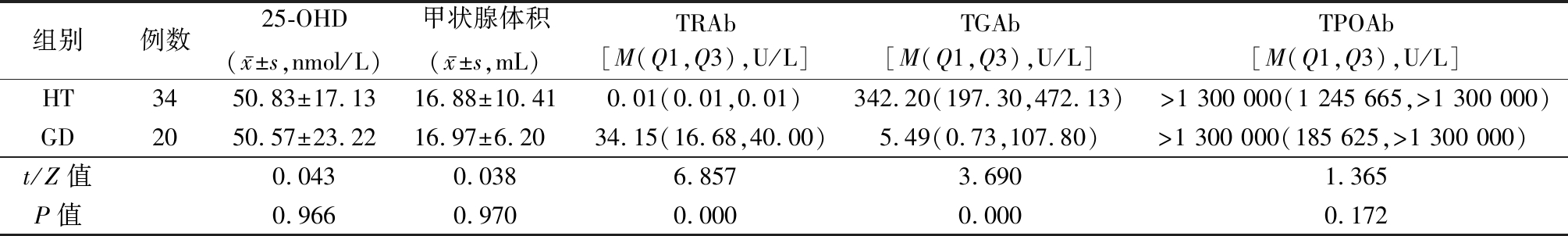
组别例数25-OHD(x-±s,nmol/L)甲状腺体积(x-±s,mL)TRAb[M(Q1,Q3),U/L]TGAb[M(Q1,Q3),U/L]TPOAb[M(Q1,Q3),U/L]HT3450.83±17.1316.88±10.410.01(0.01,0.01)342.20(197.30,472.13)>1 300 000(1 245 665,>1 300 000)GD2050.57±23.2216.97±6.2034.15(16.68,40.00)5.49(0.73,107.80)>1 300 000(185 625,>1 300 000) t/Z值0.0430.0386.8573.6901.365P值0.9660.9700.0000.0000.172
2.3 有尿碘结果的40例HT与18例GD患儿25-OHD和相关抗体比较 HT组TGAb显著高于GD组,TRAb显著低于GD组,差异有统计学意义(P<0.05);2组尿碘、25-OHD和TPOAb差异均无统计学意义(P>0.05)。见表3。
表3 HT与GD组25-OHD、尿碘及相关抗体比较
Table 3 Comparison of 25-OHD,urinary iodine and related antibodies between HT and GD groups
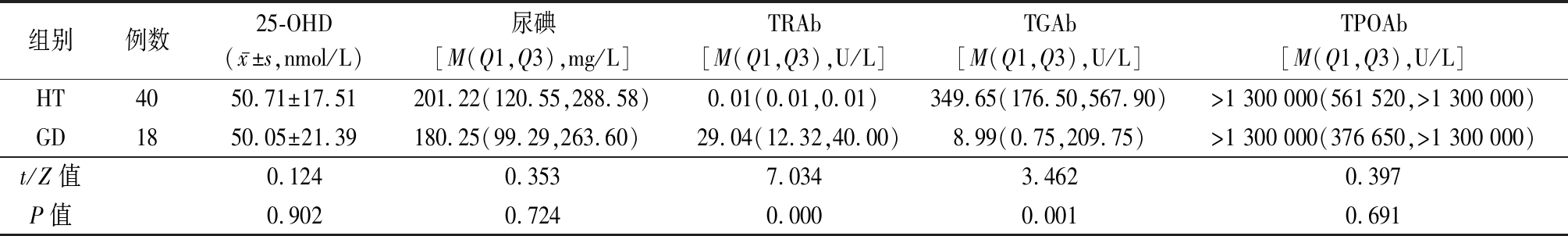
组别例数25-OHD(x-±s,nmol/L)尿碘[M(Q1,Q3),mg/L]TRAb[M(Q1,Q3),U/L]TGAb[M(Q1,Q3),U/L]TPOAb[M(Q1,Q3),U/L]HT4050.71±17.51201.22(120.55,288.58)0.01(0.01,0.01)349.65(176.50,567.90)>1 300 000(561 520,>1 300 000)GD1850.05±21.39180.25(99.29,263.60)29.04(12.32,40.00)8.99(0.75,209.75)>1 300 000(376 650,>1 300 000)t/Z值0.1240.3537.0343.4620.397P值0.9020.7240.0000.0010.691
2.4 相关性分析 HT组25-OHD水平与TSH、TRAb、TGAb、TPOAb、甲状腺体积、尿碘均无相关性(r/rs=-0.093、-0.136、0.047、-0.009、-0.077、-0.164,P>0.05)。GD组25-OHD水平与TPOAb呈弱正相关(r=0.352,P=0.033),与TSH、TRAb、TGAb、甲状腺体积、尿碘均无相关性(r/rs=-0.004、0.087、0.065、0.316、0.268,P>0.05)。
3 讨 论
HT和GD在甲状腺肿、甲状腺功能、超声表现等多方面存在相似表现,尽管TRAb、TPOAb及TGAb分别在两者中相对特异性表达,但亦存在重叠;病理方面,从GD 到HT,淋巴细胞浸润、滤泡萎缩和纤维组织增生、间质血管量减少由轻到重逐渐转化;随病程发展,HT与GD患者甲状腺功能、相对特异性抗体及病理表现亦可相互转化。因此,可以认为HT和GD本质上是一种疾病,病程不同临床表现型不同。两者之间存在某种程度鉴别诊断及治疗困惑。维生素D的经典作用为调节钙磷稳态,维持骨健康,但其在非骨骼系统中的作用受到越来越广泛的关注,包括其在AITD中的作用[6-8]。关于维生素D在AITD中的作用仍存在争议[9]。本研究对HT和GD患儿血清25-OHD及甲状腺相关参数进行对比观察,试图探讨25-OHD是否在两者间内在联系中发挥作用。
人类机体维生素D主要由紫外线照射皮肤产生。因此,户外活动时间、肤色、季节、纬度、紫外线防护措施等均可影响维生素D产生,血清维生素D水平有明显季节性[10] 、年龄性[11]、地域性[12]变化。因此,本研究选择的HT和GD患儿为石家庄地区汉族儿童,且进行了初诊日期统计,2组性别、年龄、初诊日期构成比差异均无统计学意义,可排除上述影响因素干扰。尽管HT组FT3、FT4、TT3、TT4、TSH低于GD组,差异有统计学意义,但血清25-OHD差异无统计学意义,表明25-OHD与甲状腺功能参数无明显相关性,与本课题组前期研究结论相符。
甲状腺过氧化物酶(thyroid peroxidase,TPO)在甲状腺激素合成多个步骤发挥重要催化作用。 TPO与 TPOAb抗原抗体免疫反应引起甲状腺淋巴细胞浸润,导致甲状腺损伤,是AITD的标志性抗体。TGAb也是AITD的标志性抗体,往往伴随TPOAb同时出现。TRAb与TSH受体结合促进甲状腺激素合成和释放,促进GD发生。本研究结果显示,HT组TGAb显著高于GD组,TRAb显著低于GD组,表明TGAb及TRAb分别在HT及GD中相对特异性表达,而25-OHD与TGAb及TRAb无相关性,可能是因为25-OHD并非通过影响TGAb及TRAb表达参与AITD的发生发展;2组TPOAb差异无统计学意义,且均呈高水平表达,表明TPOAb在HT及GD发病中均起着重要作用;GD组中25-OHD与TPOAb存在较弱正相关,与低水平25-OHD促进AITD发展的观点相反[13-14]。尽管本研究排除了季节、纬度、年龄等对25-OHD的影响,但存在样本量小、仅为横断面研究等不足,可能造成与其他研究结果不一致甚至相反。因此,需要大样本量随机对照前瞻性研究进一步明确25-OHD在AITD中的作用。
HT与GD患儿均存在甲状腺肿大。本研究对有甲状腺体积的34例HT和20例GD患儿进行了比较,结果显示2组甲状腺体积和血清25-OHD差异无统计学意义,表明甲状腺肿大程度无法区分HT与GD,且本课题组前期研究及本研究均发现血清25-OHD与HT及GD患儿甲状腺体积无关,故25-OHD对2组患儿甲状腺体积无差异性影响。碘与甲状腺疾病密切相关。尿碘是评估人群碘营养水平的主要指标。有调查发现,GD与HT组TRAb、TPOAb水平高于对照组,且与尿碘水平存在正相关,提示GD和HT患者的高碘状态可能是疾病发生发展的重要因素之一[15]。本研究中,有尿碘结果的40例HT和18例GD患儿尿碘均未见明显升高,且2组尿碘和25-OHD差异无统计学意义,25-OHD和尿碘亦无明显相关性,表明两者不同临床表现可能与维生素D及碘营养状态无关。
综上所述,HT与GD患儿血清25-OHD差异无统计学意义,且与TSH、TGAb和TRAb、甲状腺体积、尿碘水平无明显相关,表明血清25-OHD水平可能不在HT及GD内在联系中发挥作用。
[1] 张颖,黄卫锋.趋化因子CCL5及其受体与自身免疫性疾病的研究进展[J].临床和实验医学杂志,2016,15(21):2175-2177.
[2] 蔡雪蜂,欧阳晓光.甲状腺上动脉血流速度在Graves病和桥本氏甲状腺炎诊断中的应用价值[J].中国实用医药,2018,13(14):27-28.
[3] Inoue N,Watanabe M,Ishido N,et al. The functional polymorphisms of VDR,GC and CYP2R1 are involved in the pathogenesis of autoimmune thyroid diseases[J]. Clin Exp Immunol,2014,178(2):262-269.
[4] Bizzaro G,Shoenfeld Y. Vitamin D and thyroid autoimmune diseases: the known and the obscure[J]. Immunol Res,2015,61(1/2):107-109.
[5] Vondra K. Vitamin D and autoimmune thyroid diseases[J]. Vnitr Lek,2016,62(9 Suppl 3):121-125.
[6] Kim D. The Role of Vitamin D in Thyroid Diseases[J]. Int J Mol Sci,2017,18(9).pii:E1949.
[7] Muscogiuri G,Tirabassi G,Bizzaro G,et al. Vitamin D and thyroid disease: to D or not to D?[J]. Eur J Clin Nutr,2015,69(3):291-296.
[8] Bozkurt NC,Karbek B,Ucan B,et al. The association between severity of vitamin D deficiency and Hashimoto′s thyroiditis[J]. Endocr Pract,2013,19(3):479-484.
[9] D′Aurizio F,Villalta D,Metus P,et al. Is vitamin D a player or not in the pathophysiology of autoimmune thyroid diseases?[J]. Autoimmun Rev,2015,14(5):363-369.
[10] 阎雪,徐佳琛,韩笑,等.石家庄地区儿童血清25羟VD水平的季节和年龄变化[J].营养学报,2017,39(1):37-40.
[11] 刘向辉,阎雪,田旭,等.夏季高海拔地区儿童血清25羟维生素D水平分析[J].中国儿童保健杂志,2016,24(10):1113-1115.
[12] 韩笑,阎雪,张亚男,等.石家庄市夏季汉族4月龄至14岁健康儿童血清25-羟维生素D和甲状旁腺素的关系[J].中国循证儿科杂志,2015,10(3):202-205.
[13] Xu MY,Cao B,Yin J,et al. Vitamin D and Graves′ disease:a meta-analysis update[J]. Nutrients,2015,7(5):3813-3827.
[14] Zhang H,Liang L,Xie Z. Low vitamin D status is associated with increased thyrotropin-receptor antibody titer in Graves disease[J]. Endocr Pract,2015,21(3):258-263.
[15] 王娟娟,贾清珍,张向东,等.尿碘与甲状腺疾病相关性的研究[J].中华地方病学杂志,2013,32(4):359-361.