肺炎支原体是呼吸道感染常见致病原[1-2]。尤其在儿童中,可导致严重支气管及肺部感染[3]。由于肺炎支原体感染缺乏特异的临床表型,增加临床误诊和漏诊率,故实验室诊断尤为重要。肺炎支原体感染的实验诊断方法主要依赖血清学检测[3],但儿童的第二份血清标本难以获得[3],且抗体结果容易受儿童年龄及免疫状态影响[4]。因此,拥有更高灵敏度和特异度的分子生物学方法逐渐受到临床医生的青睐。在本课题组的前期研究中,将多重PCR和毛细管电泳整合,建立了可在一管扩增体系中检测包括肺炎支原体在内的20种社区获得性肺炎常见病原体的GeXP方法[5]。在随后的临床应用中发现,GeXP方法与检测肺炎支原体抗体的血清学方法偶尔会有结果相反的情况出现。为了验证2种方法的一致性,本研究回顾了2015年度社区获得性肺炎住院儿童的GeXP及血清学结果,发现2种方法不一致的病例占总人数的6.29%。使用能够检测肺炎支原体RNA的等温扩增技术(simultaneous amplification and testing,SAT)检测不一致标本后发现,SAT与GeXP的一致率好,但与血清学结果一致率不显著[6-7]。本研究旨在寻找分子生物学方法与血清学方法产生差异的原因。
1 资料与方法
1.1 一般资料 2015年3月—2016年2月连续入选河北省儿童医院疑似呼吸道感染的住院和门诊患儿,年龄0~13岁。本研究共回顾9 339份血清标本,其中有428例患儿虽然提供了第二份血清,但与第一份血清相比,滴度没有变化被排除出组,剩余8 911份标本,男性5 495例,女性3 416例(男女比例为1.6∶1),年龄范围0~13岁,年龄中位数1岁。此外,在4 094份呼吸道分泌物标本中,49例(1.2%)为重复测试无差别标本,排除后剩余4 045份,男性2 603例,女性1 442例(男女比例为1.8∶1)。上述2种方法在同一天完成标本采集的患儿继续入组,共有3 118例。 抗体检测阳性、核酸检测阳性者237例,抗体检测阴性、核酸检测阳性者19例,抗体检测阳性检测阴性者192例,抗体检测阴性、核酸检测阴性者2 670例。
1.2 纳入和排除标准 呼吸道感染诊断标准:参考《诸福棠实用儿科学》第8版[8],入组时需满足:①以鼻塞、发热、咳嗽等症状为主;②肺部听诊可有喘鸣、痰鸣,伴或不伴有湿性啰音;③X射线检查可表现为支气管炎或肺炎征象,如点片状、絮状浸润影、间质性改变、节段性或大叶性肺实质浸润影或肺门淋巴结肿大。排除标准:①合并免疫缺陷性疾病、结核病、反复呼吸道感染、先天性心脏病患儿;②临床资料不详者。
1.3 标本采集 采集患儿的静脉全血并分离出血清2~8 ℃保存,24 h内完成。双份血清中的第一份在就医时采集,至少7 d后采集第二份血清。呼吸道分泌物包括痰液和咽拭子,采集后于4 ℃冰箱保存,24 h内完成。
1.4 仪器与试剂 Serodia-MycoⅡ试剂盒(珠海丽珠试剂股份有限公司)、13种呼吸道病原体复合试剂盒(宁波海尔施基因科技有限公司)、MagX自动化平台(上海仁度生物科技有限公司)、PCR仪(AB7500,美国)、GeXPGenomeLab分析平台(Beckman Coulter,美国)。
1.5 方法
1.5.1 肺炎支原体抗体检测 取2 mL全血分离出的血清,按Serodia-MycoⅡ试剂盒说明书加入血清稀释液和明胶粒子(感作粒子和未感作粒子在试验前30 min用规定量的血清稀释液复溶),混匀后置室温3 h观察结果,每次均设置阴性、阳性对照,抗体稀释度从1∶40到>1∶1 280)。血清学阳性的诊断标准是配对血清4倍及以上滴度升高或单份血清滴度≥1∶160[8]。
1.5.2 肺炎支原体DNA检测 应用13种呼吸道病原体复合试剂盒(PCR毛细管电泳片段分析)(宁波海尔施基因科技有限公司),进行逆转录-聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR),然后通过GeXP自动化平台(Beckman Coulter,美国)进行毛细管电泳以及荧光信号检测过程[5]。荧光数据由GeXP相配套的系统软件分析。
1.5.3 肺炎支原体RNA检测 应用RNA提取试剂盒在MagX自动化平台(上海仁度生物科技有限公司)上提取标本中RNA,随后使用肺炎支原体SAT等温扩增试剂盒在PCR仪(AB7500,美国)上扩增肺炎支原体的16SrRNA。荧光信号通道被设置为FAM(采样通道)和HEX(内部控制通道)。荧光结果使用SAT分析系统进行分析。RT-PCR Ct值≤30被定义为阳性。
1.6 统计学方法 应用SPSS 19.0统计软件处理数据。计数资料比较采用χ2检验;应用四格表诊断性试验方法计算敏感度、特异度、准确度、阳性预测值和阴性预测值。P<0.05为差异有统计学意义。
2 结 果
2.1 2种检测方法的比较 在抗体检测的8 911份标本中,女性阳性检出率显著高于男性,随年龄增长抗体检出阳性率逐渐升高,门诊患者的阳性检出率显著高于住院患儿,秋季和冬季阳性检出率显著高于春季和夏季(P<0.05)。在4 045份核酸检测标本中,核酸阳性检出率随年龄增长逐渐升高,秋季和冬季阳性检出率显著高于春季和夏季(P<0.05),而男女性别之间以及住院和门诊间核酸阳性检出率差异均无统计学意义(P>0.05)。见表1。
表1 肺炎支原体抗体和核酸检测在患儿性别、年龄、就医方式和季节分布比较
Table 1 Comparison of gender, age, medical treatment mode and season distribution in children between mycoplasma pneumoniae antibody and nucleic acid

项别抗体检测例数阳性例数(%)χ2值P值核酸检测例数阳性例数(%)χ2值P值性别 男性 女性5 4953 416851(15.5) 789(23.1) 81.2430.0002 6231 442149(5.7) 104(7.2) 3.7400.053年龄 ①<1岁 ②>1~3岁 ③>3~6岁 ④>6岁4 9411 9651 195 810276(5.6) 397(20.2)∗ 506(42.4)∗# 464(57.3)∗#△1 813.6620.0003 042 582 263 158456(1.5) 43(7.4)∗ 77(29.3)∗#85(53.8)∗#232.5280.000就医方式 住院 门诊8 426 4851 466(17.4) 178(36.7) 113.5340.0004 023 22249(6.2) 2(9.1) 0.0140.950季节 ①春 ②夏 ③秋 ④冬 2 142 2 201 2 031 2 537 270(12.6) 315(14.3) 449(22.1)∗# 609(24.0)∗# 143.8440.000 971 897 6081 569 30(3.1) 42(4.7) 58(9.5)∗# 122(7.8)∗# 37.8860.000
*P值<0.05与①比较 #P值<0.05与②比较 △P值<0.05与③比较(χ2检验)
2.2 肺炎支原体感染患儿抗体滴度分布 8 911例抗体检测肺炎支原体感染的患儿中,抗体滴度为1∶320的位列第一(14.7%,1 310/8 911),随后分别是>1∶1 280(11.0%,980/8 911)、1∶160(9.8%,873/8 911)、1∶80(9.5%,847/8 911)、1∶640(9.3%,829/8 911)、1∶40(6.6%,588/8 911)和1∶1 280(5.8%)。
2.3 核酸检测对不同抗体滴度的评价 以核酸检测为金标准,分别对抗体滴度为1∶160和1∶640的检测结果进行评价,结果显示:在抗体滴度为1∶640时,一致性较1∶160更好;抗体滴度为1∶640时,敏感度较1∶160降低,但特异度、准确度、阳性预测值较抗体1∶160时升高。见表2。
表2 核酸检测对不同抗体滴度的评价
Table 2 Comparison between antibody and nucleic acid detection analysis when the positive serological result is set as different antibody titers
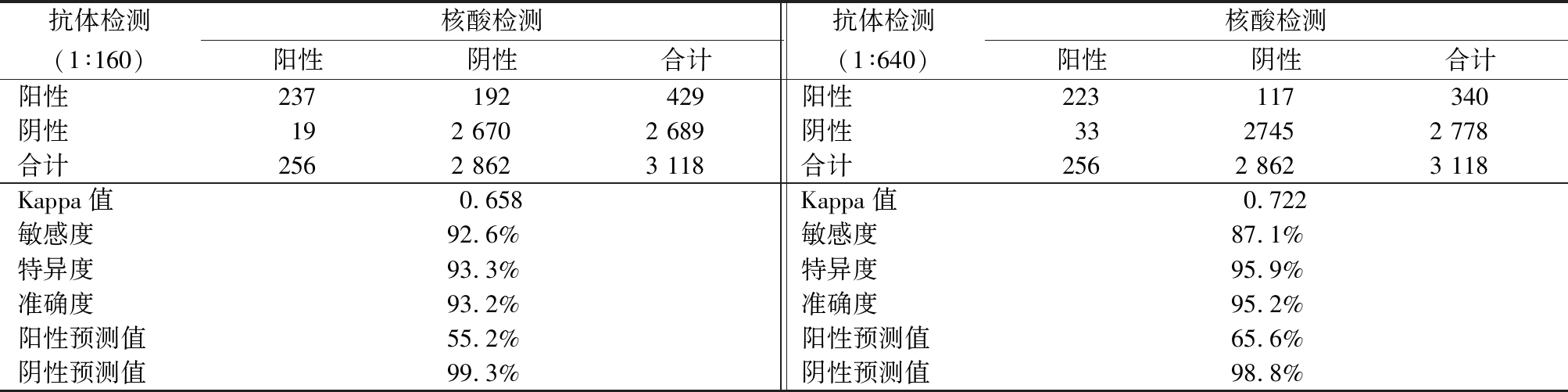
抗体检测(1∶160)核酸检测阳性阴性合计抗体检测(1∶640)核酸检测阳性阴性合计阳性237192429阳性223117340阴性192 6702 689阴性 3327452 778合计2562 8623 118合计2562 8623 118Kappa值0.658Kappa值0.722敏感度92.6%敏感度 87.1%特异度93.3%特异度 95.9%准确度93.2%准确度 95.2%阳性预测值55.2%阳性预测值 65.6%阴性预测值99.3%阴性预测值 98.8%
3 讨 论
本研究对比全年所有疑似感染肺炎支原体并接受血清学和分子生物学检测的2个患者群体结果显示,血清学方法易受门诊/住院因素影响。逐一分析抗体滴度后发现,1∶320滴度在门诊患儿中出现的比例最高。对比同一个患儿2种方法结果不一致的患儿滴度绝大多数出现在>1∶1 280和1∶320两处,并且在1∶320滴度时不一致组显著多于一致组。如果将核酸检测阳性看作判断肺炎支原体感染的“金标准”,那么抗体检测的“假阳性”滴度容易出现在1∶320,而>1∶1 280滴度虽占比多于1∶320,但其主要分布于一致组,即“真阳性率”显著高于“假阳性率”。当使用核酸检测作为参考方法评估抗体检测方法时,特异度、敏感度和阴性预测值均在90%以上,但阳性预测值只有55.2%。究其原因主要有以下三点:①抗体假阳性可能来源于其他病原造成的血清学交叉反应;②本研究所应用的富士公司生产的Serodia-MycoⅡ试剂盒,其目标抗体包括MP-IgM和IgG,抗体阳性可能是由既往感染产生的IgG造成,而非现行感染,这可能是造成本研究中门诊患儿肺炎支原体抗体假阳性率高于住院患儿的原因之一,即门诊患儿虽然抗体呈阳性,但其查体及影像学等证据未达到住院所需严重或急性程度,所以不予收入住院;③MP确实存在于呼吸道内,但其载量低于核酸检测的最低限[9]。有报道称,与血清学相比,PCR的诊断准确性可能在疾病发作7 d以后逐渐降低,尤其是那些接受抗生素治疗超过1周的患者,此情况更为常见[10]。
肺炎支原体分离培养是确定肺炎支原体感染的金标准,但由于在临床标本中病原体含量少,方法操作繁琐、需要时间长等缺点,分离培养并不用于常规检测[11-12]。故补体结合试验、间接免疫荧光试验、颗粒凝集试验等替代方法层出不穷,相应的对比研究也较常见[5,13-15]。但对比单份血清滴度与PCR方法学研究仅见1篇报道,Kim等[16]使用定量PCR方法检测儿童鼻炎吸取物内肺炎支原体DNA,使用与本研究一致的被动颗粒凝集法检测单份血清内的肺炎支原体抗体,并在各滴度内逐一对比2种方法一致性,结果显示当以单份血清滴度≥1∶320判定为阳性时,PCR的累积阳性率为26.7%,若以单份血清滴度≥1∶640判定为阳性,PCR累积阳性率为78.2%。本研究与其结果一致,即当临界滴度设置在1∶640时,抗体与核酸检测的一致性最好。在本研究中,仅有约7%患儿提供了第二份血清,其中另有一半患儿提供的血清滴度升高不足4倍。所以,当配对血清标本无法采集时,有必要结合血清学和分子生物学方法共同判定肺炎支原体感染,可降低使用单一方法可能出现的假阳性和假阴性。
除了方法学对比之外,不同的抗体滴度还与临床症状有关。孙海霞等[17]分析了100例肺炎支原体肺炎患儿的临床特点后发现,随着肺炎支原体抗体滴度的上升,患儿发热、咳嗽、头痛程度逐渐加重,CRP逐渐升高。与刘引等[18]报道相似。表明抗体滴度与疾病严重程度相关。张国华等[19]观察了305例肺炎支原体感染患儿的临床表现、血清转氨酶、血总胆红素、B超和X线表现以及血、尿淀粉酶等,肺炎支原体感染合并消化系统损害较单纯肺炎支原体感染的肺炎支原体抗体滴度高。柴玲彦等[20]以滴度1∶160为界,将100例肺炎支原体肺炎患儿分为2组,发现滴度≥1∶160的患儿在心肌酶谱异常例数和数值、心电图异常例数均显著多于或大于滴度<1∶160的患儿。
综上所述,抗体滴度高低与肺炎严重程度及肺外并发症的发生有关,观察滴度差异有其临床意义。对比血清滴度与分子生物学方法结果确有差异,且门诊患儿或当血清滴度为1∶320时应注意结合2种方法共同判定肺炎支原体感染。
[1] Posten S,Reed J. Pediatric community acquired pneumonia[J]. S D Med,2017,70(12):557-561.
[2] Kutty PK,Jain S,Taylor TH,et al. Mycoplasma pneumoniae among children hospitalized with community-acquired pneumonia[J]. Clin Infect Dis,2018[Epub ahead of print].
[3] 李冬梅.肺炎支原体实验室诊断研究进展[J].医学理论与实践,2015,28(17):2305-2307.
[4] Dumke R,Jacobs E. Antibody response to Mycoplasma pneumoniae:protection of host and influence on outbreaks?[J]. Front Microbiol,2016,7:39.
[5] Wang L,Zhao M,Shi Z,et al. A GeXP-based assay for simultaneous detection of multiple viruses in hospitalized children with community acquired pneumonia[J]. PLoS One,2016,9(11):e0162411.
[6] Wang L,Feng Z,Zhao M,et al. A comparison study between GeXP-based multiplex-PCR and serology assay for Mycoplasma pneumoniae detection in children with community acquired pneumonia[J]. BMC infect Dis,2017,1(17):518.
[7] 张文超,赵梦川,冯志山,等.被动颗粒凝集法检测MP抗体效价和胶体金法联合检测MP-IgM、MP-IgG抗体在儿童支原体肺炎中的应用价值[J].河北医科大学学报,2018,9(39):1058-1061,1066.
[8] 江载芳,申昆玲,沈颖.诸福棠实用儿科学[M].8版.北京:人民卫生出版社,2015:1247-1251.
[9] de Groot RCA,Meyer Sauteur PM,Unger WWJ,et al. Things that could be Mycoplasma pneumoniae[J]. J Infect,2017,74(Suppl 1):S95-100.
[10] Chang HY,Chang LY,Shao PL,et al. Comparison of real-time polymerase chain reaction and serological tests for the confirmation of Mycoplasma pneumoniae infection in children with clinical diagnosis of atypical pneumonia[J]. J Microbiol Immunol Infect,2014,47(2):137-144.
[11] Song M,Zhang Y,Li S,et al. A sensitive and rapid immunoassay for Mycoplasma pneumoniae in children with pneumonia based on single-walled carbon nanotubes[J]. Sci Rep,2017,7(1):16442.
[12] Carrim M,Wolter N,Benitez AJ,et al. Epidemiology and molecular identification and characterization of Mycoplasma pneumoniae,South Africa,2012-2015[J]. Emerg Infect Dis,2018,24(3):506-513.
[13] 龚亚东,马庆庆,林牧.儿童肺炎支原体感染3种检测方法对比分析[J].现代医药卫生,2017,33(2):251-253.
[14] Ullberg M,Lüthje P,Mölling P,et al. Broad-range detection of microorganisms directly from bronchoalveolar lavage specimens by pcr/electrospray ionization-mass spectrometry[J]. PLoS One,2017,12(1):e0170033.
[15] Zhao MC,Li GX,Zhang D,et al. Clinical evaluation of a new single-tube multiplex reverse transcription PCR assay for simultaneous detection of 11 respiratory viruses,Mycoplasma pneumoniae and Chlamydia in hospitalized children with acute respiratory infections[J]. Diagn Microbiol Infect Dis,2017,88(2):115-119.
[16] Kim NH,Lee JA,Eun BW,et al. Comparison of polymerase chain reaction and the indirect particle agglutination antibody test for the diagnosis of Mycoplasma pneumoniae pneumonia in children during two outbreaks[J]. Pediatr Infect Dis J,2007,26(10):897-903.
[17] 孙海霞,魏秀红,郭俊平,等.儿童肺炎支原体抗体滴度与肺炎支原体肺炎的关系[J/CD].临床医药文献电子杂志,2016,23(3):4555-4558.
[18] 刘引,王子才,方洁,等.肺炎支原体IgM测定的临床意义[J].临床儿科杂志,2005,8(23):560-561.
[19] 张国华,罗素云,王琴,等.0~5岁肺炎支原体感染合并消化系统损害的支原体抗体滴度分布研究[J].中国医学创新,2010,7(36):28-30.
[20] 柴玲彦,赵红,刘连凤,等.支原体肺炎患儿心肌损害与支原体抗体滴度的相关性分析[J].现代中西医结合杂志,2015,24(20):2200-2202.