术后认知功能障碍(postoperative cognitive dysfunction,POCD)是一种常见的麻醉手术后的中枢神经系统并发症[1]。该病多发生于接受大手术或急诊手术的老年患者,表现为手术后精神错乱、焦虑、人格改变及记忆受损等[2-4]。目前POCD发病的确切机制尚不十分明确,多认为是麻醉手术等外界因素诱发了疾病过程,多因素相互影响、协同的作用参与了其发病机制[5]。在麻醉引起POCD的可能机制中,中枢胆碱能系统、Tau蛋白、β淀粉样沉淀以及炎症反应等作用均在其中发挥着重要作用[6-7]。尤其炎症作用是近年研究的热点,在POCD发生过程中,有大量促炎细胞因子的释放,如肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleuken,IL)-1β、IL-6等[8-10]。乌司他丁是一种蛋白酶抑制剂,主要通过清除氧自由基、抑制炎症反应、免疫调节等发挥器官保护作用[11]。目前研究发现,乌司他丁可通过抑制核因子κB(nuclear factor-kappa B,NF-κB)的活性抑制炎症介质的过度释放[12]。本研究旨在分析乌司他丁对手术创伤大鼠POCD的影响,探讨其对POCD作用的相关机制。
1 材料与方法
1.1 材料 注射用乌司他丁(广东天普生化医药股份有限公司);戊巴比妥钠(美国sigma);0.9%氯化钠注射液(山东华鲁制药有限公司);MDA试剂盒(南京建成生物有限公司);SOD试剂盒(南京建成生物有限公司);TNF-α、NF-κB、IL-1β酶联免疫吸附测定试剂盒(RD,进口分装);Morris水迷宫(上海欣软信息科技有限公司)。
1.2 实验动物来源及分组 清洁级Wistar大鼠,雌性,200~230 g,购自内蒙古大学实验动物中心[实验动物生产许可证(SCXK(蒙)2015-0001)],按啮齿动物培养方法和条件培养。随机分为对照组、POCD组、乌司他丁组,每组20只,适应性饲养1周。
1.3 实验模型制备及处理 手术前,将所有实验大鼠置于水温保持在24 ℃的水迷宫中,适应2 min。连续5 d进行空间获得性训练。第6天进行相应的分组处理。对照组大鼠腹腔注射生理盐水2 mL,之后每日沿尾静脉注射生理盐水(10 mL/kg)。POCD组腹腔注射2%戊巴比妥钠(50 mL/kg)麻醉,无菌环境中,于左肋缘下1 cm作横行切口,长约2 cm,逐层分离,结扎血管,切除脾脏。逐层关腹,术后保暖,术后每日沿尾静脉注射生理盐水(10 mL/kg)。乌司他丁组先行尾静脉注射乌司他丁(5 000 U/mL,10 mL/kg),之后在全身麻醉下行脾切除术,术后每日沿尾静脉注射乌司他丁(5 000 U/mL,10 mL/kg)。
1.4 Morris水迷宫测试
1.4.1 空间获得性实验 术前所有大鼠均行空间获得性实验。水箱第一象限水下置有隐匿逃逸平台,先将大鼠置于平台上20 s,之后依次从水箱的其他3个象限将大鼠放入水中,观察其登上隐匿平台的时间即逃逸潜伏时间。若在60 s内登上逃逸平台,则允许其停留在平台上10 s,并记录实际时间为逃逸潜伏期。若60 s未登上隐匿平台者,人工引导或拎至平台上,并允许其停留10 s,逃逸潜伏期记录为60 s。每天训练3次,每次间隔30 min,连续训练5 d。
1.4.2 参考记忆测试 于术后3,7 d,进行参考记忆测试。撤除第一象限的逃逸平台。于第三象限将大鼠置于水中,观察60 s内大鼠在第一象限的停留时间和穿台次数,以此作为空间记忆检测的统计学指标。
1.4.3 工作记忆测试 完成上述测验后,将平台置于除第一象限之外的任意一象限内,分别从另外某一固定象限将大鼠放于水中。若60 s内大鼠可以登上平台,则允许其在平台上待10 s,若不能找到并登上平台,则引导其登上平台并放置10 s。间隔15 s后,将该大鼠由同一位置放入水中,观察其潜伏期。评估其短时工作记忆。
1.5 标本采集、处理 术后3,7 d,每组选取10只大鼠,断头处死,迅速取出脑组织,用4 ℃生理盐水洗去血污,滤纸吸干。冰上进行后续操作:将分离得到的大鼠海马及前额皮层组织置于预冷的小烧杯中,加入6倍体积4 ℃生理盐水,用眼科剪迅速剪碎成小组织块。之后将剪碎的组织倒入预冷的玻璃匀浆管中,再用3倍体积4 ℃生理盐水反复冲洗烧杯,冲洗液一并移入匀浆管中,上下反复研磨数十次。充分研碎,使组织匀浆化。4 ℃,3 000 r/min,15 min,吸取上清置于洁净EP管中,-80 ℃贮存备用。
1.6 观察指标 比较3组大鼠行为学变化:停留时间、穿台次数和工作记忆潜伏时间。比较3组大鼠海马及前额皮层组织中丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)含量和TNF-α、Il-1β及NF-κB水平。 MDA、SOD含量测定按照试剂盒说明步骤进行,以MDA(nmol/mg)、SOD(U/mg)表示。按试剂盒说明书流程,采用酶联免疫吸附测定法测定TNF-α、Il-1β、NF-κB水平。
1.7 统计学方法 应用SPSS 17.0统计软件分析数据。计量资料比较分别采用F检验、SNK-q检验和配对t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 3组大鼠行为学变化比较 术后3 d,POCD组大鼠停留时间短于对照组,穿台次数少于对照组,工作记忆潜伏时间长于对照组(P<0.05);乌司他丁组大鼠停留时间短于对照组,长于POCD组,穿台次数多于POCD组,工作记忆潜伏时间长于对照组,短于POCD组(P<0.05)。术后7 d,对照组和乌司他丁组大鼠停留时间短于术后3 d,工作记忆潜伏时间长于术后3 d(P<0.05);POCD组大鼠停留时间短于对照组,工作记忆潜伏时间长于对照组(P<0.05);乌司他丁组大鼠停留时间短于对照组,长于POCD组,工作记忆潜伏时间长于对照组,短于POCD组(P<0.05)。见表1。
表1 3组大鼠术后行为学变化比较
Table 1 Comparison of postoperative behavioral changes in three groups of rats![]()
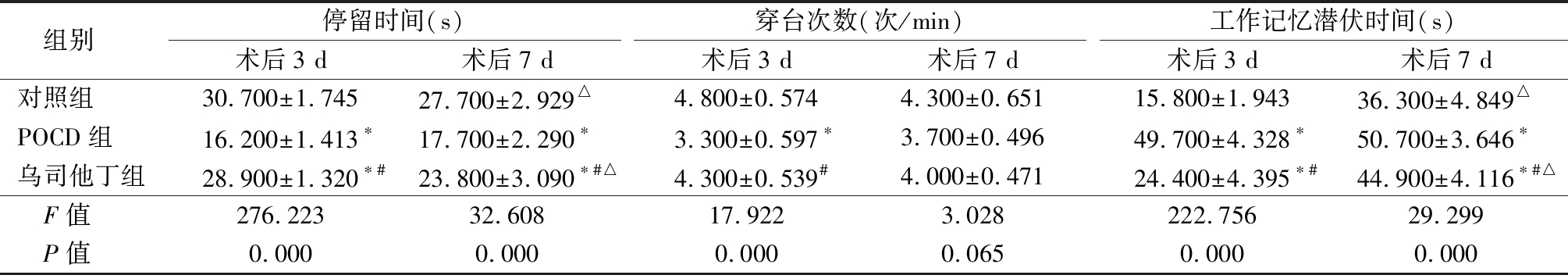
组别停留时间(s)术后3 d术后7 d穿台次数(次/min)术后3 d术后7 d工作记忆潜伏时间(s)术后3 d术后7 d对照组30.700±1.74527.700±2.929△4.800±0.5744.300±0.65115.800±1.94336.300±4.849△POCD组16.200±1.413∗17.700±2.290∗3.300±0.597∗3.700±0.49649.700±4.328∗50.700±3.646∗乌司他丁组28.900±1.320∗#23.800±3.090∗#△4.300±0.539#4.000±0.47124.400±4.395∗#44.900±4.116∗#△ F值276.22332.60817.9223.028222.75629.299 P值0.0000.0000.000 0.065 0.0000.000
*P值<0.05与对照组比较 #P值<0.05与POCD组比较(SNK-q检验) △P值<0.05与术后3 d比较(配对t检验)
2.2 3组大鼠海马及前额皮层组织中MDA、SOD含量比较 术后3 d,POCD组大鼠MDA含量高于对照组,SOD含量低于对照组,乌司他丁组大鼠MDA含量高于对照组,低于POCD组,SOD含量低于对照组,高于POCD组(P<0.05)。术后7 d,对照组和乌司他丁组MDA含量高于术后3 d,POCD组MDA含量低于术后3 d,对照组SOD含量低于术后3 d,POCD组和乌司他丁组MDA含量高于术后3 d(P<0.05);POCD组大鼠MDA含量高于对照组,SOD含量低于对照组,乌司他丁组大鼠MDA含量高于对照组,低于POCD组,SOD含量低于对照组,高于POCD组(P<0.05)。见表2。
表2 3组大鼠海马及前额皮层组织中MDA、SOD含量比较
Table 2 Comparison of MDA and SOD contents in hippocampus and prefrontal cortex in three groups of rats![]()
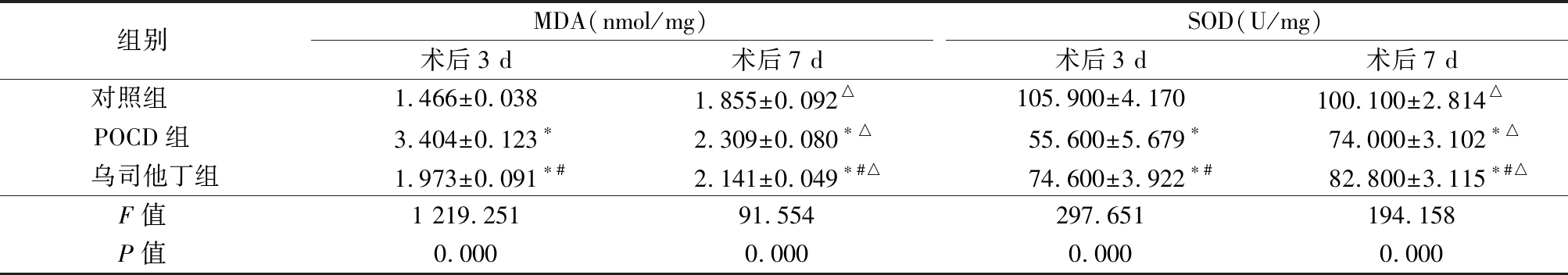
组别 MDA(nmol/mg)术后3 d术后7 dSOD(U/mg)术后3 d术后7 d对照组 1.466±0.0381.855±0.092△105.900±4.170100.100±2.814△POCD组 3.404±0.123∗2.309±0.080∗△55.600±5.679∗74.000±3.102∗△乌司他丁组1.973±0.091∗#2.141±0.049∗#△74.600±3.922∗#82.800±3.115∗#△F值 1 219.25191.554297.651194.158P值 0.0000.0000.0000.000
*P值<0.05与对照组比较 #P值<0.05与POCD组比较(SNK-q检验) △P值<0.05与术后3 d比较(配对t检验)
2.3 3组大鼠海马及前额皮层组织中细胞因子水平比较 术后3 d,POCD组大鼠TNF-α、IL-1β和NF-κB水平均高于对照组,乌司他丁组TNF-α、IL-1β和NF-κB水平均高于对照组,低于POCD组(P<0.05)。术后7 d,POCD组和乌司他丁组TNF-α水平低于术后3 d,3组IL-1β和NF-κB水平低于术后3 d(P<0.05);POCD组大鼠TNF-α、IL-1β和NF-κB水平均高于对照组,乌司他丁组IL-1β水平低于POCD组(P<0.05)。见表3。
表3 3组大鼠海马及前额皮层组织中细胞因子水平比较
Table 3 Comparison of cytokines levels in hippocampus and prefrontal cortex in three groups of rats![]()
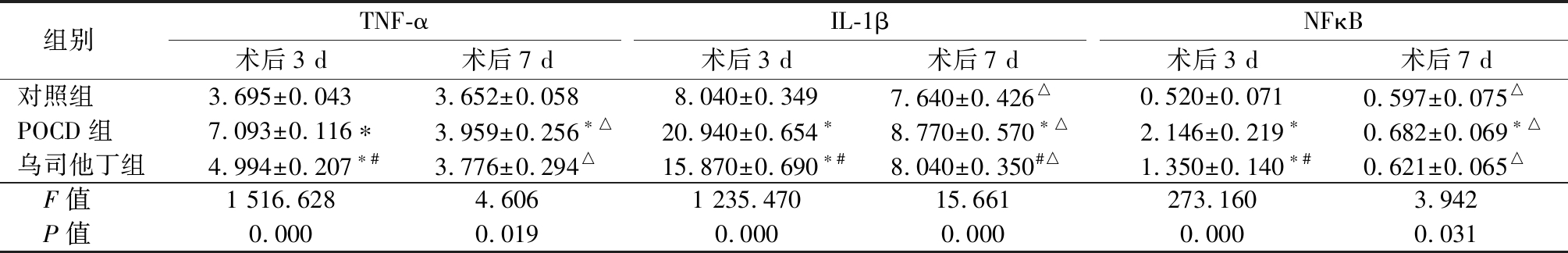
组别TNF-α术后3 d术后7 dIL-1β术后3 d术后7 dNFκB术后3 d术后7 d对照组3.695±0.0433.652±0.0588.040±0.3497.640±0.426△0.520±0.0710.597±0.075△POCD组7.093±0.116∗3.959±0.256∗△20.940±0.654∗8.770±0.570∗△2.146±0.219∗0.682±0.069∗△乌司他丁组4.994±0.207∗#3.776±0.294△15.870±0.690∗#8.040±0.350#△1.350±0.140∗#0.621±0.065△ F值1 516.6284.6061 235.47015.661273.1603.942 P值0.0000.0190.0000.0000.0000.031
*P值<0.05与对照组比较 #P值<0.05与POCD组比较(SNK-q检验) △P值<0.05与术后3 d比较(配对t检验)
3 讨 论
本研究在全身麻醉状态下对大鼠实施全脾切除术制备POCD模型。通过Morris水迷宫测试对其参考记忆、工作记忆进行评估。参考记忆主要是测量海马依赖性学习记忆[13]。结果显示,术后3 d POCD组出现了固定记忆损害,而乌司他丁组这一损害得到了有效缓解。工作记忆测试主要是用于评估非海马依赖性的记忆功能,即用于进行认知弹性的评估。本研究POCD组大鼠表现为学习能力和短期记忆明显降低,乌司他丁可有效阻止这一过程的发生,而术后7 d这种保护作用的表现并不十分突出,虽然有一定的改善认知障碍、恢复认知功能的趋势,但未恢复到对照组水平。
在POCD病理过程之中,伴随着氧自由基的大量产生,势必影响脑组织中MDA和SOD的含量[14]。MDA是体内脂质被过氧化物降解之后的产物,其浓度的变化反映了组织遭受氧自由基伤害的程度。SOD可以有效清除体内氧自由基,保护细胞膜结构、线粒体和溶酶体的功能,防止细胞发生自融。本研究结果显示,术后3 d POCD组大鼠MDA含量高于对照组,SOD含量低于对照组,乌司他丁组大鼠MDA含量低于POCD组,SOD含量高于POCD组。说明乌司他丁可以有效拮抗上述过程,并通过清除氧自由基的抗氧化机制实现对于认知功能的保护。
在手术等强烈刺激之下,机体会产生大量炎症因子,TNF-α、IL-1β等可以通过特异性的机制穿过血脑屏障,进入颅内。大量炎症介质在颅内堆积,可对脑组织造成明显的损伤,表现为认知功能损害。尤其在大脑海马区高度表达多种炎症因子受体,故而其对于炎症因子的过度增加表现的更为敏感。本研究结果显示,术后3 d POCD组中TNF-α、IL-1β、NF-κB水平明显升加。IL-1β可以通过多种病理机制激发炎症反应,造成血-脑屏障破坏[15]。脑外伤后短时间内出现NF-κB活化,IL-1β、TNF-α相应表达[16],它们共同参与了颅脑损伤后的炎性反应过程。本研究结果显示,乌司他丁组大鼠海马及前额皮层组织中TNF-α、IL-1β、NF-κB水平明显低于POCD组。说明乌司他丁可通过调控机体炎症水平实现改善术后认知功能的作用。
综上所述,全身麻醉下脾切除术可以成功诱导大鼠POCD模型,其能够较好地实现临床POCD患者所表现出的认知水平降低、超氧离子损伤、炎症因子产生浸润等病理现象。超氧离子和炎症因子均是导致POCD的重要因素,其共同作用于中枢神经系统,相互影响,共同促进,加重了认知功能损害。而乌司他丁通过清除氧自由基、抑制炎症反应、免疫调节等发挥器官保护作用,对防止POCD的发生和进展具有积极的意义。
[1] 王以新,苏艾中,刘再英.术后认知功能障碍研究进展[J/CD].中华临床医师杂志:电子版,2016,10(12):1795-1799.
[2] 高华敏,李金洪.老年患者术后认知功能障碍的危险因素分析[J].海南医学,2016,27(2):207-209.
[3] 修双玲,孙丽娜,穆志静,等.老年2型糖尿病患者认知障碍的危险因素分析[J].山西医科大学学报,2016,47(8):747-750.
[4] 李会晓.老年患者缺血性卒中后认知障碍相关危险因素分析[J].中国老年保健医学,2015,13(2):99-100.
[5] 王珑,张惠曼,王宏,等.麻醉前给予不同药物对小鼠术后认知功能的影响[J].中国临床研究,2017,30(2):251-253.
[6] 马辉,徐伟乐,王英.硬膜外麻醉联合静脉全身麻醉对老年开胸手术患者术后认知的影响[J].河北医科大学学报,2015,36(10):1173-1176.
[7] 孙龙,段宏伟.全身麻醉药与术后认知功能障碍关系的研究进展[J].中国临床医学,2016,23(3):392-395.
[8] 张阳,张从利,李晓红.术后认知功能障碍与神经炎症介质的相关性研究进展[J].海南医学,2016,27(13):2168-2170.
[9] Zhang X,Yao H,Qian Q,et al. Cerebral Mast Cells Participate In Postoperative Cognitive Dysfunction by Promoting Astrocyte Activation[J]. Cell Physiol Biochem,2016,40(1/2):104-116.
[10] Steinberg BE,Sundman E,Terrando N,et al. Neural control of inflammation: implications for perioperative and critical care[J]. Anesthesiology,2016,124(5):1174-1189.
[11] 林峰,周志军,张晨虹,等.用乌司他丁抑制炎症反应减轻大鼠移植肝再灌注损伤的实验研究[J].药学实践杂志,2014,32(2):110-113,127.
[12] Feng C,Li B,Wang LL,et al. Effect of peritoneal lavage withulinastatinon the expression of NF-κB and TNF-α in multiple organs of rats with severe acute pancreatitis[J]. Exp Ther Med,2015,10(6):2029-2034.
[13] 方松.Morris水迷宫实验中海马相关空间学习记忆的研究进展[J].国际病理科学与临床研究杂志,2008,30(4):321-326.
[14] Zhao WX,Zhang JH,Cao JB,et al. Acetaminophen attenuates lipopolysaccharide-induced cognitive impairment through antioxidant activity[J]. J Neuroinflammation,2017,14(1):17.
[15] 魏平波,游潮,陈浩,等.脑出血大鼠模型中血清IL-1β的表达与脑水肿关系及意义探讨[J].中风与神经疾病杂志,2014,31(4):307-309.
[16] Abdullah Z,Rakkar K,Bath PM,et al. Inhibition of TNF-α protects in vitro brain barrier from ischaemic damage[J]. Mol Cell Neurosci,2015,69:65-79.