肺癌目前已经成为全球范围内发病率和病死率最高的恶性肿瘤,2015年美国约有158 000人死亡,而在我国每年新发肺癌患者已达73.33万,居所有恶性肿瘤之首[1]。肺癌病理类型中约有80%病例是非小细胞肺癌,其中肺腺癌已成为最常见的组织学类型,约占非小细胞肺癌的50%。肺腺癌通常发生在肺外周Ⅱ型肺细胞或支气管肺泡干细胞的腺上皮中,5年生存率约为16%[2],大部分肺腺癌患者就诊时已处于临床中晚期,既往治疗基于含铂双药化疗为主,效果欠佳。虽然近年来基于分子生物学的靶向治疗取得突破性进展,对具有敏感驱动性基因EGFR[3-4]、ALK[5-6]等突变基因的肺腺癌患者采用靶向治疗已经取代传统化疗成为一线治疗,但目前有半数肺腺癌患者仍没有确切的治疗靶点。在真核生物中Polo-like激酶1(Polo-like kinase 1,PLK1)是一种高度保守的丝氨酸-苏氨酸激酶,它在有丝分裂的启动、中心体成熟、双极纺锤体形成以及染色体浓缩和分离过程中起着非常重要的作用。同时有专家发现在骨肉瘤[7]、结肠癌[8-9]、肺鳞癌[10]多种恶性肿瘤中高表达,下调PLK1表达能通过减少细胞增殖、促进凋亡等多种机制进行抗肿瘤,效果十分明显[11]。并且有研究表明PLK1与肿瘤的侵袭性和患者预后密切有关[12]。目前全球关于肺腺癌PLK1表达和细胞周期关系的研究较多,但与细胞侵袭转移的相关性研究少见。本研究采用反义RNA技术抑制PLK1基因的表达,分析其表达与肺腺癌细胞周期和侵袭转移的关系,并对其机制进行初步探讨。
1 材料与方法
1.1 材料 肺腺癌细胞株H1792购自美国ATCC细胞库,胎牛血清购自美国Gemini公司,SilencerTM Select PLK1和control siRNA购自美国Life Technologies公司,TaqManGAPDH引物和探针和TaqMan PLK1购自杭州禾船生物科技有限公司, LipofectamineTM RNAiMAX 转染试剂盒上海浩然生物技术有限公司,iScriptTMcDNA合成试剂盒购自美国Bio-Rad公司, TaqMan基因表达预混液购自美国Applied Biosystems公司,Tris/甘氨酸缓冲液、Tris/甘氨酸/蛋白电泳缓冲液购自上海沪震实业有限公司,总RNA提取试剂盒购自武汉艾美捷科技有限公司, E-cadherin、Vimentin、PLK1和GAPDH单克隆抗体均购自北京奥维亚生物技术有限公司,West Femto最高灵敏度化学发光底物试剂盒购自美国Thermo Scientific公司,Pierce-BCA 蛋白分析试剂盒购自杭州主诺生物技术有限公司,PVDF 膜购自迈博瑞生物膜技术有限公司,Transwell膜嵌套购自上海百赛生物技术股份有限公司,结晶紫购自美国Sigma公司,甲醇购自山东诺尔化工有限公司,Transwell 细胞培养小室购自美国BD公司。
1.2 实验主要仪器设备 Synergy-HT多功能酶标仪购自美国伯腾仪器有限公司,ABI Prism 7900HT型荧光定量聚合酶链反应(polymerase chain reaction,PCR)仪购自北京义翘神州科技有限公司,低温高速离心机购自美国Beckman Coulter公司,NanoDrop 8000全光谱紫外-可见光分光光度计购自美国赛默飞世尔公司。
1.3 实验方法
1.3.1 细胞培养和转染 将肺腺癌细胞H1792细胞在37 ℃、5%CO2的恒温恒湿培养箱中培养,待细胞融合达80%时进行传代培养。将生长状态良好的肺腺癌H1792细胞按一定细胞数接种于6孔板上,待融合生长达70%~80%时设control siRNA 组(空白对照组)和PLK1 siRNA(实验组),更换无血清培养基。参照LipofectamineTM RNAiMAX转染试剂说明书将Lipofectamine 2000、siRNA、Opti-MEM溶液均匀混合,室温放置20 min,加入到含有 H1792细胞的6孔板内,每组设3个副孔。调整PLK1 siRNA组和control siRNA组的终浓度均为 100 nmol/L,转染6 h,更换培养基培养48 h。
1.3.2 实时荧光定量PCR法检测各组PLK1基因的表达 用PBS洗涤转染好的肺腺癌H1792细胞并根据试剂盒说明书提取每组总RNA,将经RNeasy技术纯化的RNA 在NanoDrop 8000全光谱紫外-可见光分光光度计仪器中检测RNA浓度。参照iScriptTMcDNA合成试剂盒说明书进行反转录生成cDNA,然后用无R-Nase水稀释cDNA作为模板,将相应预混液、探针、cDNA放到ABI荧光定量PCR仪专用384孔板上,瞬时离心后进行PCR扩增,95 ℃预变性5 min,95 ℃变性5 s,60 ℃退火10 s,72 ℃延伸10 s,40个循环。用2-△Ct法进行数据分析。
1.3.3 Western blot法检测各组相关指标蛋白的表达 用PBS洗涤转染好的肺腺癌H1792细胞,用胰蛋白酶消化细胞5~8 min,加入培养基,制成单细胞悬液,上机离心去上清液,加入蛋白裂解液,上机取上清液,提取样本的细胞总蛋白,用BCA 法(即用BCA试剂盒检测,制备牛血清白蛋白标准曲线,再检测每组样本的吸光度值,对照标准曲线根据吸光度值得到对应样本的蛋白浓度)测定蛋白的浓度。在转印槽中加上Tris/甘氨酸/蛋白电泳液,制胶:在Mini-PROTEAN TGX 预制胶中每组样本加12 μL 蛋白,电泳达到参考线,再用双蒸水短暂冲洗凝胶,再用水和转膜缓冲液冲洗摇动15 min;转膜:在Tris/甘氨酸缓冲液中将其转至PVDF膜(冰浴),注意赶出气泡,转膜条件电压 100 V,时间 40 min。室温TBST液封膜1 h,加入各对应指标相应浓度的一抗,4 ℃摇床振荡过夜。第2天TBST洗膜3次,每次10 min,加入二抗室温振荡1 h,TBST洗膜,将ECL发光液A液和B液1∶1混合后滴于PVDF膜上于X室曝光显影,以GAPDH作为内参照,用 Image软件测量灰度值。
1.3.4 流式细胞术检测转染前后PLK1基因后对细胞周期的变化 将转染好的肺腺癌H1792细胞用PBS洗涤,用胰酶消化细胞,PBS清洗,上机离心弃上清,重复2次,重悬细胞于PBS中,缓慢加入冰乙醇放到振荡器上搅拌固定过夜。次日离心弃上清用冷PBS洗去乙醇,重悬细胞并加入RNaseA消化1 h再加入碘化丙啶避光染色。上机进行分析。
1.3.5 Transwell侵袭实验 Matrigel胶液化与4 ℃预冷的无血清培养基稀释,然后将Matrigel胶平铺于聚碳酸酯膜,将转染好的肺腺癌H1792细胞以1×105个细胞的RPMI 200 μL加入Transwell小室上室,下室加含500 μL的RPMI 1640培养液,然后放到恒湿恒温箱内24 h,然后甲醇室温固定30 min并干燥后用结晶紫对其进行染色10 min,清水漂洗晾干,随机选取4个高倍视野数出穿膜细胞数。
1.4 统计学方法 应用SPSS 17.0统计软件分析数据。计量资料比较采用两独立样本的t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 RNAi特异性降低H1792细胞 PLK1 mRNA的表达 实时荧光定量PCR方法检测PLK1 siRNA组PLK1 mRNA表达水平为0.39±0.03,显著低于control siRNA组的1.00±0.02,差异有统计学意义(t=28.619,P=0.000)。
2.2 RNA特异性降低H1792细胞蛋白表达 Western blot法检测显示,PLK1 siRNA组PLK1蛋白和 Vimentin蛋白表达显著低于control siRNA组,E-cadherin蛋白表达显著高于control siRNA组,差异均有统计学意义(P<0.05),见表1。
表1蛋白质印迹方法检测H1792细胞中PLK1、E-cadherin和Vimentin蛋白表达
Table 1 The PLK1、E-cadherin and Vimentin protein expression in H1792 cells by Western blot assay![]()
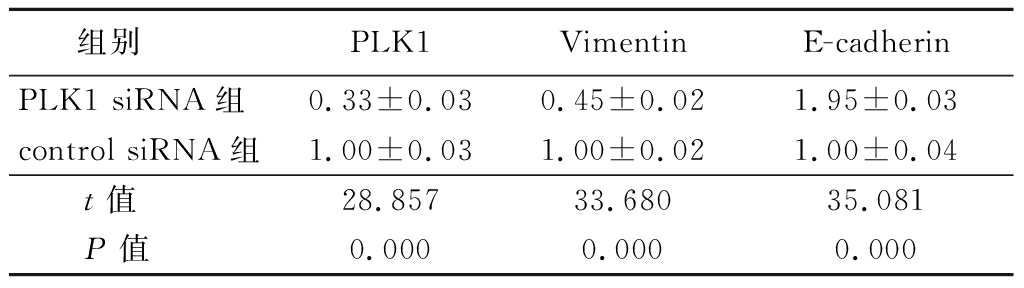
组别 PLK1VimentinE-cadherinPLK1 siRNA组0.33±0.030.45±0.021.95±0.03control siRNA组1.00±0.031.00±0.021.00±0.04 t值28.85733.68035.081 P值0.0000.0000.000
2.3 RNAi对H1792细胞细胞周期的影响 流式细胞术检测显示,PLK1 siRNA组G2/M期细胞比例显著高于control siRNA组,S期细胞比例显著低于control siRNA组,差异均有统计学意义(P<0.05);而2组G0/G1期细胞比例差异无统计学意义(P>0.05)。见表2。
表2 流式细胞术检测肺腺癌H1792细胞周期的变化
Table 2 Flow cytometry for detection of cell cycle of H1792 in lung adenocarcinoma![]()
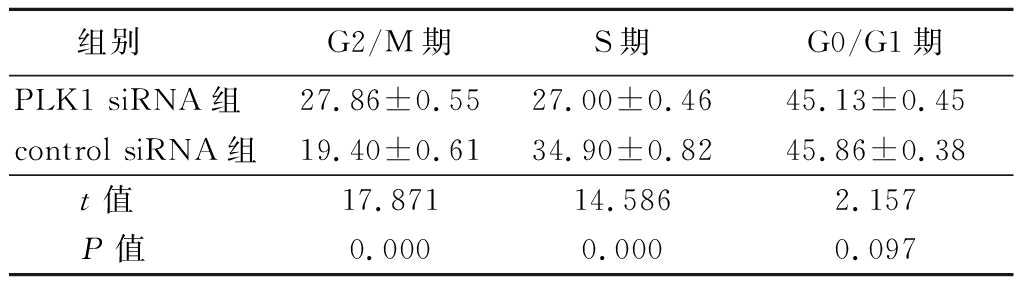
组别 G2/M期S期G0/G1期PLK1 siRNA组27.86±0.5527.00±0.4645.13±0.45control siRNA组19.40±0.6134.90±0.8245.86±0.38 t值17.87114.5862.157 P值0.0000.0000.097
2.4 RNAi对 H1792细胞侵袭能力的影响 Transwell侵袭实验显示,PLK1 siRNA组穿膜细胞数(18.00±2.08)个,明显少于control siRNA组的(57.00±3.05)个,差异有统计学意义(t=18.272,P=0.000)。
3 讨 论
细胞有丝分裂是一个精致而又复杂的过程,受许多关键调节因子的控制。PLKs属于高度保守的丝氨酸/苏氨酸激酶家族,其中PLK1作为重要的一个调节因子在细胞周期的表达、活性、亚细胞定位等方面呈现周期依赖性,几乎贯穿于整个有丝分裂过程。PLK1对于精确调节细胞分裂、维持有丝分裂、纺锤体组装和DNA中基因组稳定性至关重要,在各种癌症中PLK1可以通过细胞周期依赖性激酶1活化,调节双极纺锤体形成、染色体排列、染色体分离和胞质分裂等。PLK1蛋白的表达及其活性在G0期、G1期和S期较低,在G2期开始增高,在M期达到高峰[13-14]。先前的研究表明过度表达的PLK1与较差的存活率相关[15]。Wang等[16]采用PLK1 siRNA于体内外处理肝癌细胞后,发现抑制PLK1基因表达可以显著阻滞细胞于G2/M期,肿瘤细胞凋亡显著增加,并且引起了细胞p53、Bax和p21等细胞周期相关蛋白显著性增强,Bcl-2水平下调。本研究通过应用siRNA特异性沉默H1792细胞PLK1基因表达,结果显示H1792细胞中存在PLK1高表达,RNA干扰可显著减少肿瘤细胞PLK1 mRNA和蛋白表达;通过应用流式细胞术对转染PLK1 siRNA的肺腺癌H1792细胞与control siRNA组H1792细胞进行了细胞周期分析,结果显示PLK1 siRNA转染组较control siRNA组相比G2/M期细胞比例明显增多,提示发生G2/M期阻滞,表明PLK1在肺腺癌细胞生长增殖发挥重要调控作用。Ma等[17]在结肠癌中通过荧光素酶测定发现miR-593与PLK1结合的特定位点。通过蛋白质印迹法发现转染miR-593模拟物的结肠癌细胞中PLK1的表达显着降低,肿瘤的增殖能力明显降低,发现miR-593通过下调PLK1抑制结肠癌细胞的增殖,并在结肠癌中起到明显的抑制作用。
绝大多数肿瘤患者的死因是侵袭转移。上皮间质转化(epithelialt-mesenchymal transition,EMT)是指在某些特定的生理条件及病理状态下上皮细胞失去上皮表型而向间质细胞转变,从而导致使上皮细胞转变为迁移、侵袭、抗凋亡能力更强的间质细胞,在此转化过程中以上皮黏附分子表达缺失或下调[18-19]以及Vimentin、N-cadherin(间质表型蛋白)表达上调为特征[20]。EMT可以赋予细胞的迁徙和侵袭特性并且增加耐受凋亡的能力。肿瘤细胞发生EMT受多种复杂的信号通路、转录因子及相关基因调控,可通过靶向EMT进程减少肿瘤侵袭转移。目前关于PLK1表达和肿瘤细胞EMT之间相关性的研究极少,Wu等[21]研究发现PLK1可以通过CRAF/ERK信号传导通路诱导前列腺癌细胞发生EMT以及促进细胞迁移能力。Cai等[22]同样在胃癌中研究发现PLK1通过调节AKT途径加速胃癌细胞的转移和上皮-间质转化过程。本研究表明,特异性抑制PLK1表达使肺腺癌E-cadherin蛋白表达上调,同时Vimentin蛋白表达下调;Transwell侵袭实验显示,相比于对照组PLK1 siRNA组穿膜细胞数显著减少,肿瘤细胞的侵袭能力明显下降。分析其原因:可能是PLK1通过影响E-cadherin和Vimentin转录因子影响了细胞的EMT过程,干扰了肿瘤细胞的上皮间质转化过程。
综上所述,本研究发现PLK1与肺腺癌细胞的细胞周期调控和EMT进程密切相关,PLK1可以促进肿瘤细胞生长和侵袭转移,这为肺腺癌的精准医疗提供了一个新靶点和实验依据,至于PLK1 如何调控EMT的详细作用机制还有待进一步研究。
[1] Chen W,Zheng R,Baade PD,et al. Cancer statistics in China,2015[J]. CA Cancer J Clin,2016,66(2):115-132.
[2] Sun ZQ,Chen G,Guo Q,et al. In vivo and in vitro effects of hyperplasia suppressor gene on the proliferation and apoptosis of lung adenocarcinoma A549 cells[J]. Biosci Rep,2018,38(5).pii:BSR20180391.
[3] Deng H,Liu J,Duan X,et al. The relationship between EGFR mutation status and clinic-pathologic features in pulmonary adenocarcinoma[J]. Pathol Res Pract,2018,214(3):450-454.
[4] Yamaoka T,Ohba M,Ohmori T. Molecular-targeted therapies for epidermal growth factor receptor and its resistance mechanisms[J]. Int J Mol Sci,2017,18(11).pii:E2420.
[5] Sgambato A,Casaluce F,Maione P,et al. Targeted therapies in non-small cell lung cancer:a focus on ALK/ROS1 tyrosine kinase inhibitors[J]. Expert Rev Anticancer Ther,2018,18(1):71-80.
[6] Tian HX,Zhang XC,Yang JJ,et al. Clinical characteristics and sequence complexity of anaplastic lymphoma kinase gene fusions in Chinese lung cancer patients[J]. Lung Cancer,2017,114:90-95.
[7] Chou YS,Yen CC,Chen WM,et al. Cytotoxic mechanism of PLK1 inhibitor GSK461364 against osteosarcoma:Mitotic arrest,apoptosis,cellular senescence,and synergistic effect with paclitaxel[J]. Int J Oncol,2016,48(3):1187-1194.
[8] Dasgupta N,Thakur BK,Ta A,et al. Polo-like kinase 1 expression is suppressed by CCAAT/enhancer-binding protein alpha to mediate colon carcinoma cell differentiation and apoptosis[J]. Biochim Biophys Acta Gen Subj,2017,1861(7):1777-1787.
[9] Fern ndez-Ace
ndez-Ace ero MJ,Cortés D,Gómez del Pulgar T,et al. PLK-1 expression is associated with histopathological response to neoadjuvant therapy of hepatic metastasis of colorectal carcinoma[J]. Pathol Oncol Res,2016,22(2):377-383.
ero MJ,Cortés D,Gómez del Pulgar T,et al. PLK-1 expression is associated with histopathological response to neoadjuvant therapy of hepatic metastasis of colorectal carcinoma[J]. Pathol Oncol Res,2016,22(2):377-383.
[10] Li H,Wang H,Sun Z,et al. The clinical and prognostic value of polo-like kinase 1 in lung squamous cell carcinoma patients:immunohistochemical analysis[J]. Biosci Rep,2017[Epub ahead of print].
[11] Ergul M,Bakar-Ates F. RO3280,A novel PLK1 inhibitor,suppressed proliferation of MCF-7 breast cancer cells through induction of cell cycle arrest at G2/M point[J]. Anticancer Agents Med Chem,2019[Epub ahead of print].
[12] Yan W,Yu H,Li W,et al. Plk1 promotes the migration of human lung adenocarcinoma epithelial cells via STAT3 signaling[J]. Oncol Lett,2018,16(5):6801-6807.
[13] Liu Z,Sun Q,Wang X. PLK1,a potential target for cancer therapy[J]. Transl Oncol,2017,10(1):22-32.
[14] Gheghiani L,Loew D,Lombard B,et al. PLK1 Activation in late G2 sets up commitment to mitosis[J]. Cell Rep,2017,19(10):2060-2073.
[15] Dang SC,Fan YY,Cui L,et al. PLK1 as a potential prognostic marker of gastric cancer through MEK-ERK pathway on PDTX models[J]. Onco Targets Ther,2018,11:6239-6247.
[16] Wang D,Chang R,Wang G,et al. Polo-like kinase 1-targeting chitosan nanoparticles suppress the progression of hepatocellular carcinoma[J]. Anticancer Agents Med Chem,2017,17(7):948-954.
[17] Ma J,Zhu Y,Wang Z,et al.miR-593 inhibits proliferation of colon cancer cells in vitro by down-regulating PLK1[J]. Nan Fang Yi Ke Da Xue Xue Bao,2019,39(2):144-149.
[18] Liao S,Yu C,Liu H,et al. Long non-coding RNA H19 promotes the proliferation and invasion of lung cancer cells and regulates the expression of E-cadherin,N-cadherin,and vimentin[J]. Onco Targets Ther,2019,12:4099-4107.
[19] 张余飞,康静波.非小细胞肺癌上皮间质转化与靶向药物耐药关系的研究进展[J].癌症进展,2016,16(3):220-222.
[20] Bhandari A,Zheng C,Sindan N,et al. COPB2 is up-regulated in breast cancer and plays a vital role in the metastasis via N-cadherin and Vimentin[J]. J Cell Mol Med,2019,23(8):5235-5245.
[21] Wu J,Ivanov AI,Fisher PB,et al. Polo-like kinase 1 induces epithelial-to-mesenchymal transition and promotes epithelial cell motility by activating CRAF/ERK signaling[J]. Elife,2016,5.pii:e10734.
[22] Cai XP,Chen LD,Song HB,et al. PLK1 promotes epithelial-mesenchymal transition and metastasis of gastric carcinoma cells[J]. Am J Transl Res,2016,8(10):4172-4183.