远处转移过程中的关键步骤之一是上皮-间充质转化(epithelial-mesenchymal transition,EMT),其导致癌症转移,且与结肠癌患者的差预后紧密相关[1-4]。研究表明,Ascl2可抑制抑癌因子miR-200家族的转录,从而促进肿瘤的EMT,更进一步导致肿瘤的转移[5]。另有研究显示结直肠癌Ascl2高表达对癌症EMT、转移和侵袭的调节作用可能受到Hippo通路的影响[6]。Ascl2为促EMT发展的基因,目前关于其在结直肠癌异常高表达的机制报道甚少。因此,本研究进行了相关数据分析和实验,旨在为结直肠癌转移的机制研究提供新的依据。
1 资料与方法
1.1 一般资料 通过http://www.cbioportal.org/网站下载TCGA数据库中276例结肠癌患者的基因表达值和临床信息,男性134例(48.5%),女性142例(51.5%),年龄26~92岁,中位年龄67岁;T分期:T1 55例(19.92%),T2 66例(23.91%),T3 155例(56.16%);M分期:M0 181例(65.58%),M1a 46例(16.67%),M1b 49例(17.75%);YAP1表达:高表达(YAP1+)163例(59.06%),低表达(YAP1-)113例(40.94%);TAZ表达:高表达(TAZ+)98例(35.51%),低表达(TAZ-)178例(64.49%);Ascl2表达:高表达(Ascl2+)133例(48.18%),低表达(Ascl2-)143例(51.82%)。其中有55例患者含有正常结直肠组织样本,采用X-tile界定YAP1、TAZ和Ascl2在结肠癌组织中的表达临界值,分析三者在正常结直肠组织和癌组织的表达差异,不同的M分期和T分期的表达模式及生存预后,其中T分期表示肿瘤浸润程度,M分期表示肿瘤远处转移程度。
1.2 实验方法
1.2.1 试剂 兔抗大鼠MST1、MST2、YAP1、TAZ,磷酸化YAP1、TAZ,Ascl2,E-cadherin,N-cadherin和GAPDH抗体购自proteintech公司;Transwell小室购自康宁公司;基质胶、RIPA蛋白裂解液购自上海碧云天公司;ECL显色液购自Thermo公司;RNA提取试剂盒和逆转录cDNA试剂盒购自promega公司;双荧光素酶报告系统检测试剂够自Promega公司。
1.2.2 细胞培养 人类结肠癌细胞SW480购自美国ATCC公司;细胞培养采用含有10%胎牛血清的RPMI 1640 培养基(购自Hyclone公司)。转染前,使细胞均匀接种至6孔板中,至生长密度达到70%~80%进行细胞转染。
1.2.3 pcDNA3.1和MST1、MST2重组质粒的构建与转染 扩增人类 MST1和 MST2的 CDS区域,带酶切位点的引物序列Kpn I-MST1-F:GGTACCATGGGGCTGTGGTGGGTC;Nhe I-MST1-R:GCTAGCAAGGTCATGAGACTGGG-TTAG;Mlu I-MST2-F:GGTACCATGTTACAA-CTCATGGACAGTG;Nhe I-MST2-R:GCTAG-CGAAGGCAGCAAAACTTTTGA。扩增成功的CDS序列与pcDNA3.1表达载体相连,分别命名为pcDNA3.1-MST1和pcDNA3.1-MST2,转化大肠杆菌DH5α后,提取质粒后转染入SW480细胞中,转染空载体pcDNA3.1用于对照,每孔转染剂量为2 μg,过表达和对照细胞株分别命名为MST1/2+和NC。
1.2.4 实时荧光定量PCR(quantitative real-time PCR,QPCR)检测 用promega公司的RNA小提试剂盒提取过表达MST1/2及对照结直肠癌细胞的总RNA。将提取的总RNA逆转录成cDNA后,荧光定量PCR检测MST1、MST2、YAP1、TAZ、Ascl2、E-cadherin、N-cadherin表达水平。各检测基因的QPCR引物见表1。
QPCR结果采用2-△△Ct法计算相对表达量。
表1 QPCR检测引物
Table 1 QPCR primers

基因引物名称引物序列MST1正向引物5'-AGCATGTAGACTGCTGGGGCAA-3'反向引物5'-CCTGCAGTAGGTTTCTGCTGCCTTG-3'MST2正向引物5'-CACAGACTCCCTGCTTTTGCT-3'反向引物5'-TGCCTCAGAAGAGCTGAAAACTT-3'YAP1正向引物5'-ATGCATTTAAGATATGGTTGCC-3'反向引物5'-TGGAGTTGGGAAACACTTGA-3'TAZ正向引物5'-AGCATGTAGACTGCTGGGGCAA-3'反向引物5'-CCTGCAGTAGGTTTCTGCTGCCTTG-3'Ascl2正向引物5'-CATGTTTTCTGACGGCAACTT-3'反向引物5'-CCAGATCACGCCATTTCAC-3'E-cadherin正向引物5'-TTGCGCCATGCTGAAACTGTACG-3'反向引物5'-AAAGTGGCGTCCAGGGAGAAGG-3'N-cadherin正向引物5'-AGCGACACAAGAAGCTTCTG-3'反向引物5'-CTGAAGCAGCTCCGCCAAAC-3'GAPDH正向引物5'-CGGACAGGATTGACAGATTGATAGC-3'反向引物5'-TGCCAGAGTCTCGTTCGTTATCG-3'
1.2.5 免疫印迹(Western blot)检测 各组细胞在转染后的72 h内于冰上加入RIPA蛋白裂解液并研磨至液态,至4℃离心机以12 000 r/min离心10 min,吸取上清加入4倍体积的SDS 上样缓冲液,混匀后放入100 ℃水浴5 min。取30 μg的蛋白裂解液加入8% 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)中分别以60 V和100 V电压进行蛋白浓缩和分离,然后转至PVDF膜,以10%脱脂奶粉室温封闭2 h后,加入抗体,4 ℃过夜孵育后,ECL发光液显色。
1.2.6 细胞迁移和侵袭实验 通过Transwell测定过表达MST1/2导致SW480迁移和侵袭能力的变化。将含有1%FBS的200 μL RPMI 1640培养基中的细胞(1×105)接种到具有8 μm孔径过滤器的上部小室中,并且下部室充满600 μL含有20% FBS作为化学引诱物,将基质胶加入上部小室用于细胞侵袭测定。细胞培育48 h后,将Transwell小室取出,加入4%多聚甲醛固定,随后用0.1%结晶紫染色并进行显微镜拍照,镜下随机选取3个视野的染色细胞取均值,以评估迁移或侵袭的细胞个数。
1.2.7 荧光素酶报告载体的构建及转染 采用MEME在线预测Ascl2启动子上游2 000 bp的启动子序列,发现存在2个TEAD反应元件,分别位于-1 500/-1 492 bp和-485/-478 bp。从人基因组中钓取Ascl2启动子片段,并构建入pGL3-basic载体中。带酶切位点的引物为Kpn I-Ascl2-F:GGTACCTTTAGCTGAAACCGTTGA;Nhe I-Ascl2-R:GCTAGCGTAGCGTTGTGATGGATC,构建成功后提取质粒;命名为pGL3-Ascl2。将pGL3-basic与pRL-TK共转染MST1/2+SW480及对照细胞设为阴性对照组,pGL3-Ascl2与pRL-TK共转染MST1/2+SW480及对照细胞设为实验组,每孔转染剂量为2 μg。转染24 h后,裂解细胞并采用promega荧光素酶分析仪检测萤火虫荧光素酶和海肾荧光素酶的活性,两者比值为荧光素酶的相对活性。
1.3 统计学方法 应用GraphPad Prism 6.05统计软件分析数据。计量资料比较分别采用两独立样本的t检验、F检验和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 YAP1和TAZ以及Ascl2在结直肠癌肿瘤中的表达情况 YAP1、TAZ和Ascl2在55例结直肠肿瘤组织中的表达均明显高于其对应的正常组织(P<0.05);在276例结直肠癌组织中,M1期的YAP1、TAZ和Ascl2的表达远高于M0期(P<0.05),且M1b期的表达明显高于M1a期,表明远处转移的癌组织中三者均呈现高表达趋势,且随着转移程度的增加而增强;YAP1、TAZ和Ascl2在T1期结肠癌组织中的表达明显低于T2和T3期,且T3期的表达明显高于T1和T2(P<0.05),表明YAP1、TAZ和Ascl2的表达随着肿瘤侵润程度的增加而增强。见图1。
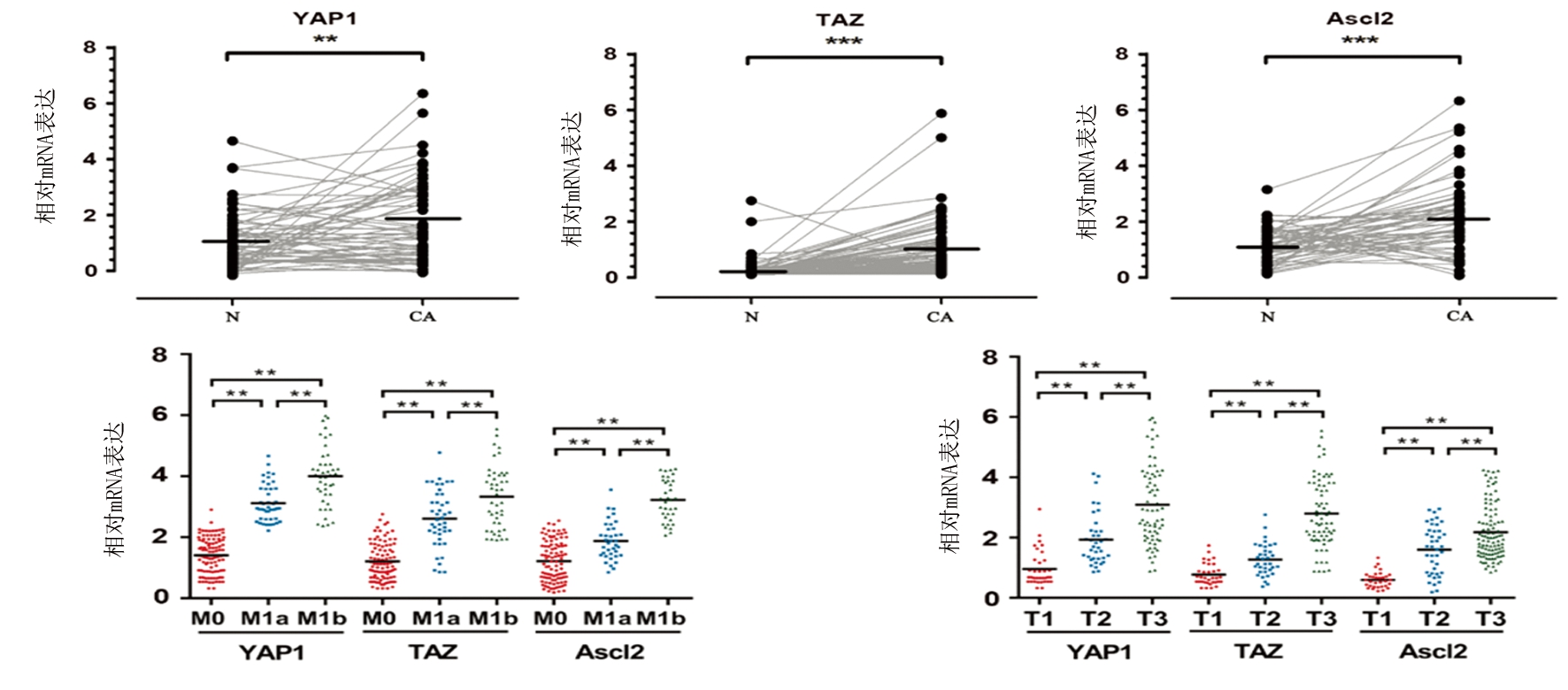
图1 YAP1和TAZ以及Ascl2在结直肠癌肿瘤中的表达
Figure1 Expression of YAP1, TAZ and Ascl2 in colorectal cancer
2.2 YAP1、TAZ和Ascl2的表达对患者总生存率和无病生存率的影响 应用X-tile软件界定YAP1、TAZ和Ascl2的高低表达临界值,并绘制生存曲线。276例患者的5年总生存率分别是:YAP1+ vs YAP1-为46.9% vs 36.5%;TAZ+ vs TAZ-为53.4% vs 41.2%;Ascl2+ vs Ascl2-为46.6% vs 27.0%。276例患者的5年无病生存率分别是:YAP1+ vs YAP1-为70.6% vs 34.1%;TAZ+ vs TAZ-为64.6% vs 42.9%;Ascl2+ vs Ascl2-为70.2% vs 39.6%。相比较YAP1、TAZ和Ascl2低表达的结直肠癌患者,高表达的YAP1、TAZ和Ascl2结直肠癌患者的总生存率和无病生存率明显降低,表明YAP1、TAZ和Ascl2的表达影响结直肠癌患者的生存预后。见图2。
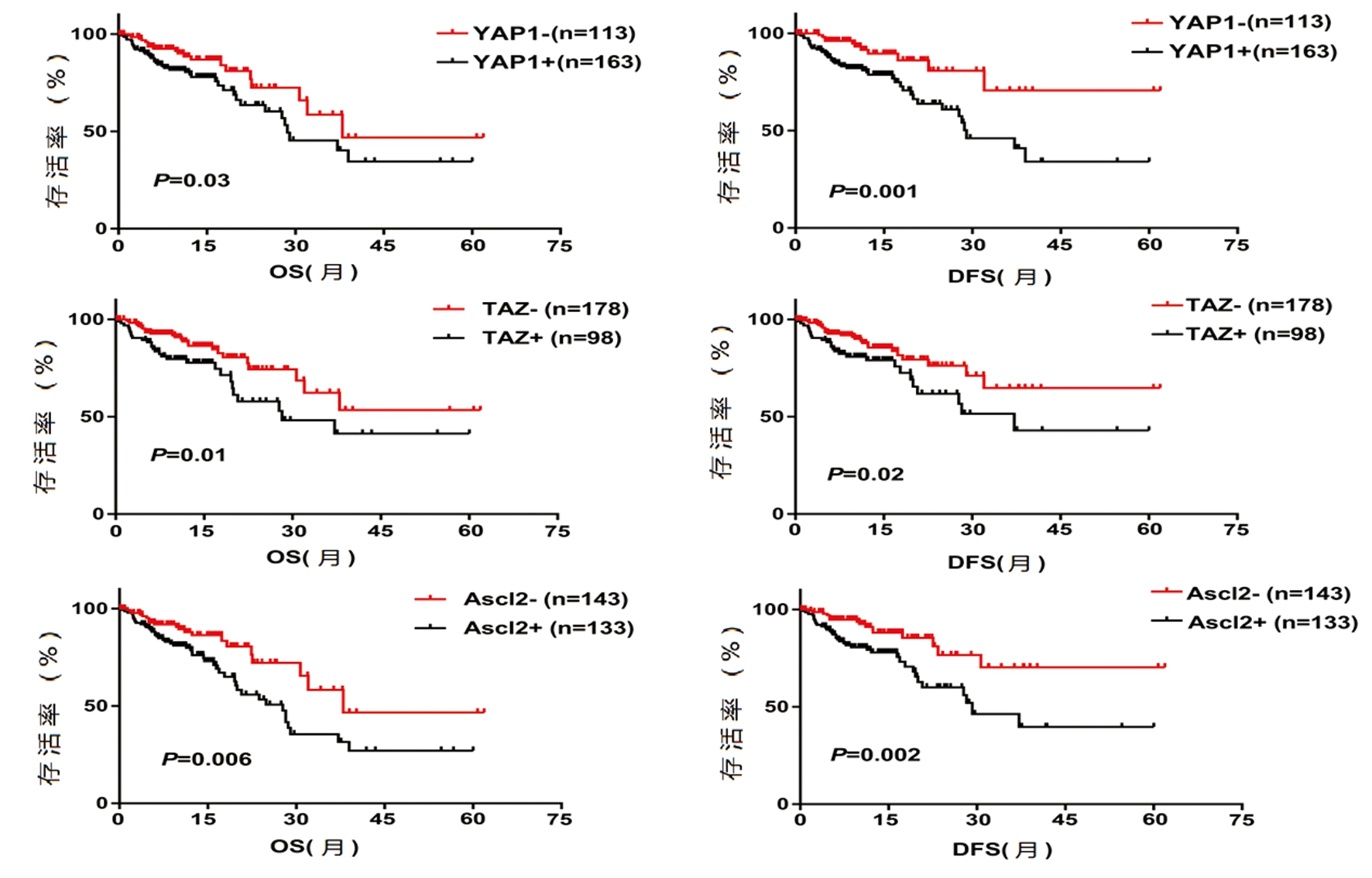
图2 YAP1、TAZ和Ascl2的表达对患者总生存率和无病生存率的影响
Figure 2 Effects of YAP1,TAZ and Ascl2 expression on overall survival and disease-free survival of patients
2.3 MST1/2过表达激活Hippo通路并抑制Ascl2的转录、表达和EMT的发展 已知YAP1和TAZ是Hippo信号通路的靶基因,Hippo通路通过MST1/2激活YAP1/TAZ的磷酸化,从而阻止YAP1/TAZ与TEAD的结合,进而阻碍TEAD下游基因的转录调控。为了证明Hippo通路对结直肠癌Ascl2和EMT进展发挥的作用,采用过表达MST1/2载体转染SW480细胞,检测Hippo通路相关基因的表达。过表达MST1/2导致磷酸化的YAP/TAZ蛋白水平增加,YAP/TAZ mRNA和未磷酸化的总蛋白表达降低;上皮标志物E-cadherin的mRNA水平和蛋白水平表达增加,而Ascl2与间充质标志物N-cadherin的mRNA水平和蛋白水平表达减少,证明Hippo通路的激活导致Ascl2的表达和EMT进程受到抑制。进一步,通过荧光素酶报告系统证实,过表达MST1/2的SW480细胞Ascl2启动子的转录活性明显低于对照细胞,表明YAP/TAZ磷酸化导致其与TEAD结合减少,从而减弱TEAD对Ascl2的转录激活能力。见图3,表2,3。
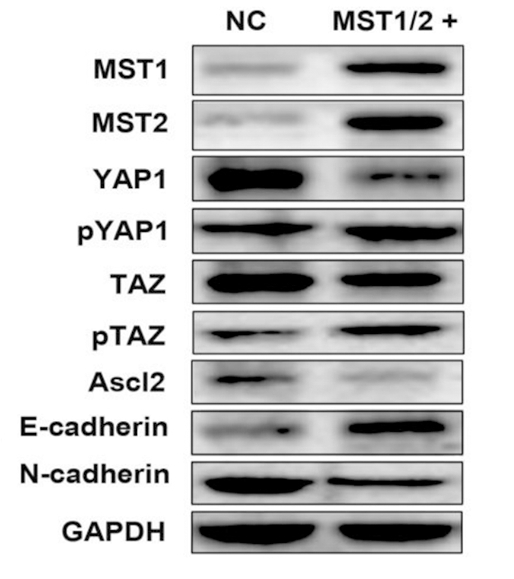
图3 Hippo通路相关蛋白的表达
Figure 3 Expression of Hippo pathway related proteins
表2 Hippo通路相关mRNA相对表达
Table 2 Relative expression of mRNA related to Hippo pathway![]()
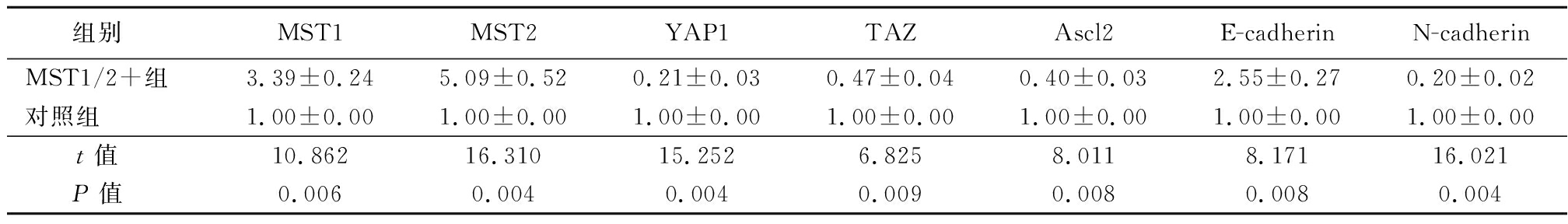
组别 MST1MST2YAP1TAZAscl2E-cadherinN-cadherinMST1/2+组3.39±0.245.09±0.520.21±0.030.47±0.040.40±0.032.55±0.270.20±0.02对照组1.00±0.001.00±0.001.00±0.001.00±0.001.00±0.001.00±0.001.00±0.00t值 10.86216.31015.2526.8258.0118.17116.021P值 0.0060.0040.0040.0090.0080.0080.004
表3 相对荧光素酶活性
Table 3 Relative luciferase activity![]()

组别 pGL3-Ascl2MST1/2+组1.87±0.09对照组5.77±0.55t值 9.888P值 0.006
2.4 MST1/2过表达减弱结肠癌细胞的迁移和侵袭能力 过表达MST1/2导致SW480细胞的迁移和侵袭能力明显受到抑制(P<0.05),表明Hippo通路激活抑制Ascl2表达和EMT进展的同时,也阻碍了结肠癌细胞的迁移和侵袭,见图4,表4。
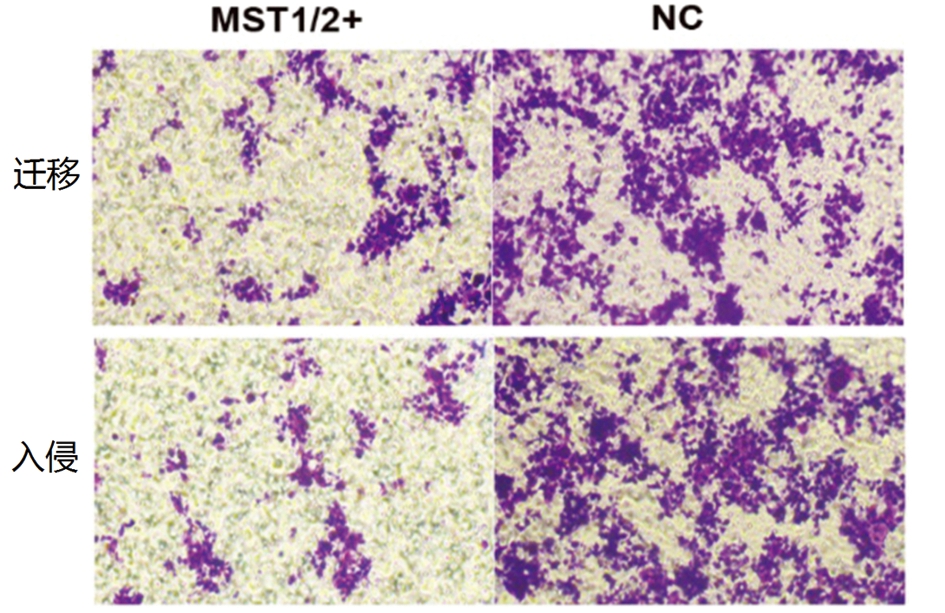
图4 MST1/2过表达对结肠癌细胞的迁移和侵袭能力的影响
Figure 4 Effect of MST1/2 overexpression on migration and invasion of colon cancer cells
表4 MST1/2过表达对结肠癌细胞的迁移和侵袭能力的影响
Table 4 Effect of MST1/2 overexpression on migration and invasion of colon cancer cells ![]() 个)
个)
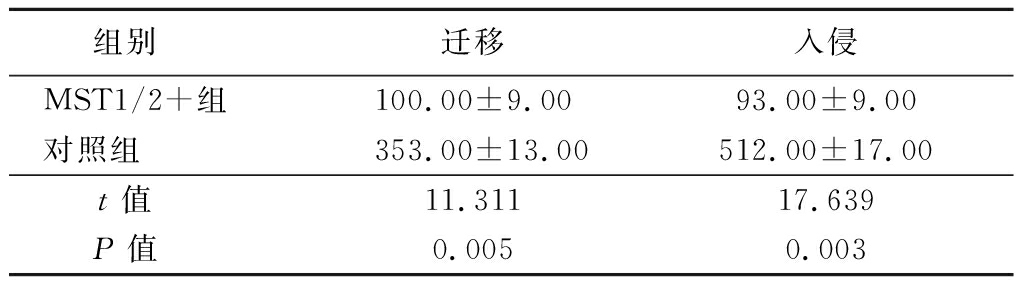
组别 迁移入侵MST1/2+组100.00±9.0093.00±9.00对照组353.00±13.00512.00±17.00t值 11.31117.639P值 0.0050.003
3 讨 论
在癌症发生发展过程中,癌症转移的初始阶段需要肿瘤上皮细胞通过EMT过程转变成间充质表型。在恶性肿瘤中,EMT重排细胞骨架促进细胞运动,启动间充质转录程序,并破坏细胞极性和粘连以从邻近组织释放细胞,从而使原发性肿瘤细胞获得转移的前提条件,即迁移和侵袭的能力。Hippo通路主要由MST1/2-LATS1/2-YAP1/TAZ-TEAD信号组成,其控制肿瘤EMT主要通过非磷酸化的YAP1/TAZ转位至细胞核内与TEAD结合,并与β-catenin/TCF或Smads[7]一起诱导调节细胞形态,迁移和癌症转移的基因。上游激酶(Mst/Lats)导致YAP1/TAZ磷酸化,迫使它们在细胞质滞留并被GSK3-β相关的蛋白酶体降解[8],从而抑制相关转录因子的反式激活[9]。研究表明,YAP1过表达在永生化乳腺上皮细胞导致间充质形态学改变并启动促EMT基因的表达,在相同的细胞系中TAZ过表达也被报道产生相似的EMT表型[10-11]。YAP/TAZ促EMT发展的相关机制研究发现,YAP和TAZ可以通过上调FOXC2、Snail家族锌指蛋白(SNAIL、SLUG)、Twist相关蛋白1和ZEB1/2等关键EMT编排蛋白促进EMT进程[12-13]。本研究结果显示,在276例结直肠癌患者的肿瘤组织中,YAP1和TAZ的表达水平随着肿瘤的远处转移和浸润程度的增加而升高,且高表达的YAP1和TAZ的结直肠癌患者具有更低的5年总生存率和无病生存率,表明YAP1/TAZ影响结直肠肿瘤转移能力及患者的生存预后。过表达Hippo上游激酶MST1和MST2导致LATS1和LAST2蛋白磷酸化增强,促进YAP1和TAZ磷酸化,导致YAP1/TAZ失活。进一步抑制间充质细胞标记因子N-cadherin的表达和增强上皮细胞标志因子E-cadherin的表达。细胞行为学检测发现MST1/2过表达的SW480的结肠癌细胞相比正常SW480具有更低迁移和侵袭能力,表明Hippo通路的激活能够抑制结肠癌细胞EMT进程、迁移和侵袭,降低细胞转移的能力。
Ascl2作为肠道干细胞和结肠癌祖细胞的重要影响因子,在结直肠肿瘤中除了能促进和维持结肠癌干细胞的自我更新,还能通过靶向抑制miR-200家族维持EMT-MET的可塑性[14-16]。研究表明,Ascl2发挥促结直肠肿瘤EMT的作用受到缺氧及HIF-1α的调节,缺氧环境下HIF-1α转录激活Ascl2的表达并抑制miR-200b的转录,而miR-200b可通过负反馈机制靶向抑制HIF-1α的3′UTR区域,进而抑制HIF-1α的表达,故维持结直肠癌细胞EMT的进程。本研究结果显示,Ascl2在结肠癌组织中高表达,且在转移和浸润的组织中表达更高,表明高表达Ascl2的患者具有更低的5年总生存率和无病生存率,提示Ascl2的表达影响结直肠肿瘤的转移及患者的生存预后;过表达MST1/2的SW480细胞中Ascl2和N-cadherin的表达明显低于对照细胞,而E-cadherin表达增加,提示Hippo通路可能通过Ascl2调节EMT相关因子的表达;过表达MST1/2的SW480细胞中Ascl2启动子的转录活性明显低于对照细胞,表明Ascl2的转录受到激活的Hippo通路抑制。
综上所述,本研究发现YAP1/TAZ能通过转录激活Ascl2促进结直肠肿瘤EMT进程,而Hippo通路激活能够抑制Ascl2的转录,从而抑制结肠癌EMT、迁移和侵袭,为研究结直肠肿瘤的转移机制提供新的理论依据。
[1] 詹琪琪,徐卫国.靶向治疗药物在结直肠癌治疗中的应用及进展[J].河北医科大学学报,2018,39(7):860-865.
[2] Castells A. Choosing the optimal method in programmatic colorectal cancer screening:current evidence and controversies[J]. Therap Adv Gastroenterol,2015,8(4):221-233.
[3] Kim JH. Chemotherapy for colorectal cancer in the elderly[J]. World J Gastroenterol,2015,21(17):5158-5166.
[4] Donninelli G,Del Cornò M,Pierdominici M,et al. Distinct blood and visceral adipose tissue regulatory T cell and innate lymphocyte profiles characterize obesity and colorectal cancer[J]. Front Immunol,2017,8:643.
[5] Tian Y,Pan Q,Shang Y,et al. MicroRNA-200(miR-200) cluster regulation by achaete scute-like 2(Ascl2):impact on the epithelial-mesenchymal transition in colon cancer cells[J]. J Biol Chem,2014,289(52):36101-36115.
[6] Du X,Dong Y,Shi H,et al. Mst1 and mst2 are essential regulators of trophoblast differentiation and placenta morphogenesis[J]. PLoS One,2014,9(3):e90701.
[7] Pefani DE,Pankova D,Abraham AG,et al. TGF-β Targets the Hippo Pathway Scaffold RASSF1A to Facilitate YAP/SMAD2 Nuclear Translocation[J]. Mol Cell,2016,63(1):156-166.
[8] Huang W,Lv X,Liu C,et al. The N-terminal Phosphodegron Targets TAZ/WWTR1 Protein for SCFβ-TrCP-dependent Degradation in Response to Phosphatidylinositol 3-Kinase Inhibition[J]. J Biol Che,2012,287(31):26245-26253.
[9] Hwang YW,Yoo NK,Yang HM,et al. RNA polymerase Ⅲ control elements are required for trans-activation by the murine retroviral long terminal repeat sequences[J]. Biochem Biophys Res Commun,2015,456(1):110-115.
[10] Santoro R,Zanotto M,Carbone C,et al. MEKK3 Sustains EMT and stemness in pancreatic cancer by regulating YAP and TAZ transcriptional activity[J]. Anticancer Res,2018,38(4):1937-1946.
[11] Rana MK,Aloisio FM,Choi C,et al. Formin-dependent TGF-β signaling for epithelial to mesenchymal transition[J]. Mol Biol Cell,2018,29(12):1465-1475.
[12] Tang Y,Weiss SJ. Snail/Slug-YAP/TAZ complexes cooperatively regulate mesenchymal stem cell function and bone formation[J]. Cell Cycle,2017,16(5):399-405.
[13] Li Z,Wang Y,Zhu Y,et al. The Hippo transducer TAZ promotes epithelial to mesenchymal transition and cancer stem cell maintenance in oral cancer[J]. Mol Oncol,2015,9(6):1091-1105.
[14] Zhou ZH,Rao J,Yang J,et al. SEMA3F prevents metastasis of colorectal cancer by PI3K-AKT-dependent down-regulation of the ASCL2-CXCR4 axis[J]. J Pathol,2015,236(4):467-478.
[15] Pan Q,Meng L,Ye J,et al. Transcriptional repression of miR-200 family members by Nanog in colon cancer cells induces epithelial-mesenchymal transition (EMT)[J]. Cancer Lett,2017,392:26-38.
[16] 田音,朱蓉,汪荣泉.Ascl2表达抑制对结肠癌细胞上皮-间质转化的影响[J].解放军医学杂志,2013,38(4):292-296.