创伤已成为次于肿瘤、心脑血管疾病的人类第三大致死原因[1]。最新的研究显示,高达84.9%的创伤性休克患者在入院时存在不同程度的创伤性凝血功能异常(trauma induced coagulopathy,TIC),常引发弥漫性血管内凝血(disseminated intravascular coagulation,DIC)、多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)及死亡等严重并发症,故创伤性休克伴TIC患者的早期液体复苏救治就显得极为重要[2]。传统以积极液体复苏(active liquid resuscitation,AFR)为主,可快速维持有效的循环血量,提高重要脏器组织灌注及氧供。近年来Epstein等[3]研究发现,AFR治疗中有25%~30%患者于抢救成功后出现内环境紊乱的现象,加重凝血功能障碍,救治效果不甚理想。损伤控制复苏(damage control resuscitation,DCR)作为一种新的液体复苏策略已被广泛应用于战伤,在救治休克、改善凝血功能障碍等方面发挥了确切的作用[4]。本研究将DCR引入创伤性休克伴TIC患者的液体复苏中,观察DCR、AFR 2种复苏方式对患者凝血功能、免疫调节水平及救治效果的影响,旨在为临床制定液体复苏方案提供客观依据。
1 资料与方法
1.1 一般资料 回顾性分析2012年1月—2017年10月我院收治的94例创伤性休克伴TIC患者的临床资料。纳入标准:①TIC诊断标准活化部分凝血酶原时间(activated partial thromboplastin time,APTT) 为正常值1.5倍以上或>60 s、凝血酶时间>21 s、纤维蛋白原<0.89 g/L、凝血酶原时间(prothrombin time,PT) 为正常值的1.5倍以上或>18 s、血小板计数<50×109/L,其中1项异常即可诊断;②创伤性休克患者;③急性病理学和慢性健康评价Ⅱ(Acute Physiology and Chronic health Evaluation Ⅱ,APACHEⅡ)≥12分;④创伤严重度评分(Injury Severity Score,ISS)≥17分。排除标准:①既往有血液病及凝血功能障碍者;②伤前使用血小板相关药物者;③既往伴有慢性肝病史(Child-Pugh C级以上);④妊娠者;⑤既往有严重慢性心、肺病史;⑥不能严格随访的患者;⑦入院内24 h死亡者或在我院治疗后转院者。2015年1月以前收治的46例患者应用积极液体复苏(AFR组),男性29例(63.04%),女性17例(36.96%);年龄17~58岁,平均(36.36±7.92)岁;烧伤5例,坠落伤13例,交通事故伤15例,压砸伤7例,刀砍伤4例,其他原因伤2例;合并伤:血气胸20例,四肢关节骨折34例,脊柱骨折19例,骨盆骨折17例,腹部脏器损伤23例,大血管损伤13例。2015年2月以后收治的48例患者引入损伤控制复苏方式处理(DCR组),男性31例(64.58%),女性17例(35.42%);年龄18~59岁,平均(37.12±8.32)岁;烧伤6例,坠落伤11例,交通事故伤17例,压砸伤6例,刀砍伤5例,其他原因伤3例;合并伤:血气胸19例,四肢关节骨折35例,脊柱骨折18例,骨盆骨折19例,腹部脏器损伤22例,大血管损伤14例。2组性别、年龄、受伤类型、合并伤构成等一般资料差异均无统计学意义(P>0.05),具有可比性。见表1。
表1 2组一般临床资料比较
Table 1 Comparison of two sets of general clinical data![]()
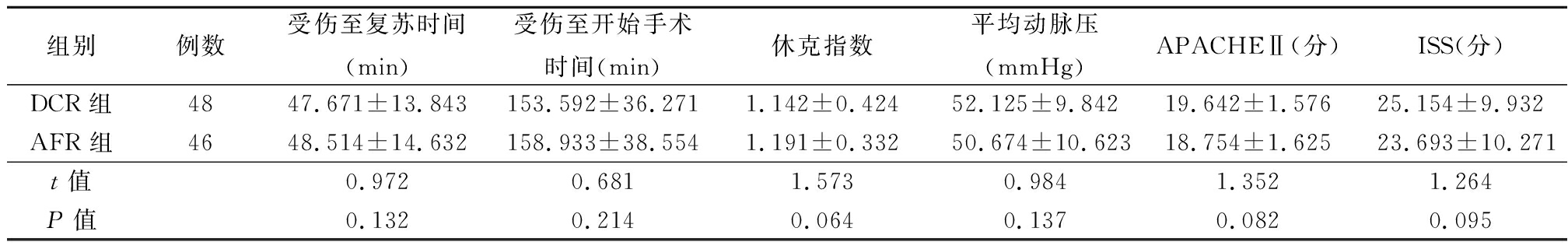
组别例数受伤至复苏时间(min)受伤至开始手术时间(min)休克指数平均动脉压(mmHg)APACHEⅡ(分)ISS(分)DCR组4847.671±13.843153.592±36.2711.142±0.42452.125±9.84219.642±1.57625.154±9.932AFR组4648.514±14.632158.933±38.5541.191±0.33250.674±10.62318.754±1.62523.693±10.271t值0.9720.6811.5730.9841.3521.264P值0.1320.2140.0640.1370.0820.095
注:1 mmHg=0.133 kPa
1.2 治疗方法
1.2.1 常规救治流程 患者入院后评估患者病情严重程度及可能并发风险,进行血流动力学等监测,尽快建立输液通道,保证呼吸通畅及重要脏器功能灌注,救治过程中严格遵循体温控制路径,防止低体温的发生,必要时可多科室联合会诊,明确病情,病情允许时及早实施手术干预。
1.2.2 AFR组治疗 早期充分、快速、大量补充液体容量,乳酸林格液(山东鲁抗辰欣药业有限公司,国药准字0809055117)和等渗氯化钠(西南药业股份有限公司,国药准字H50021772)等晶体液为主1 500~2 000 mL,补充羟乙基淀粉130/0.4氯化钠注射液(北京费森尤斯卡比医药有限公司,国药准字H20103246)等胶体液1 000~1 500 mL,输入大量的血液替代品,血浆∶悬浮去白红细胞比例为4∶1,输注氨甲环酸注射液(广州白云山天心制药股份有限公司,国药准字H20056986),平均动脉压(mean artery pressure,MAP)维持在80~100 mmHg后,进行止血探查处理。若患者血压难以维持,应用盐酸多巴胺注射液(广州白云山明兴制药股份有限公司,国药准字H44022388) 10~20 μg·kg-1·min-1。
1.2.3 DCR组治疗 在复苏后60 min内给予晶体溶液(以乳酸林格氏液和等渗氯化钠为主)500~1 500 mL,再补充胶体溶液(羟乙基淀粉130/0.4氯化钠注射液为主)500~1 000 mL,总的液体纳入量为1 000~1 500 mL,但注意如果合并严重颅脑损伤者,应避免使用乳酸林格液补液,晶体液、胶体液二者比约为2~3∶1,如果患者MAP达到50 mmHg时,限制性减慢补液速度,精确控制液体输入量,将MAP维持在70~80 mmHg,中心静脉压高于2.21 mmHg,谨防酸中毒的发生,若患者血压难以维持,应用多巴胺10~20 μg·kg-1·min-1;同时给予止血性复苏,新鲜冷冻血浆、浓缩红细胞、血小板建议按照1∶1∶1比例输注,若血库成分血制品供量有限时,需直接输注新鲜全血,联合氨甲环酸注射液处理;给予损伤控制性外科手术干预,积极手术止血。
1.3 观察指标 检测复苏前20 min和复苏后12 h的国际标准化比值(international normalized ratio,INR)、APTT、PT、D-二聚体;记录复苏后18 h 2组休克指数(shock index,SI)、MAP、血压波动幅度;检测复苏前20 min和复苏后12 h、24 h、48 h 2组磷脂酶A2(phospholipase A2,PLA2)、血小板活化因子(platelet activating factor,PAF);记录复苏后96 h内DIC、MODS、急性呼吸窘迫综合征(acut respiratory distress syndrome,ARDS)发生率及复苏后1周存活率。
1.4 统计学方法 应用SPSS 20.0统计软件处理数据。计量资料比较分别采用两独立样本的t检验、配对t检验和重复测量的方差分析;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 不同时间点2组凝血功能指标比较 复苏前20 min 2组凝血功能指标差异无统计学意义(P>0.05);复苏后12 h DCR组凝血功能指标值显著低于AFR组(P<0.05)。见表2。
表2 不同时间点2组凝血功能指标比较
Table 2 Comparison of coagulation function between two groups at different time points![]()
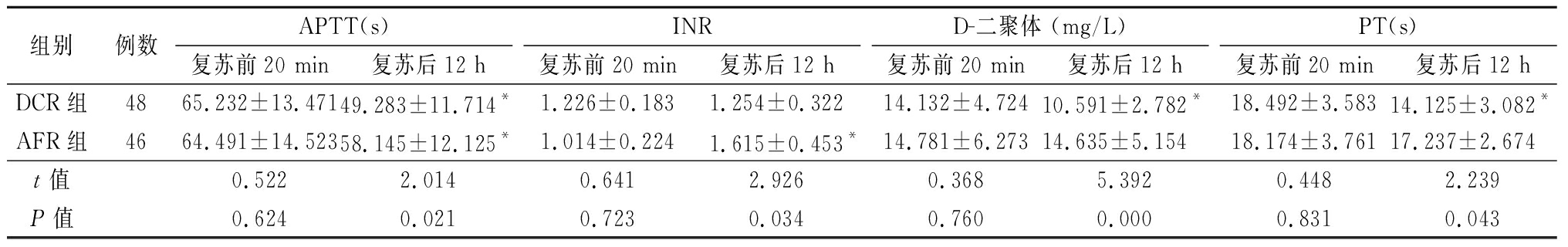
组别例数APTT(s)复苏前20 min复苏后12 hINR复苏前20 min复苏后12 hD-二聚体 (mg/L)复苏前20 min复苏后12 hPT(s)复苏前20 min复苏后12 hDCR组4865.232±13.47149.283±11.714*1.226±0.1831.254±0.32214.132±4.72410.591±2.782*18.492±3.58314.125±3.082*AFR组4664.491±14.52358.145±12.125*1.014±0.2241.615±0.453*14.781±6.27314.635±5.15418.174±3.76117.237±2.674t值0.5222.0140.6412.9260.3685.3920.4482.239P值0.6240.0210.7230.0340.7600.0000.8310.043
*P值<0.05 与复苏前20 min比较(配对t检验)
2.2 复苏后18 h 2组MAP、血压波动幅度、SI、总补液量比较 复苏后18 h DCR组MAP、血压波动幅度、SI及总补液量明显低于AFR组(P<0.05),见表3。
表3 复苏18 h 2组MAP、血压波动幅度、SI、总补液量比较
Table 3 Comparison of MAP,blood pressure fluctuation amplitude,SI and fluid volume between two groups at 18 h after resuscitation![]()
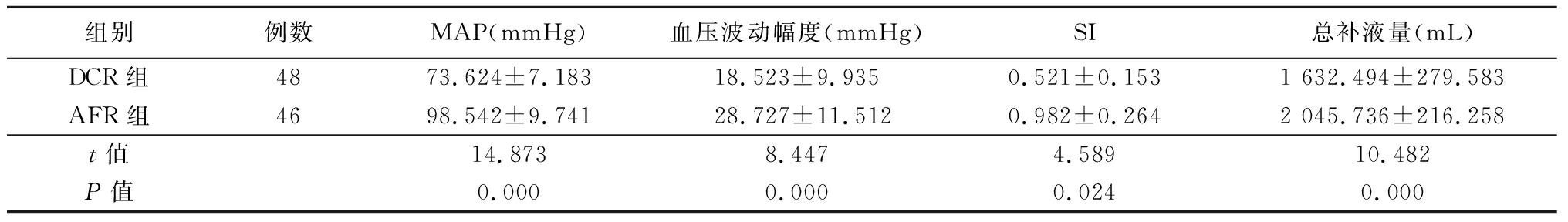
组别例数MAP(mmHg)血压波动幅度(mmHg)SI总补液量(mL)DCR组4873.624±7.18318.523±9.9350.521±0.1531 632.494±279.583AFR组4698.542±9.74128.727±11.5120.982±0.2642 045.736±216.258t值14.8738.4474.58910.482P值0.0000.0000.0240.000
2.3 2组免疫细胞因子、炎症介质比较 复苏前20 min和复苏后24 h 2组PAF、PLA2差异无统计学意义(P>0.05),复苏后12 h DCR组PAF、PLA2明显高于AFR组,复苏后48 h DCR组PAF、PLA2明显低于AFR组,其组间和组间与时点间交互作用差异均有统计学意义(P<0.05),而时点间差异无统计学意义(P>0.05),见表4。
表4 2组细胞因子、炎症介质指标比较
Table 4 Comparison of cytokines and inflammatory mediators between two groups![]()
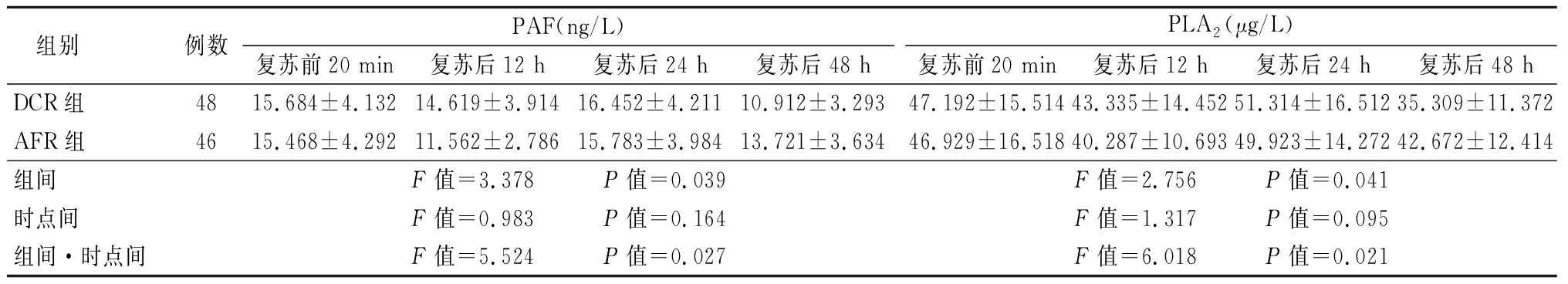
组别例数PAF(ng/L)复苏前20 min复苏后12 h复苏后24 h复苏后48 hPLA2(μg/L)复苏前20 min复苏后12 h复苏后24 h复苏后48 hDCR组4815.684±4.13214.619±3.91416.452±4.21110.912±3.29347.192±15.51443.335±14.45251.314±16.51235.309±11.372AFR组4615.468±4.29211.562±2.78615.783±3.98413.721±3.63446.929±16.51840.287±10.69349.923±14.27242.672±12.414组间 F值=3.378 P值=0.039F值=2.756 P值=0.041时点间 F值=0.983 P值=0.164F值=1.317 P值=0.095组间·时点间F值=5.524 P值=0.027F值=6.018 P值=0.021
2.4 2组并发症发生率和存活率比较 复苏后96 h内DCR组ARDS、DIC、MODS发生率明显低于AFR组,复苏后1周存活率DCR组明显高于AFR组,差异均有统计学意义(P<0.05),见表5。
表5 2组并发症发生率和存活率比较
Table 5 Comparison of complications and survival rates between two groups (例数,%)
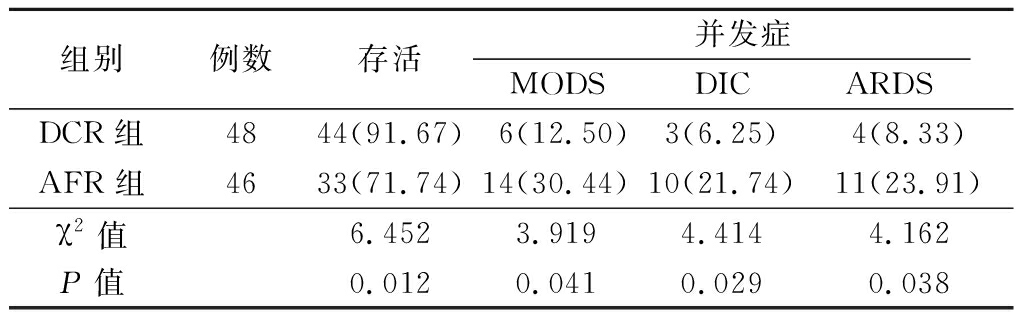
组别例数存活并发症MODSDICARDSDCR组4844(91.67)6(12.50)3(6.25)4(8.33)AFR组4633(71.74)14(30.44)10(21.74)11(23.91)χ2值6.4523.9194.4144.162P值0.0120.0410.0290.038
3 讨 论
随着高速交通、重工业的迅猛发展,道路交通伤、爆炸伤及砸压伤等高能量创伤导致的休克伴TIC的患者不断增加[5]。近年来,创伤性休克伴TIC患者的救治水平有所提高,但仍有大量难题亟待解决,其中液体复苏方法的选择一直是治疗难点及热点。DCR的理念及方法主要包括:①止血性复苏,早期应用血液制品联合抗凝血病药物使用;②低压复苏,既保证重要脏器的基本灌注,又避免血压波动的不利影响;③限制性液体复苏,严格限制晶体液的输入,防止稀释性凝血障碍、低体温发生,切实避免了 “致死三联征” 的发生,提高了国际战伤救治水平[6]。本研究将DCR用于休克伴TIC患者的诊疗中,与传统AFR进行比较,结果显示DCR、AFR 2组患者入院时受伤类型构成、ISS评分、MAP等病情差异无统计学意义,DCR较之AFR在维持血压稳定性、纠正休克指数、改善凝血功能、降低并发症发生率等方面优势明显。
创伤性休克的患者易发生TIC[7],这可能与凝血因子、免疫调节因子、炎症介质的过度释放,激素调节的紊乱同时伴有休克、酸中毒、感染等多重致病因素叠加效益,激活内源性及外源性凝血系统有关[8]。因此,TIC是重症创伤性休克患者死亡的独立危险因素,纠正TIC是创伤性休克伴TIC患者液体复苏治疗的关键。临床上APTT、INR均是监测TIC较为有效的指标[9],同时D-二聚体也很敏感,其含量升高表示机体处于高纤溶和高凝的病理状态,动态监测对于评价多发创伤伴TIC患者的预后及治疗效果有较为重要的意义[10]。本研究AFR组在复苏后18 h快速及大量输液(2 045.736±216.258) mL,血红蛋白及凝血因子被稀释,机体供氧能力下降,加重凝血功能障碍,同时大量液体灌注抑制患者肺泡氧合功能、心肌收缩功能及肾脏滤过功能,出现ARDS、MODS及死亡等严重并发症[11],导致并发症发生率升高;DCR组采用允许性低血压复苏,在血压稳定70~80 mmHg范围内、保证机体的基本血液供应的前提下,血压波动幅度较之AFR组小,精确控制液体进入量(1 632.494±279.583)mL,源头上调控,防止血红蛋白及凝血因子被稀释,提高机体供氧能力,避免血压波动幅度过大对靶向器官(肺、心、肾等)造成副损伤[12];同时止血性复苏,给予等比例成分输血联合止血药物治疗等诸多措施,有效改善凝血功能及休克状态,防止TIC的进展及恶化;复苏前2组凝血功能指标、SI比较差异无统计学意义,复苏后12 h DCR组凝血功能指标、复苏后18 h DCR组SI值明显优于AFR组;由于DCR对重要器官的保护,复苏后96 h DCR组并发症发生率明显低于AFR组,明显提高患者复苏后1周的存活率。说明DCR较AFR可以更好地改善创伤性休克伴TIC患者的凝血功能指标及预后,同时使液体复苏达到一个平衡点,既通过DCR适当恢复重要脏器的再灌注,又不过多地扰乱机体的内环境及代偿机制,进而优化治疗效果[13]。
创伤性休克伴TIC患者的病理改变是多种细胞因子、炎症介质参与的结果,致使不同水平层次的免疫应答丧失,导致相关并发症的发生,故炎症反应是影响复苏质量的重要指标之一[14]。诸多致病因子中,PAF是最为关键的始动因子,能增加毛细血管的通透性,导致微循环及细胞功能障碍;同时它能损害血管内皮细胞的抗凝功能,使凝血时间明显缩短,导致使机体处于高凝状态[15],加重凝血功能障碍。PLA2是内毒素的生物活性最强的部分,使多种肠道细菌及病毒移位,导致炎症介质的大量外源性释放,致使机体出现全身炎症反应综合征[16],如果复苏治疗介入不及时,PLA2致使炎症链级反应发生,导致DIC的发生,同时介导髓系抑制性细胞(myeloid suppressor cells,MDSCs)增殖或上调其活性[17],激活机体免疫抑制机制,使肺部通透性明显降低,出现ARDS,加重凝血功能障碍,最终导致MODS,甚至死亡[18]。本研究复苏前20 min 2组PAF、PLA2等指标差异无统计学意义(P>0.05),复苏后12 h DCR组PLA2明显高于AFR组(P<0.05)。提示积极液体复苏能有效减轻休克后早期的免疫抑制,这是由于早期大量液体灌注,有效减少毛细血管渗漏综合征的发生,改善微循环障碍,减轻肠黏膜缺血,一定程度上改善屏障功效,使血管通透性降低,减少PLA2、PAF等细胞因子及炎症介质入血,故AFR较DCR可更为有效地改善机体早期免疫调节功能。本研究复苏后24 h 2组PLA2、PAF等指标差异无统计学意义(P>0.05),复苏后48 h DCR组PLA2、PAF明显低于AFR组(P<0.05),24 h、48 h 2组PLA2、PAF值均先增加后减少,可能是由于随着复苏进程的发展,等渗氯化钠溶液可将大量细胞因子、炎症介质动员至外周血液中,使得PLA2、PAF值升高,由于液体复苏的介入,免疫应答发挥作用,致使多种致病因子及介质下降;应用DCR后48 h PLA2、PAF数值比该复苏方式24 h数值下降明显,但应用AFR后48 h PLA2、PAF数值比该复苏方式24 h数值轻度下降,致使48 h DCR组PLA2、PAF明显低于AFR组,说明随着病情发展,AFR对机体免疫调节作用优势不明显,而DCR优势更为显著。
综上所述,对于创伤性休克伴TIC患者应用DCR进行抢救治疗,能够更好地纠正患者的凝血功能障碍,有效救治休克,减少并发症发生,明显提高存活率,值得临床推广;而AFR改善患者早期免疫调节作用更为明显,故在液体复苏早期过程中注重对细胞因子及炎症介质的干预,适当增加补液量,可改善凝血功能障碍,提高创伤性休克伴TIC患者的救治水平。由于本研究纳入样本量少,观察时间短,还需在今后的临床工作中进一步探讨及总结。
[1] 史云光,张志刚,张瑞英,等.多发伤患者凝血功能指标在病情程度及预后判断中的作用研究[J].海军医学杂志,2017,38(2):170-174.
[2] Rossaint R,Bouillon B,Cerny V,et al. The European guideline on management of major bleeding and coagulopathy following trauma:fourth edition[J]. Crit Care,2016,20:100.
[3] Epstein DS,Mitra B,O′Reilly G,et al. Acute traumatic coagulopathy in the setting of isolated traumatic brain injury:a systematic review and meta-analysis[J]. Injury,2014,45(5):819-824.
[4] Kragh JF Jr,Dubick MA,Aden JK 3rd,et al. U.S.military experience from 2001 to 2010 with extremity fasciotomy in war surgery[J]. Mil Med,2016,181(5):463-468.
[5] Leman P,Morley P. Review article:Updated resuscitation guidelines for 2016:a summary of the australian and new zealand committee on resuscitation recommendations[J]. Emerg Med Australas,2016,28(4):379-382.
[6] Chang R,Holcomb JB. Optimal fluid therapy for traumatic hemorrhagic shock[J]. Crit Care Clin,2017,33(1):15-36.
[7] Davenport RA,Brohi K. Cause of trauma induced coagulopathy[J]. Curr Opin Anaesthesiol,2016,29(2):212-219.
[8] Maegele M,Schochl H,Cohen MJ. An update on the coagulopathy of trauma[J]. Shock,2014,41(Suppl 1):21-25.
[9] 张宪,刘红升,姚咏明,等.创伤失血性休克限制性液体复苏中急诊监测的临床意义[J].中国急救医学,2015,35(12):1097-1099.
[10] 郝继山,季庆,孙清,等.限制性液体复苏对颅脑损伤合并多发伤的疗效[J].中华创伤杂志,2015,31(2):124-127.
[11] Maitland K,Kiguli S,Opoka RO,et al. Mortality after fluid bolus in African children with severe infeetion[J]. N Engl J Med,2011,364(26):2483—2495.
[12] White NJ,Wang X,Bradbury N,et al. Fluid resuscitation of uncontrolled hemorrhage using a hemoglobin-based oxygen carrier:effect of traumatic brain injury[J]. Shock,2013,39(2):210-219.
[13] Lipsky AM,Ganor O,Abramovich A,et al. Walking between the drops:lsraeli defense forces fluid resuscitation protocol[J]. J Emerg Med,2013,44(4):790-795.
[14] 杭太香,吴珊珊,王玉洁,等.手术时问对老年患者开腹手术后复苏的影响及可能机制探讨[J].河北医科大学学报,2016,37(9):1055-1059.
[15] 张俊.TIA进展为脑梗死患者血清血小板活化因子的含量及与凝血功能、炎症 反应的相关性[J].海南医学院学报,2017,23(15):2157-2160.
[16] 栾赤兵.炎症因子表达及凝血相关指标检测在急性进展性脑梗死中的应用研究[J].中国实用医药,2017,12(16):10-12.
[17] 尹松涛,李玲雁,张国君,等.不同液体复苏对多发伤伴失血性休克患者凝血功能及髓系抑制性细胞数的影响[J].广西医科大学学报,2017,34(11):1611-1613.
[18] De SF,Solito S,Ugel S,et al. MDSCs in cancer:Conceiving new prognostic and therapeutic targets[J]. Biochim Biophys Acta,2016,1865(1):35-48.