子痫前期(pre-eclampsia,PE)是妊娠期特有的高血压性疾病,随着疾病严重程度的升高,常常伴随心肝肾和脑功能损伤,并可导致胎儿宫腔内发育迟缓甚至胎死宫内[1]。其中最常累及的器官为肾脏,多表现为肾小管通透性增加、尿蛋白增多等[2]。早诊断和早治疗对预防和保护肾功能损害具有十分重要的作用。近年来尿肾损伤因子1(renal injury molecule 1,KIM-1)和血清胱抑素C(cystatin C,Cys C)对损伤诊断价值越来越受到关注[3-4]。信号素3A(semakin 3A,Sema 3A)属于轴突导向因子家族中一种分泌型蛋白,对足细胞分化、肾小球滤过屏障形成和血管内皮细胞迁移过程有重要的调节作用,与肾功能损伤的发生发展具有密切联系。本研究旨在观察联合检测Sema 3A、KIM-1和Cys-C水平在诊断PE患者早期肾功能损害中的临床意义,现报告如下。
1 资料与方法
1.1 一般资料 选择2016年10月—2018年3月在上海市浦东新区妇幼保健院就诊的PE患者116例,根据子痫的严重程度分为轻度PE组(67例)和重度PE组(49例)。其中轻度PE组年龄25~38岁,平均(35.14±2.37)岁,孕周30~41周,平均(35.25±3.64)周,体重指数26.23±4.62;重度PE组年龄28~45岁,平均(35.45±5.18)岁,孕周27~39)周,平均(35.34±3.16)周,体重指数26.58±5.27。根据肾小球滤过率不同分为肾功能正常组(65例,≥90 mL·min-1·1.73 m-2)和肾功能异常组(51例,<90 mL·min-1·1.73 m-2)。纳入标准:①患者均知情同意,研究经医院伦理委员会批准;②单胎妊娠;③无免疫性疾病者;④无高血压、糖尿病和肾脏原发性疾病者。排除标准:①慢性高血压患者;②妊娠不足20周;③辅助生育技术者;④精神疾病者;⑤原有心、肝、肺等重要脏器功能障碍者;⑥肝炎、结核和急性肺炎等急慢性感染者。另选择同期行产检并分娩的孕妇60例作为对照组,年龄20~45岁,平均(34.67±4.38)岁,孕周27~41周,平均(35.76±4.86)周,体重指数26.16±4.67。3组年龄、孕周、体重指数等差异均无统计学意义(P>0.05),具有可比性。
1.2 PE严重程度分组 轻度PE组:表现为妊娠20周后出现收缩压≥140 mmHg(1 mmHg=0.133 kPa)和(或)舒张压≥90 mmHg,伴蛋白尿≥0.3 g/24 h或随机蛋白尿为“+”及以上。重度PE组:当出现以下任何一种情况即诊断为重度PE,血压持续升高≥160 mmHg和(或)舒张压≥110 mmHg,尿蛋白定量≥2.0 g/24 h或随机蛋白尿≥“++”,血清肌酐(serum creatinine,SCr)≥105.84 μmol/L,血小板低于100×109/L,血清转氨酶水平升高,出现持续上腹痛,持续头痛或视觉障碍,微血管性溶血。
1.3 血液指标检测 患者入院后在治疗前取清洁中段尿液20 mL,在无菌条件下常温离心15 min,离心速度3 000 r/min,离心半径6 cm,收集上清液,放入5 μL蛋白酶抑制剂,放置在-80 ℃的冰箱中。同样取患者肘静脉血约10 mL,用离心机2 500 r/min,离心半径6 cm,离心10 min,分离出上清液,放置在-80 ℃的冰箱中保存。24 h尿蛋白采用免疫比浊法;SCr、尿素氮(blood urea nitrogen,BUN)和尿酸(uric acid,UA)应用美国GE公司生产的全自动生化分析仪检测,根据SCr计算肾小球滤过率;Sema 3A、KIM-1和Cys C应用电化学发光仪(瑞士罗氏公司)检测,采用Elecsys软件自动通过定标曲线计算出Sema 3A、KIM-1和Cys C含量。
1.4 观察指标 观察对照组、轻度PE组和重度PE组的Sema 3A、KIM-1和Cys C表达水平,PE患者Sema 3A、KIM-1和Cys C含量之间的相关性及其与肾功能损害的关系,并探讨联合Sema 3A、KIM-1和Cys C指标在早期诊断肾功能损害中的价值。
1.5 统计学方法 应用SPSS 12.0统计软件分析数据。计量资料比较分别采用两独立样本的t检验、F检验和SNK-q检验;计数资料比较采用χ2检验;相关性采用Spearman相关分析;采用Logistic回归建立联合检测的新变量,与各指标独立检测绘制ROC曲线。P<0.05为差异有统计学意义。
2 结 果
2.1 3组24h尿蛋白、SCr、BUN、UA、肾小球滤过率比较 轻度PE组和重度PE组24 h尿蛋白、SCr、BUN和UA均明显高于对照组,肾小球滤过率明显低于对照组(P<0.05);重度PE组24 h尿蛋白和UA均明显高于轻度PE组,肾小球滤过率明显低于轻度PE组(P<0.05)。见表1。
表1 3组24 h尿蛋白、SCr、BUN、UA和肾小球滤过率比较
Table 1 Comparison of 24 h urine protein,SCr,BUN,UA and glomerular filtration rate in three groups![]()
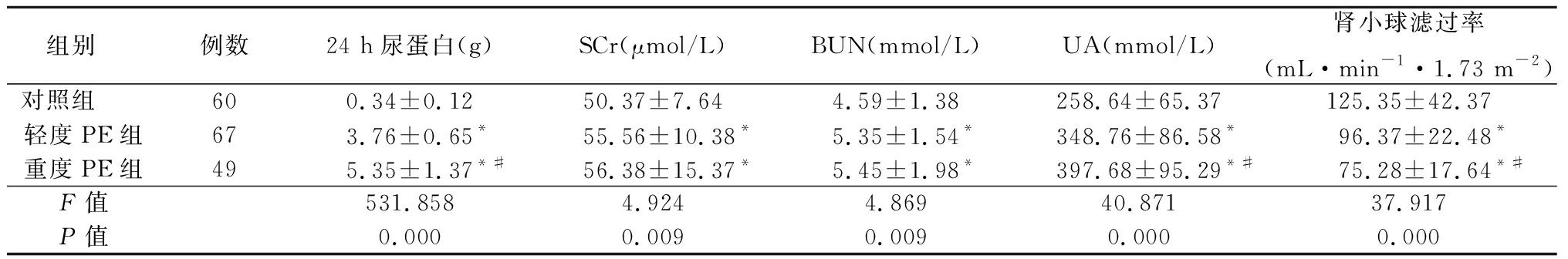
组别 例数24 h尿蛋白(g)SCr(μmol/L)BUN(mmol/L)UA(mmol/L)肾小球滤过率(mL·min-1·1.73 m-2)对照组 600.34±0.1250.37±7.644.59±1.38258.64±65.37125.35±42.37轻度PE组673.76±0.65*55.56±10.38*5.35±1.54*348.76±86.58*96.37±22.48*重度PE组495.35±1.37*#56.38±15.37*5.45±1.98*397.68±95.29*#75.28±17.64*#F值531.8584.9244.86940.87137.917P值0.0000.0090.0090.0000.000
*P值<0.05与对照组比较 #P值<0.05与轻度PE组比较(SNK-q检验)
2.2 3组尿液Sema 3A、KIM-1和血清Cys C水平比较 轻度PE组和重度PE组尿液Sema 3A、KIM-1和血清Cys C水平均明显高于对照组(P<0.05);重度PE组尿液Sema 3A、KIM-1和血清Cys C水平均明显高于轻度PE组(P<0.05)。见表2。
表2 3组尿液Sema 3A、KIM-1和血清Cys C水平比较
Table 2 Comparison of urine Sema 3A,KIM-1 and serum Cys C levels in three groups![]()

组别 例数Sema 3A(mg/L)KIM-1(μg/L)Cys C(mg/L)对照组 600.95±0.234.85±1.4656.35±9.37轻度PE组671.85±0.62*7.67±1.67*156.47±18.19*重度PE组492.41±0.98*#10.56±2.18*#259.20±20.65*#F值70.963143.4342024.794P值0.0000.0000.000
*P值<0.05与对照组比较 #P值<0.05与轻度PE组比较(SNK-q检验)
2.3 PE患者尿液Sema 3A、KIM-1和血清Cys C水平之间的相关性分析 PE患者尿液Sema 3A水平与尿液KIM-1和血清Cys C水平呈正相关(rs=0.791、0.683,P<0.05),尿液KIM-1与血清Cys C水平呈正相关(rs=0.837,P<0.05)。
2.4 肾功能异常组和肾功能正常组尿液Sema 3A、KIM-1和血清Cys C水平比较 肾功能异常组尿液Sema 3A、KIM-1和血清Cys C水平均明显高于肾功能正常组(P<0.05),见表3。
2.5 Sema 3A,KIM-1和Cys C含量早期诊断PE患者肾功能异常的ROC曲线分析 以Sema 3A、KIM-1、Cys C水平和联合检测(Sema 3A+KIM-1+Cys C)作为检验变量,以肾功能损害为状态变量绘制ROC曲线。联合检测的最佳截断值为>0.258,其灵敏度为72.5%,特异度为93.8%,ROC曲线下面积为0.890,联合检测的曲线下面积明显大于Sema 3A(Z=3.399,P<0.05)、KIM-1(Z=3.377,P<0.05)和Cys C(Z=3.225,P<0.05),而Sema 3A,KIM-1和Cys C曲线下面积之间差异无统计学意义(P>0.05),见表4。
表3 肾功能异常组和肾功能正常组尿液Sema 3A、KIM-1和血清Cys C水平比较
Table 3 Comparison of urine Sema 3A,KIM-1 and serum Cys C levels with renal dysfunction and normal renal function![]()

组别例数Sema 3A(mg/L)KIM-1(μg/L)Cys C(mg/L)肾功能异常组512.55±0.92 9.67±2.14 210.37±20.67 肾功能正常组651.72±0.67 8.28±1.76 191.62±18.39 t值5.6203.8385.161P值0.0000.0000.000
表4 Sema 3A、KIM-1和Cys C含量在早期诊断PE患者肾功能异常的ROC曲线分析
Table 4 ROC curve analysis of Sema 3A,KIM-1 and Cys C content in early diagnosis of renal function abnormality in patients with preeclampsia
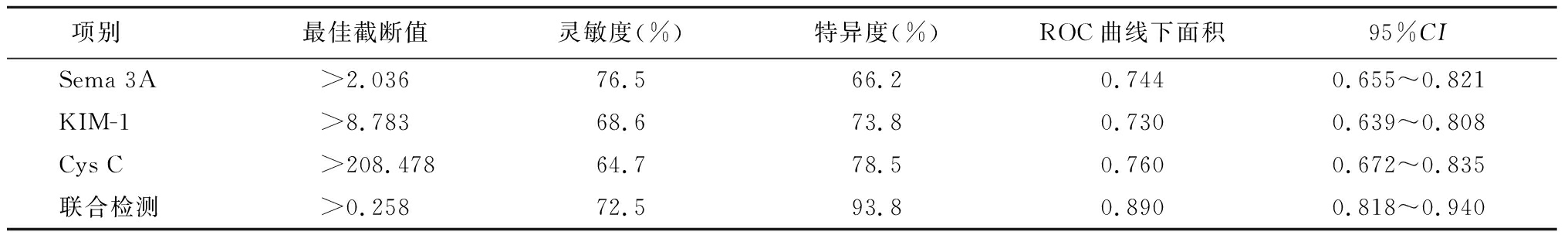
项别 最佳截断值灵敏度(%)特异度(%)ROC曲线下面积95%CISema 3A>2.03676.566.20.7440.655~0.821KIM-1>8.78368.673.80.7300.639~0.808Cys C >208.47864.778.50.7600.672~0.835联合检测>0.25872.593.80.8900.818~0.940
3 讨 论
PE患者主要的病理生理变化是全身小动脉痉挛,从而导致全身各个器官缺血缺氧,肾脏的病理变化主要为肾小球血管壁内皮细胞肿胀、体积增大和血流淤滞等。肾脏排出的代谢产物主要包括BUN、SCr和UA,在正常妊娠状态下,其排出量比非妊娠期明显增多;但在PE的病理状态下,由于肾血流量明显降低,其排出量明显降低[5-6]。本研究结果显示,轻度PE组和重度PE组24 h尿蛋白、SCr、BUN和UA明显高于对照组,肾小球滤过率明显低于对照组;重度PE组24 h尿蛋白、UA高于轻度PE组,肾小球滤过率低于轻度PE组。表明PE患者肾功能受损时,24 h尿蛋白、UA及肾小球滤过率可能比SCr、BUN更能反映肾功能损害的严重程度。
Sema 3A在未完全发育的肾脏中主要定位于S型小体和输尿管芽,而在成熟肾脏中主要定位于足细胞、集合管和远曲小管,在输尿管芽的形成过程中起到负调节作用[7]。近年来越来越多的研究表明,Sema 3A在急性肾损伤早期诊断中具有重要作用和价值。如在实行心肺转流手术所导致的缺血性肾损伤过程中,尿Sema 3A水平明显升高,并且在损伤发生后3 h就已出现明显升高趋势,而传统SCr改变多在损伤发生后24 h。因此,尿Sema 3A水平可作为缺血性急性肾损伤早期诊断的生物学指标[8]。目前,Sema 3A主要用于肝移植术后急性肾损伤的早期诊断。有研究显示,尿Sema 3A水平是肝移植术后急性肾损伤的独立早期诊断因子,并且发现对Sema 3A基因进行干预后,能够保护肾功能和改善预后[9]。而在PE患者中诊断肾功能损伤的研究较少。本研究结果显示,轻度PE组和重度PE组尿液Sema 3A水平明显高于对照组,肾功能异常组尿液Sema 3A水平明显高于肾功能正常组。说明尿液Sema 3A水平与PE患者肾功能损害有一定关系。KIM-1属于跨膜蛋白类,在正常情况下不表达,肾损伤时患者尿液中的KIM-1表达明显增加,尿液中的KIM-1水平是反映肾脏的损伤程度的重要指标[10-11]。本研究结果显示,轻度PE组和重度PE组尿液KIM-1水平明显高于对照组,重度PE组尿液KIM-1水平明显高于轻度PE组,肾功能异常组尿液KIM-1水平明显高于肾脏功能正常组。表明KIM-1是PE患者肾脏损伤的重要指标,并在一定程度上与疾病的严重程度相关。Cys C是由122个氨基酸组成的低分子非糖基化蛋白,在机体中的生成稳定,不受年龄、饮食习惯等因素的影响,肾脏是其唯一的清除器官[12-13]。在肾功能轻度损伤早期,血清Cys C水平明显升高[14-15]。本研究结果显示,轻度PE组和重度PE组血清Cys C水平明显高于对照组,肾功能异常组Cys C水平明显高于肾功能正常组。说明Cys C是反映PE患者肾功能损伤的指标之一。
本研究结果显示,PE患者尿Sema 3A水平与尿KIM-1和血清Cys C水平呈正相关,尿KIM-1与血清Cys C水平呈正相关。上述3个指标在诊断肾功能损伤方面是否有着某种内在联系?联合检测3个指标诊断PE患者出现肾功能损伤是否更具有临床价值?尚需要进一步研究。本研究以Sema 3A、KIM-1、Cys C水平和联合检测(Sema 3A+KIM-1+Cys C)作为检验变量,以肾功能损害为状态变量绘制ROC曲线。在早期诊断肾功能损害方面,Sema 3A的最佳截断值为>2.036,其灵敏度为76.5%,特异度为66.2%,曲线下面积为0.744;KIM-1的最佳截断值为>8.783,其灵敏度为68.6%,特异度为73.8%,曲线下面积为0.730;Cys C的最佳截断值为>208.478,其灵敏度为64.7%,特异度为78.5%,曲线下面积为0.760;联合检测的最佳截断值为>0.258,其灵敏度为72.5%,特异度为93.8%,曲线下面积为0.890。联合检测的曲线下面积明显大于Sema 3A(Z=3.399,P<0.05)、KIM-1(Z=3.377,P<0.05)和Cys C(Z=3.225,P<0.05),而Sema 3A、KIM-1和Cys C的曲线下面积差异无统计学意义。说明单个指标检测虽然有一定的临床诊断价值,但联合检测在PE患者肾功能损害的早期诊断中其灵敏度和特异度均明显升高,具有重要的临床价值。
总之,PE患者同时检测Sema 3A、KIM-1和Cys-C,其灵敏度和特异度均优于单项指标检测,能够更好地早期诊断肾功能损害,具有重要的临床价值。
[1] Sur nyi A,Altorjay
nyi A,Altorjay  ,Kaiser L,et al. Evaluation of placental vascularization by three-dimensional ultrasound examination in second and third trimester of pregnancies complicated by chronic hypertension,gestational hypertension or pre-eclampsia[J]. Pregnancy Hypertens,2017,8:51-59.
,Kaiser L,et al. Evaluation of placental vascularization by three-dimensional ultrasound examination in second and third trimester of pregnancies complicated by chronic hypertension,gestational hypertension or pre-eclampsia[J]. Pregnancy Hypertens,2017,8:51-59.
[2] Arab M,Entezari M,Ghamary H,et al. Peripapillary retinal nerve fiber layer thickness in preeclampsia and eclampsia[J]. Int Ophthalmol,2017[Epub ahead of print].
[3] 黄菁,郑美玲,王玉珏,等.尿肾损伤分子1、血清胱抑素C和尿中性粒细胞明胶酶相关性脂质运载蛋白早期诊断子痫前期发病和早期肾损伤的价值[J].中国医科大学学报,2016,45(5):460-463.
[4] Niraula A,Lamsal M,Baral N,et al. Cystatin-C as a marker for renal impairment in preeclampsia[J]. J Biomark,2017,2017:7406959.
[5] 陈鹏,史琳,杨红梅,等.妊娠期高血压、子痫前期及子痫与孕前和孕期体质量及其他因素的相关性研究[J].实用妇产科杂志,2017,33(11):848-852.
[6] 孙白云,乔东艳,于红.滋养细胞焦亡与子痫前期发病机制的研究进展[J].国际妇产科学杂志,2017,44(6):610-613,625.
[7] 田漫漫,赵双平.尿Sema3A对重症监护病房患者急性肾损伤的早期诊断价值[J].中华医学杂志,2015,95(19):1457-1462.
[8] 廖正.信号素3A与肾脏疾病[J].肾脏病与透析肾移植杂志,2017,26(6):540-544.
[9] 郭玉娜,匡梦华,刘伟,等.子痫前期孕妇血清细胞因子信号转导负调控因子-3、肿瘤坏死因子-α及白细胞介素-10水平变化的临床价值[J].中华医学杂志,2015,95(1):23-25.
[10] 申伟,李清怀,李筱雨,等.重症急性胰腺炎大鼠肾损伤的血清及尿液生化指标变化趋势研究[J].河北医科大学学报,2014,35(10):1117-1120.
[11] 王琳,郝明.β2-MG、ET-1与KIM-1联合检测对子痫前期肾损伤的早期诊断价值[J].内科急危重症杂志,2018,24(1):69-71.
[12] 翟连臣.血清胱抑素C、超敏C反应蛋白和同型半胱氨酸检测在妊娠高血压早期肾损伤的临床价值[J].实验与检验医学,2018,36(1):101-102,126.
[13] 王亚军.肾血流动力学、相关标志物和炎性因子评价妊娠高血压疾病患者肾功能的临床研究[J].河北医科大学学报,2016,37(9):1093-1096.
[14] Yalcin S,Ulas T,Eren MA,et al. Relationship between oxidative stress parameters and cystatin C levels in patients with severe preeclampsia[J]. Medicina(Kaunas),2013,49(3):118-123.
[15] 阮丹燕,夏训和,程运涛.血清胱抑素C在诊断妊娠高血压综合征患者肾功能损伤中的价值[J].安徽医学,2017,38(10):1290-1292.