结核病是由结核分枝杆菌引发的慢性传染性疾病,耐药结核分枝杆菌的产生与播撒,特别是耐多药结核菌,已经成为结核病预防和控制的难题之一[1-2]。根据世界卫生组织报道,2016年全球估计有1 040万人患有结核病,其中耐药结核占新增结核病的4.1%[3]。杨新宇等[4]报道,结核分枝杆菌复合群临床分离株的总耐药率为33.3%,耐多药率为17.2%,耐药菌株药敏试验显示对异烟肼(isoniazid,INH)、利福平(rifampin,RFP)、链霉素(streptomycin,SM)和乙胺丁醇(ethambutol,EMB)的高耐药百分比分别为69.0%、57.1%、60.5%和31.7%。因此,快速检测结核耐药情况是治疗和预防耐药结核病的重要手段。传统的培养/药敏法仍是进行结核分枝杆菌鉴定和耐药情况检测的“金标准”,但其所需时间较长。噬菌体生物扩增法(pha B)利用噬菌体生长快、只能在活的结核分枝杆菌中增殖的特性,能够以较高的敏感度和特异度快速检测结核分枝杆菌耐药性[5]。近年来,根据靶序列熔点变化,实时PCR检测结核分枝杆菌基因组中的耐药相关突变位点变化的分子生物学方法——荧光定量PCR探针熔解曲线法(PCR法)[6-7],逐渐被广泛接受。因此,本研究旨在通过BACTEC MGIT 960药敏法(BD960)、pha B和PCR法同时检测结核患者的临床分离株对INH、RFP、SM和EMB的耐药情况,评估3种方法检测结核分枝杆菌抗结核一线药物耐药性的临床效能及应用价值。
1 材料与方法
1.1 菌株来源 收集2018年7—12月河北省胸科医院80例门诊及住院患者结核分枝杆菌临床分离株样本,经BACTEC MGIT 960全自动仪分枝杆菌培养及涂片鉴定,均为结核分枝杆菌阳性。
1.2 试剂和材料 结核分枝杆菌-噬菌体检测试剂盒(BIOTECLab产品,英国);结核分枝杆菌耐药突变检测试剂盒(荧光PCR熔解曲线法)购自厦门致善生物科技有限公司;INH、RFP、SM和EMB药物来源于医院药房,与患者使用药物一致。
1.3 检测方法
1.3.1 BD960 参照AST操作程序要求,接种0.5 mL菌悬液至最终浓度分别为1.0,0.1,1.0,5.0 mg/L的SM、INH、RFP、EMB含药管,生长对照管加1∶100无菌生理盐水稀释的菌悬液0.5 mL,按生长对照管、SM、INH、RFP、EMB的顺序置于BD960系统药敏测试架,扫描测试架条形码,按照仪器指示位置放入。由检测仪报告药敏结果。
1.3.2 pha B 在对照管和试验管中分别加入1∶5 000稀释的待检菌液0.5 mL,分别在试验管中加入0.5 mL SM 、INH、RFP及EMB,对照管加0.5 mL液体培养基混匀37 ℃作用48 h。分别计算每个菌株的加药管与对照管的噬菌斑减少百分比。以加药管与对照管的噬菌斑减少百分比≥99%判为敏感,反之为耐药;INH以加药管与对照管的噬菌斑减少百分比>95%为判断标准。
1.3.3 PCR法 经DNA提取、扩增、杂交、仪器判读等步骤,每一步骤均严格按照操作规程进行。分别用结核分枝杆菌SM、INH、RFP及EMB耐药突变检测试剂盒进行检测。所有PCR扩增体系均为25 μL。反应程序按试剂盒说明书进行操作,并进行结果判读。每个标本有2个反应管,每种突变检测FAM和TET 2个通道荧光信号,即每个标本有4个通道的检测结果。其中标本的熔点与阳性对照(每种突变检测均有2种阳性对照)的熔点均一致(误差不超过1 ℃)时判定为野生型;4个通道任一通道中标本的熔点低于阳性对照2 ℃及以上时判定为突变型。
1.4 统计学方法 应用SPSS 16.0统计软件处理数据。以BD960为金标准计算其他2种方法的灵敏度和特异度。Kappa检验分析检测结果的一致性:Kappa值<0.40为低度一致性;Kappa值0.40~0.74为中度一致性;Kappa值≥0.75~1.00为高度一致性。非正态分布计量资料以中位数(25%位数,75%位数)表示,组间差异分析采用非参数秩和检验。计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
80株经BACTEC MGIT 960全自动仪分枝杆菌培养及涂片鉴定,均为结核分枝杆菌阳性的临床分离株,同时采用BD960、pha B和PCR法进行抗结核一线药物的耐药检测。
pha B法和PCR法平均报告时间明显短于BD960法, PCR法平均报告时间明显短于pha B法,差异有统计学意义(P<0.05);3种方法对80株临床分离株进行SM、INH、RFP和EMB耐药检测,耐药检出结果差异均无统计学意义(P>0.05)。见表1。
表1 3种检测方法平均报告时间及耐药检出结果比较
Table 1 Comparison of average reported days and drug resistance detection results of three detection methods (n=80)
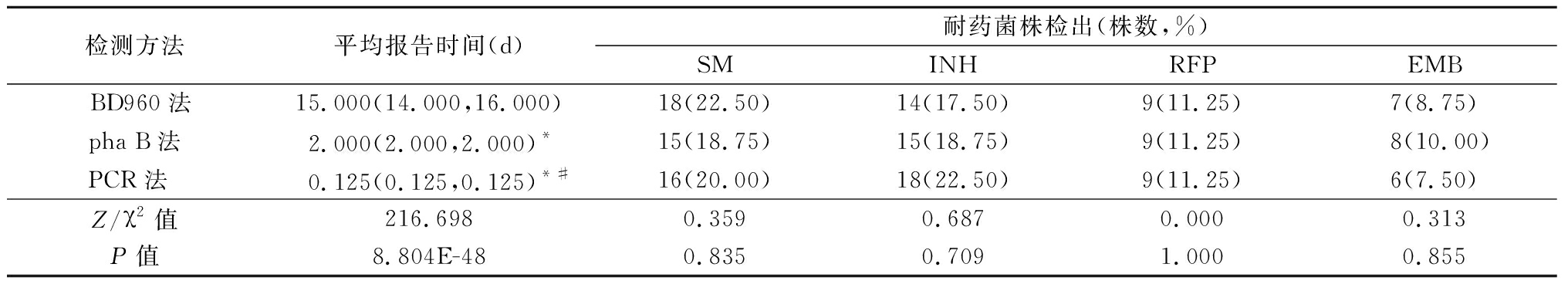
检测方法平均报告时间(d)耐药菌株检出(株数,%)SMINHRFPEMBBD960法15.000(14.000,16.000)18(22.50)14(17.50)9(11.25)7(8.75)pha B法2.000(2.000,2.000)*15(18.75)15(18.75)9(11.25)8(10.00)PCR法 0.125(0.125,0.125)*#16(20.00)18(22.50)9(11.25)6(7.50)Z/χ2值216.6980.3590.6870.0000.313P值8.804E-480.8350.7091.0000.855
*P值<0.05与BD960法比较 #P值<0.05与pha B法比较(秩和检验)
与BD960检测结果相比,pha B检测SM的敏感度、特异度和符合率分别为77.78%(14/18)、98.39%(61/62)和93.75%(75/80),检测INH的敏感度、特异度和符合率分别为85.71%(12/14)、95.45%(63/66)和93.75%(75/80),检测RFP的敏感度、特异度和符合率分别为88.89%(8/9)、98.59%(70/71)和97.50%(78/80),检测EMB的敏感度、特异度和符合率分别为71.43%(5/7)、95.77%(70/73)和93.59%(75/80),见表2。
表2 pha B与BD960检测结核分枝杆菌耐药性比较
Table 2 Comparison of pha B and BD960 drug sensitivity in detection of drug resistance of Mycobacterium tuberculosis (株数)
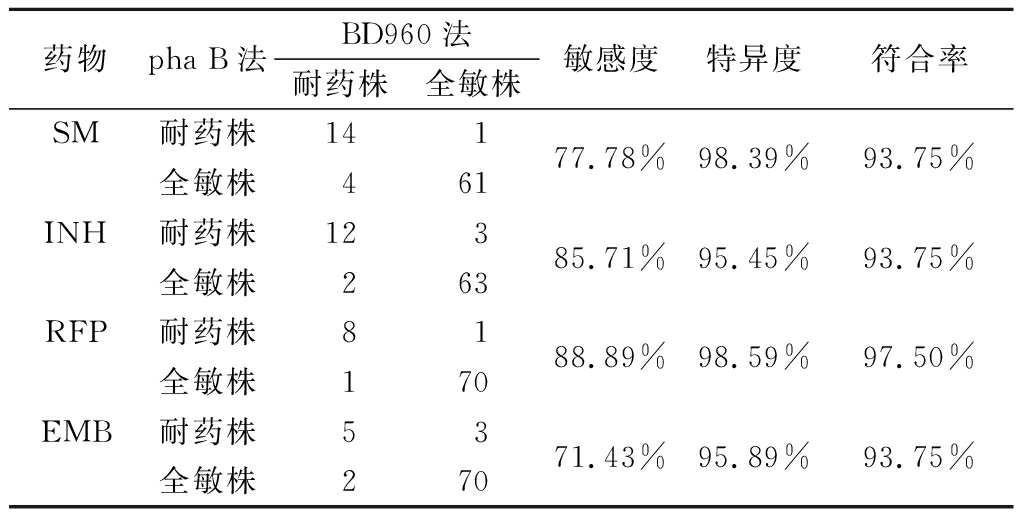
药物pha B法BD960法耐药株全敏株敏感度 特异度 符合率 SM耐药株全敏株14416177.78%98.39%93.75%INH耐药株全敏株12236385.71%95.45%93.75%RFP耐药株全敏株8117088.89%98.59%97.50%EMB耐药株全敏株5237071.43%95.89%93.75%
与BD960检测结果相比,PCR法检测SM的敏感度、特异度和符合率分别为72.22%(13/18)、95.16%(59/62)和90.00%(72/80),检测INH的敏感度、特异度和符合率分别为100.00%(14/14)、93.94%(62/66)和95.00%(76/80),检测RFP的敏感度、特异度和符合率分别为88.89%(8/9)、98.59%(70/71)和97.50%(78/80),检测EMB的敏感度、特异度和符合率分别为71.43%(5/7)、98.63%(72/73)和96.25%(77/80),见表3。
表3 PCR法与BD960药敏法检测结核分枝杆菌耐药性比较
Table 3 Comparison of PCR and BD960 drug sensitivity method for detection of drug resistance of Mycobacterium tuberculosis (株数)
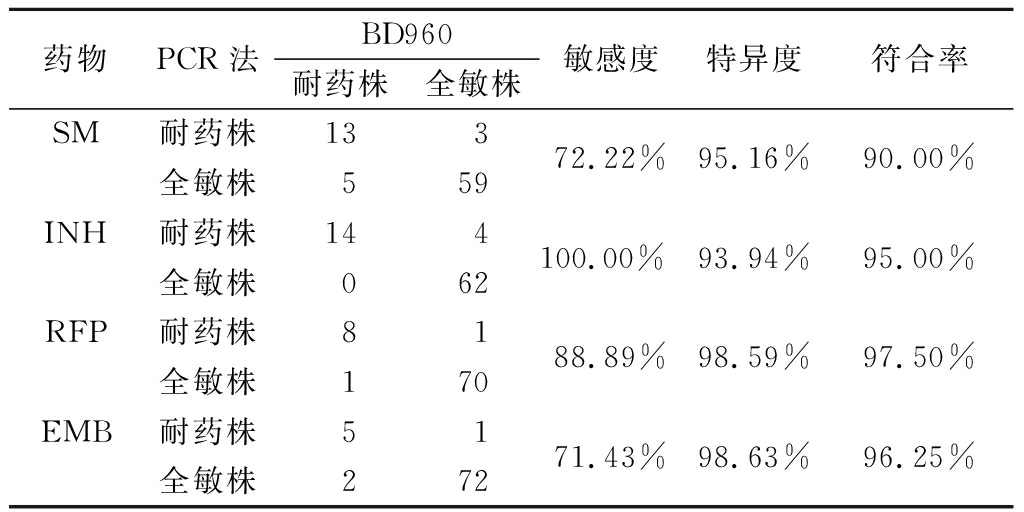
药物PCR法BD960耐药株全敏株敏感度 特异度 符合率 SM耐药株全敏株13535972.22%95.16%90.00%INH耐药株全敏株140462100.00%93.94%95.00%RFP耐药株全敏株8117088.89%98.59%97.50%EMB耐药株全敏株5217271.43%98.63%96.25%
进一步通过Kappa检验,分别分析pha B、PCR法与BD960检测结果的一致性,结果显示对于INH和RFP,pha B和PCR法与BD960检测结果均为高度一致,其他2种药物的耐药检测结果一致性也均能够满足临床要求,见表4。
表4 pha B、PCR法与BD960检测结果一致性分析
Table 4 Consistency analysis of drug resistance detection results by pha B,PCR with BD960
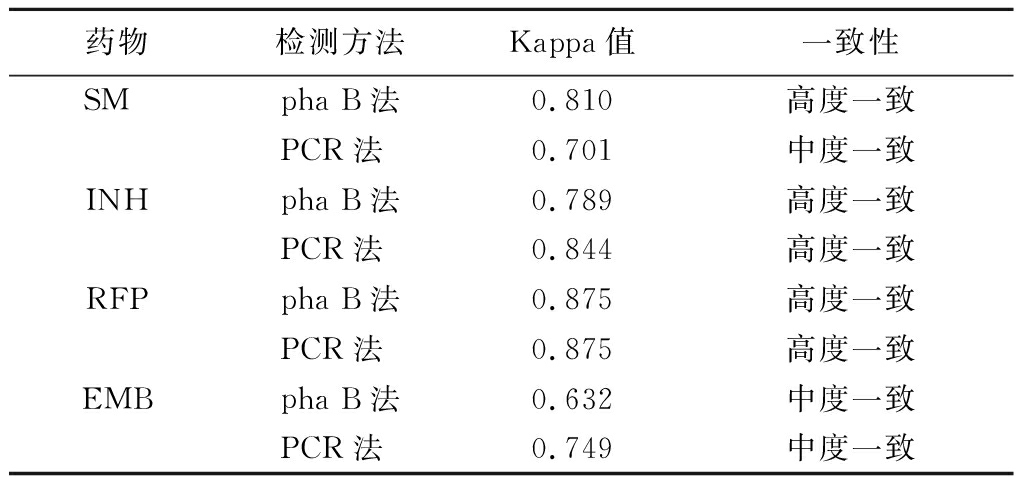
药物检测方法Kappa值一致性SM pha B法0.810高度一致PCR法 0.701中度一致INHpha B法0.789高度一致PCR法 0.844高度一致RFPpha B法0.875高度一致PCR法 0.875高度一致EMBpha B法0.632中度一致PCR法 0.749中度一致
3 讨 论
耐药性结核病的出现严重影响了全球结核病的防控[8],对此迫切需要更快速、更有效的检测与治疗措施予以应对。目前常用的结核分枝杆菌耐药情况分析的方法主要为传统罗氏药物敏感性试验、BD960、pha B和PCR法等。传统罗氏药物敏感性试验和BD960[9]利用结核分枝杆菌对抗结核药物的耐受情况进行分析,是目前监测结核分枝杆菌耐药情况的“金标准”,不足之处是培养周期较长,不能在短时间内报告结核患者感染结核分枝杆菌的耐药情况。
pha B是一种简便、快速且价廉的诊断结核病[10]及测定耐药性的新型表型技术。利用pha B对SM、环丙沙星、INH、吡嗪酰胺和EMB等抗结核药物进行药敏测定具有一定的实用性[11]。本研究用pha B对结核分枝杆菌临床分离株进行耐药情况检测,以BD960检测结果作为对照,对于SM、INH和RFP耐药检测结果均为高度一致,对EMB检测结果为中度一致,敏感度分别为77.78%、85.71%、88.89%和71.43%,特异度分别为98.39%、95.45%、98.59%和95.89%,符合率分别为93.75%、93.75%、97.50%和93.75%。在对常规抗结核一线药物耐药情况检出无差异且缩短检测时间的前提下,pha B能够简单、有效测定结核分枝杆菌的表型耐药性。
目前,分子生物学方法用于检测结核分枝杆菌核酸及耐药情况逐渐被广泛接受[12]。有研究显示,采用PCR法能快速筛查结核分枝杆菌临床分离株对一线抗结核药物的耐药情况,对RFP和INH的表型和基因型检测具有较高的一致性,而对EMB和SM的表型和基因型检测一致性一般[13-15]。本研究结果与其一致。胡春梅等[13]研究推断,耐多药结核分枝杆菌菌株对EMB和SM的表型耐药存在不稳定性;表型检测试验结果存在局限性;耐药突变检测只筛选核酸序列而非氨基酸序列,有可能不引起氨基酸改变的突变(沉默突变)而会被判为突变型;检测样品出现不均一耐药菌株,耐药菌株的比例偏低,而判定为敏感型;可能与异质性耐药或外源性再感染、新的耐药基因突变和外排泵机制、混合感染以及药敏试验结果误差等有关。总体而言,PCR法检测时间极大缩短,对4种一线抗结核药物的耐药突变情况能够进行有效检出。
目前高收入国家通常采用表型方法(基于培养的AST)以确认新结核病例的易感性,还用于检测具有危险因素的结核病例中的耐药性,并结合基因型检验。而在低收入国家,发现筛选已知赋予抗药性的热点突变的基因型方法更容易实施,因为其避免了培养和生物安全限制。鉴于基因型检测可以快速检测到突出的耐药机制,如RFP耐药的rpoB突变,面临着新的挑战,即观察假抗性(基因突变而未表现抗药性)和假易感性(突变不同于常见的)机制结果。本研究首次综合采用表型检测和分子生物学方法对结核分枝杆菌阳性的临床分离株进行4种一线抗结核药物的耐药突变情况检测,基于培养的BD960仍是临床诊断耐药性的金标准但培养周期过长,pha B操作简单但易受干扰,PCR法能够快速检测基因型突变但无法区分“死菌”与“活菌”,故采用3种方法同时对一线抗结核药物的耐药情况进行筛查,可以获得较高敏感度和特异度[16]。
[1] 程枫,杭亚平,熊国亮.耐多药结核分枝杆菌的研究进展[J].微生物学杂志,2018,38(1):123-128.
[2] 姚黎明,赵茜,贾晨光,等.脊柱结核术后复治原因的临床分析研究[J].河北医科大学学报,2016,37(3):260-263.
[3] 徐海亮,冯喜英,王玉清,等.肺结核患者多种相关免疫细胞因子的研究进展[J/CD].中华肺部疾病杂志:电子版,2017,10(2):220-222.
[4] 杨新宇,易俊莉,邢青,等.881例疑似耐多药肺结核患者的耐药性分析[J].中国防痨杂志,2018,40(2):183-188.
[5] 何茂锐,向明确,罗谊,等.应用噬菌体生物扩增法对HIV/TB双重感染患者抗结核药耐药性分析研究[J].重庆医学,2017,46(23):3219-3221,3225.
[6] Rezaei F,Haeili M,Fooladi AI,et al. High resolution melting curve analysis for rapid detection of streptomycin and ethambutol resistance in mycobacterium tuberculosis[J]. Maedica(Buchar),2017,12(4):246-257.
[7] 胡春梅,郭晶,严虹,等.荧光定量PCR探针熔解曲线法在结核分枝杆菌耐药基因检测中的应用[J].中国防痨杂志,2016,38(1):38-41.
[8] Maitre T,Aubry A,Jarlier V,et al. Multidrug and extensively drug-resistant tuberculosis [J]. Med Mal Infect,2017,47(1):3-10.
[9] 王浩,赵青,陈妹红.Sensititre(R)结核药敏板检测结核分枝杆菌药敏的方法学研究[J].河北医科大学学报,2016,37(2):187-190.
[10] 罗晶晶,于霞,马异峰,等.高强度荧光分枝杆菌噬菌体Φ2GFP10检测结核分枝杆菌对抗结核药物耐药性的价值[J].中华结核和呼吸杂志,2017,40(10):755-759.
[11] 陆伟桃.痰结核分枝杆菌噬菌体生物扩增法与痰结核菌脱氧核糖核酸联合检测对痰菌阴性肺结核诊断价值分析[J].中国医药科学,2018,8(17):130-133.
[12] 余丽,李海成,黎贞燕,等.结核菌及其耐药性不同检测方法的临床应用评价[J].广东医学,2017,38(2):190-193.
[13] 胡春梅,郭晶,严虹,等.荧光定量PCR探针熔解曲线法在结核分枝杆菌耐药基因检测中的应用[J].中国防痨杂志,2016,38(1):38-41.
[14] 常凤霞.PCR探针熔解曲线法在对肺结核患者进行结核分枝杆菌耐药基因检测中的应用效果[J].当代医药论丛,2018,16(19):171-172.
[15] 刘艳,古丽比克·木拉提,玛力亚木·阿布力提甫,等.荧光PCR熔解曲线法检测结核分枝杆菌耐药基因的结果分析[J].中国防痨杂志,2018,40(9):959-963.
[16] Schön T,Miotto P,Koeser CU,et al. Mycobacterium tuberculosis drug-resistance testing:challenges,recent developments and perspectives[J]. Clin Microbiol Infect,2017,23(3):154-160.