血流感染可引起严重的全身感染性疾病[1]。血培养是临床判断患者血流感染的最重要依据,对血培养分离菌的分布统计可以反映临床医护人员采集血培养标本的操作是否规范,培训是否到位。动态监测血培养分离菌的耐药谱对指导临床合理选择抗菌药物具有重要意义。本研究回顾性分析河北省细菌耐药监测网2016—2017年三级医院血培养分离菌的检出、药敏结果,旨在为临床诊疗提供依据,报告如下。
1 资料与方法
1.1 资料来源 收集2016年1月1日—2017年12月31日河北省细菌耐药监测网40家三级医院报送的血培养分离细菌及其药敏试验数据。根据年龄将分离自不同患者的菌株进行分组对比分析,儿童组定义为≤14岁,15~64岁定义为成年组,≥65岁定义为老年组。删除分离自同一患者的重复菌株,只分析其第1株分离菌药敏数据。
1.2 细菌鉴定 使用VITEK 2系统、Phoenix100系统或手工等专业的临床细菌鉴定方法。
1.3 药敏试验 采用自动化仪器法或纸片扩散法进行细菌药敏试验,依据美国临床和实验室标准协会 2016年版标准判定药敏试验结果。
2 结 果
2.1 菌株分布 2016—2017年血培养标本共分离细菌17 815株,其中儿童组2 261株,成年组11 261株,老年组4 293株。革兰阴性菌9 627株(54.1%),革兰阳性菌8 188株(45.9%),凝固酶阴性葡萄球菌位于分离菌首位,其次为大肠埃希菌,菌种分布见表1。
表1 血培养主要分离菌种分布
Table 1 Distribution of the microorganisms isolated from blood specimens
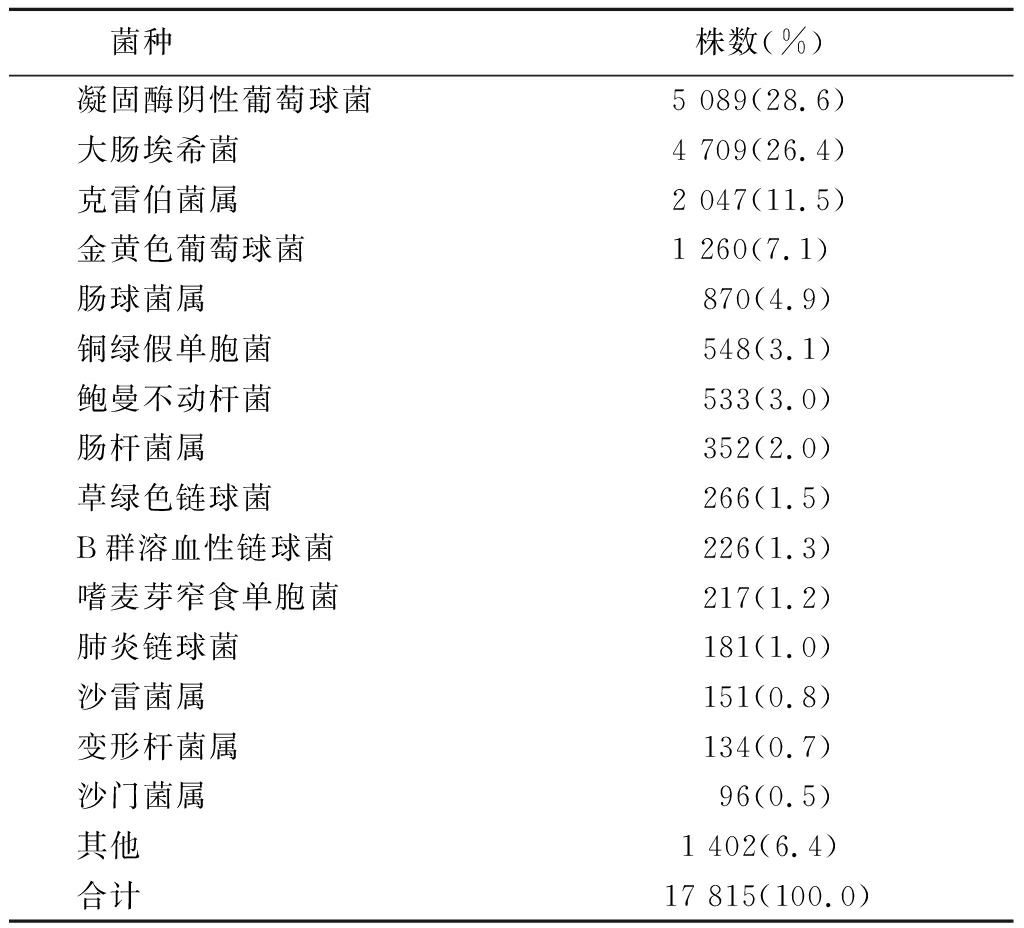
菌种株数(%)凝固酶阴性葡萄球菌5 089(28.6)大肠埃希菌4 709(26.4)克雷伯菌属2 047(11.5)金黄色葡萄球菌1 260(7.1) 肠球菌属870(4.9)铜绿假单胞菌548(3.1)鲍曼不动杆菌533(3.0)肠杆菌属352(2.0)草绿色链球菌266(1.5)B群溶血性链球菌226(1.3)嗜麦芽窄食单胞菌217(1.2)肺炎链球菌181(1.0)沙雷菌属151(0.8)变形杆菌属134(0.7)沙门菌属 96(0.5)其他1 402(6.4)合计17 815(100.0)
2.2 葡萄球菌属的耐药谱型 耐甲氧西林金黄色葡萄球菌(methicillin-resistant staphylococcus aureus,MRSA)检出率为46.3%,耐甲氧西林凝固酶阴性葡萄球菌(methicilin-resistant coagulase-negative staphylococcus,MRCNS)检出率为80.0%。在葡萄球菌属中没有发现利奈唑胺、万古霉素和替考拉宁耐药的菌株。MRSA、甲氧西林敏感金黄色葡萄球菌(methicillin-susceptible staphylococcus aureus,MSSA)、MRCNS、甲氧西林敏感凝固酶阴性葡萄球菌(methicillin-susceptible coagulase-negative staphylococcus,MSCNS) 对不同抗菌药物的耐药率和敏感率见表2。
表2 葡萄球菌属对抗菌药物的耐药谱型
Table 2 Susceptibility of Staphylococcus to antimicrobial agents (%)
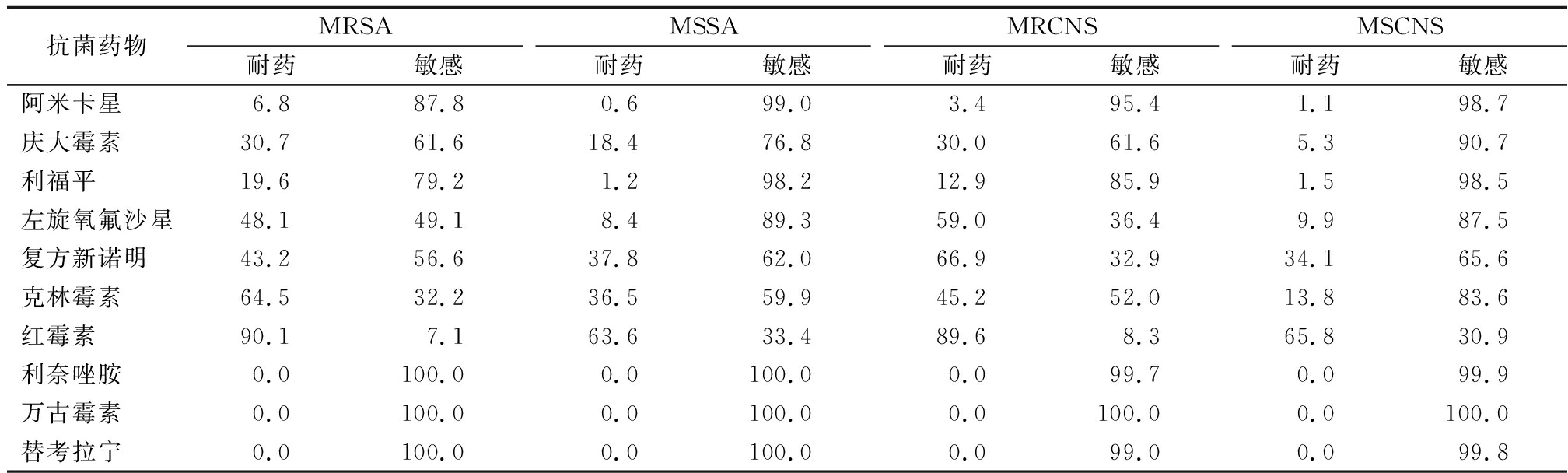
抗菌药物MRSA耐药敏感MSSA耐药敏感MRCNS耐药敏感MSCNS耐药敏感阿米卡星6.887.80.699.03.495.41.198.7庆大霉素30.761.618.476.830.061.65.390.7利福平19.679.21.298.212.985.91.598.5左旋氧氟沙星48.149.18.489.359.036.49.987.5复方新诺明43.256.637.862.066.932.934.165.6克林霉素64.532.236.559.945.252.013.883.6红霉素90.17.163.633.489.68.365.830.9利奈唑胺0.0100.00.0100.00.099.70.099.9万古霉素0.0100.00.0100.00.0100.00.0100.0替考拉宁0.0100.00.0100.00.099.00.099.8
2.3 肠球菌属 粪肠球菌和屎肠球菌对氨苄西林的耐药率分别为15.8%和86.1%;粪肠球菌对左旋氧氟沙星和莫西沙星的耐药率分别为27.3%和23.8%,而屎肠球菌对左旋氧氟沙星和莫西沙星的耐药率分别为77.5%和88.7%;粪肠球菌对利奈唑胺、万古霉素和替考拉宁的耐药率分别为1.1%、0.0%和0.6%,屎肠球菌对利奈唑胺、万古霉素和替考拉宁耐药率分别为0.4%、1.4%和1.9%。见表3。
2.4 肺炎链球菌耐药性 肺炎链球菌对青霉素耐药检出率为5.4%(依据注射用青霉素非脑膜炎折点),对头孢曲松和头孢噻肟(非脑膜炎折点)的耐药率分别为6.4%、6.9%,对红霉素、克林霉素的耐药率高达96.0%和91.6%,见表4。
表3 肠球菌属对抗菌药物的耐药谱型
Table 3 Susceptibility of Enterococcusto antimicrobial agents (%)
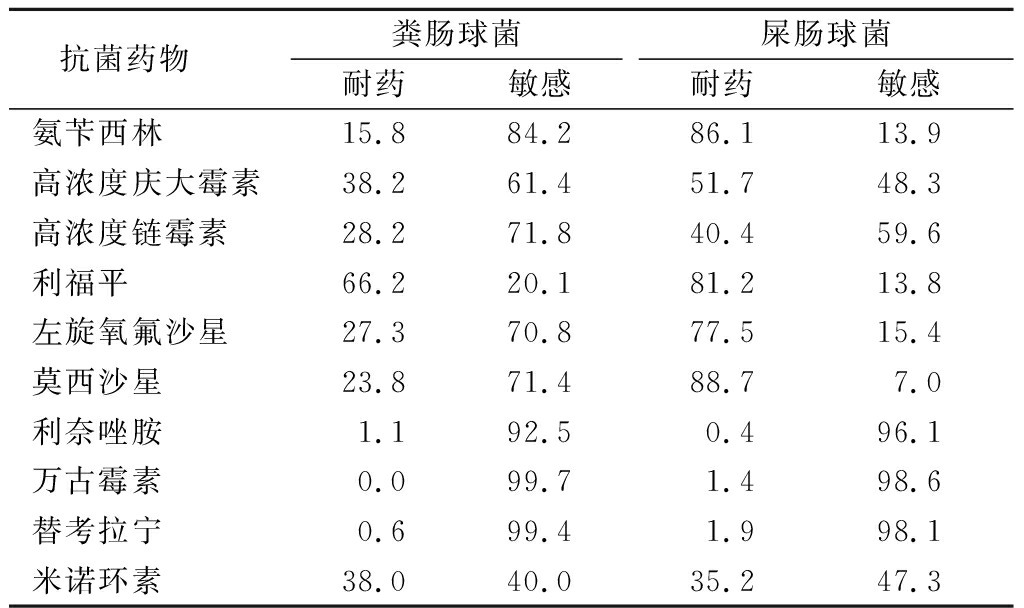
抗菌药物粪肠球菌耐药敏感屎肠球菌耐药敏感氨苄西林15.884.286.113.9高浓度庆大霉素38.261.451.748.3高浓度链霉素28.271.840.459.6利福平66.220.181.213.8左旋氧氟沙星27.370.877.515.4莫西沙星23.871.488.77.0利奈唑胺1.192.50.496.1万古霉素0.099.71.498.6替考拉宁0.699.41.998.1米诺环素38.040.035.247.3
表4 肺炎链球菌对抗菌药物的耐药谱型
Table 4 Susceptibility of main S.penumonia to antimicrobial agents (%)
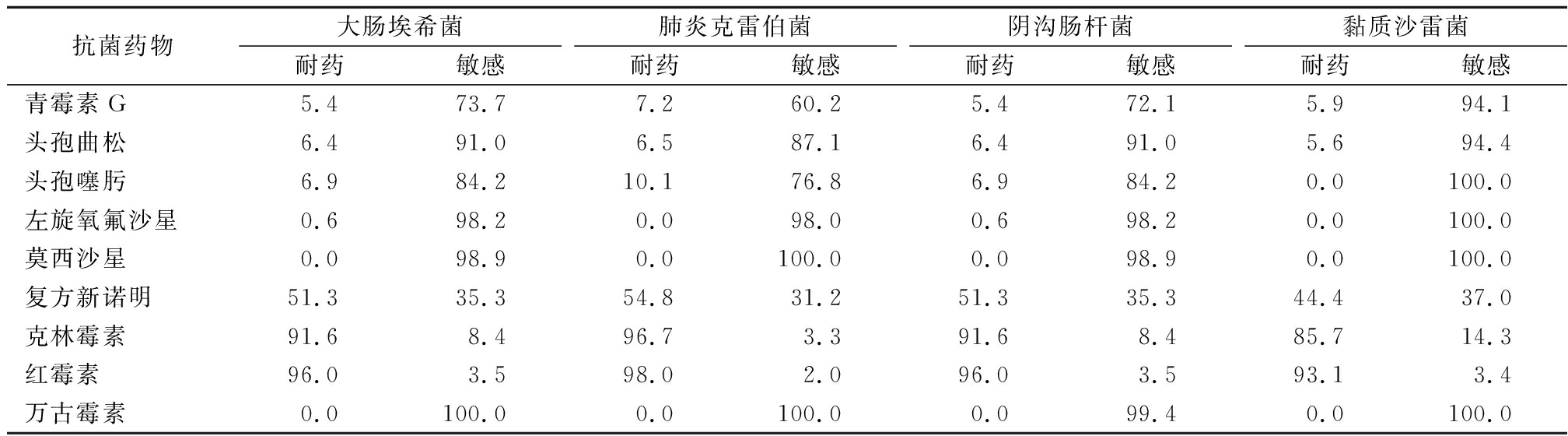
抗菌药物大肠埃希菌耐药敏感肺炎克雷伯菌耐药敏感阴沟肠杆菌耐药敏感黏质沙雷菌耐药敏感青霉素G5.473.77.260.25.472.15.994.1头孢曲松6.491.06.587.16.491.05.694.4头孢噻肟6.984.210.176.86.984.20.0100.0左旋氧氟沙星0.698.20.098.00.698.20.0100.0莫西沙星0.098.90.0100.00.098.90.0100.0复方新诺明51.335.354.831.251.335.344.437.0克林霉素91.68.496.73.391.68.485.714.3红霉素96.03.598.02.096.03.593.13.4万古霉素0.0100.00.0100.00.099.40.0100.0
2.5 肠杆菌科细菌 大肠埃希菌超广谱β-内酰胺酶(extended spectrum beta-lactamases,ESBL)的分离率为65.4%,对头孢吡肟和头孢他啶的耐药率为33%和27.7%,对头孢西丁的耐药率为8.9%,对美罗培南和亚胺培南的耐药率为1.6%和1.8%;肺炎克雷伯菌ESBL的分离率为43.8%,对美罗培南和亚胺培南的耐药率均为15.7%;阴沟肠杆菌对美罗培南和亚胺培南的耐药率为5.7%和5.9%;黏质沙雷菌对美罗培南和亚胺培南的耐药率分别为7.5%和7.4%。见表5。
表5 主要肠杆菌属细菌对抗菌药物的耐药谱型
Table 5 Susceptibility of main Enterobacter spp. to antimicrobial agents (%)
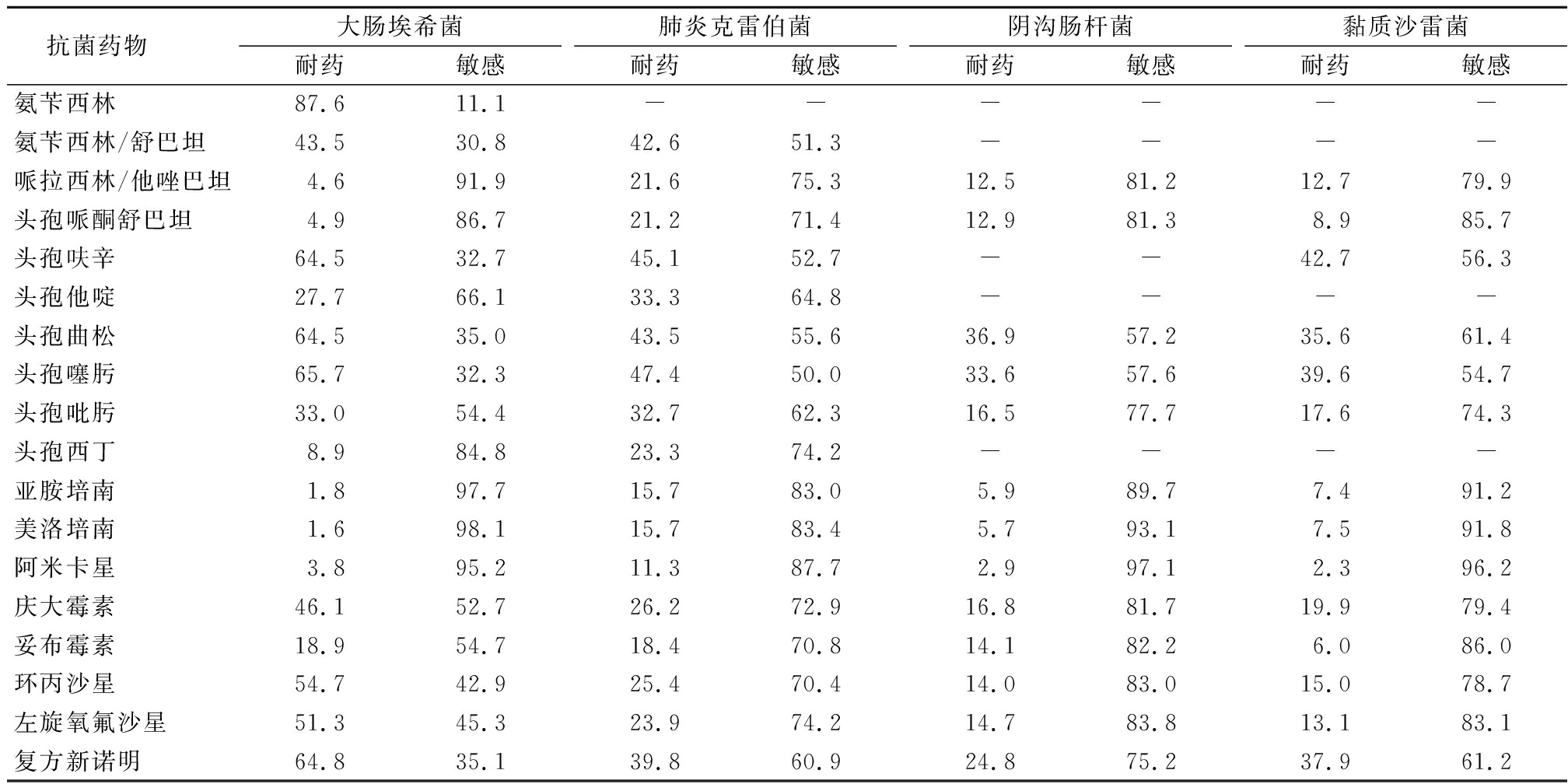
抗菌药物 大肠埃希菌耐药敏感肺炎克雷伯菌耐药敏感阴沟肠杆菌耐药敏感黏质沙雷菌耐药敏感氨苄西林87.611.1------氨苄西林/舒巴坦43.530.842.651.3----哌拉西林/他唑巴坦4.691.921.675.312.581.212.779.9头孢哌酮舒巴坦4.986.721.271.412.981.38.985.7头孢呋辛64.532.745.152.7--42.756.3头孢他啶27.766.133.364.8----头孢曲松64.535.043.555.636.957.235.661.4头孢噻肟65.732.347.450.033.657.639.654.7头孢吡肟33.054.432.762.316.577.717.674.3头孢西丁8.984.823.374.2----亚胺培南1.897.715.783.05.989.77.491.2美洛培南1.698.115.783.45.793.17.591.8阿米卡星3.895.211.387.72.997.12.396.2庆大霉素46.152.726.272.916.881.719.979.4妥布霉素18.954.718.470.814.182.26.086.0环丙沙星54.742.925.470.414.083.015.078.7左旋氧氟沙星51.345.323.974.214.783.813.183.1复方新诺明64.835.139.860.924.875.237.961.2
2.6 不发酵糖革兰阴性杆菌 铜绿假单胞菌对所测抗菌药物的耐药率均低于30.0%,对亚胺培南和美罗培南的耐药率分别为18.0%和14.3%;鲍曼不动杆菌对头孢哌酮/舒巴坦的耐药率为19.3%,对米诺环素的耐药率为19.3%,对亚胺培南和美罗培南的耐药率高达60.9%和53.8%;嗜麦芽窄食单胞菌对米诺环素的耐药率为0.0%,对复方新诺明耐药率为25.8%,对左旋氧氟沙星耐药率为3.7%。见表6。
表6 不发酵糖革兰阴性杆菌对抗菌药物的耐药谱型
Table 6 Susceptibility of the non-fermentative Gram-negative bacilli to antimicrobial agents (%)
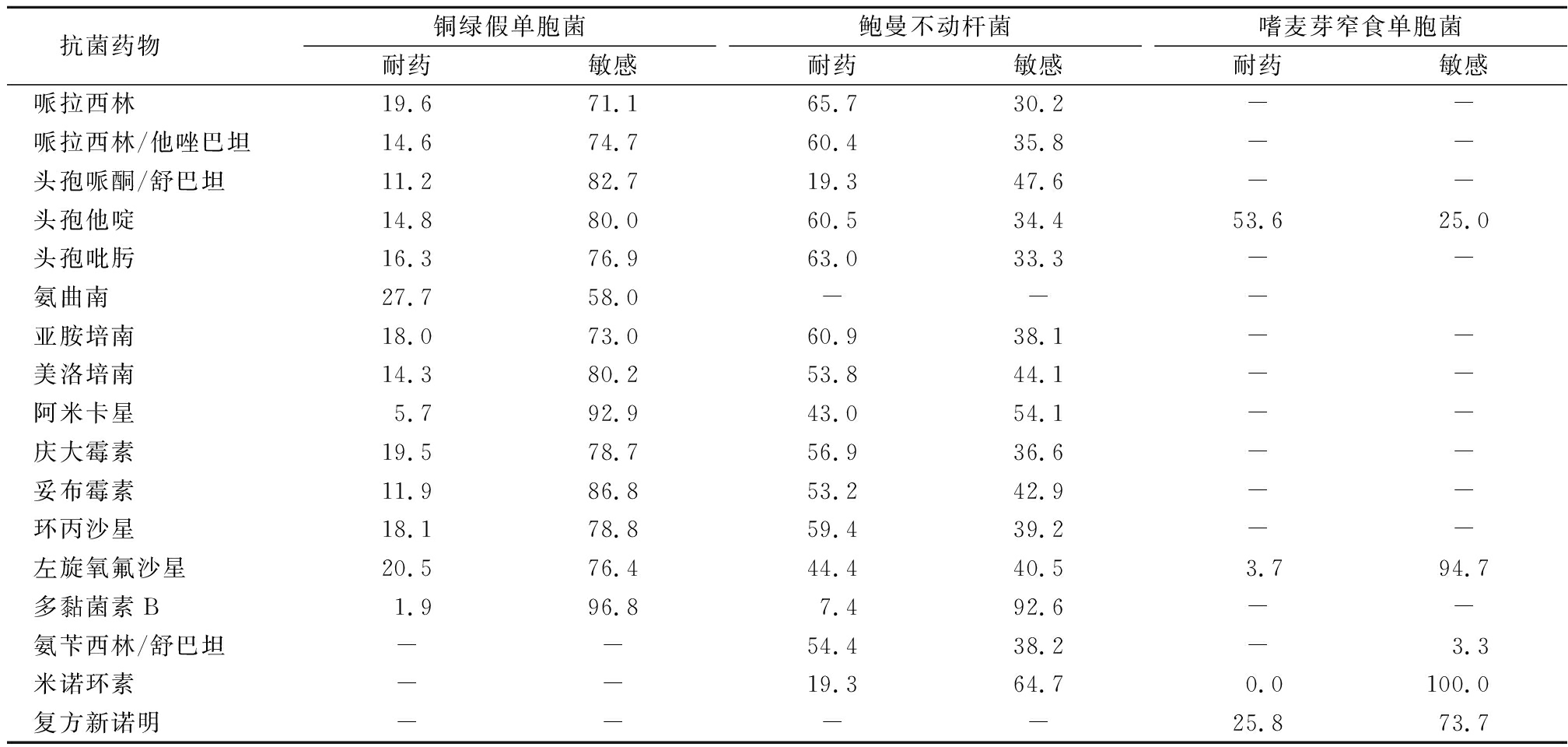
抗菌药物铜绿假单胞菌耐药敏感鲍曼不动杆菌耐药敏感嗜麦芽窄食单胞菌耐药敏感哌拉西林19.671.165.730.2--哌拉西林/他唑巴坦14.674.760.435.8--头孢哌酮/舒巴坦11.282.719.347.6--头孢他啶14.880.060.534.453.625.0头孢吡肟16.376.963.033.3--氨曲南27.758.0---亚胺培南18.073.060.938.1--美洛培南14.380.253.844.1--阿米卡星5.792.943.054.1--庆大霉素19.578.756.936.6--妥布霉素11.986.853.242.9--环丙沙星18.178.859.439.2--左旋氧氟沙星20.576.444.440.53.794.7多黏菌素B1.996.87.492.6--氨苄西林/舒巴坦--54.438.2-3.3米诺环素--19.364.70.0100.0复方新诺明----25.873.7
3 讨 论
2016—2017年河北省细菌耐药监测网三级单位血培养中共分离细菌17 815株,其中凝固酶阴性葡萄球菌的分离率为28.6%,位居第一,其次是大肠埃希菌和克雷伯菌属。血培养检出凝固酶阴性葡萄球菌时,需要具体分析是真实的致病菌,还是操作污染。建议临床可根据患者是否具有典型的血流感染症状、血培养结果阳性≥2 次(份)且分离菌及药敏谱相同、培养报警时间<48 h、是否具有血管内人工装置等因素综合判断其致病性[2]。通过调研发现监测网内各单位的血培养标本采集操作仍存在不到位的情况。一些单位皮肤消毒仍然使用2%的碘伏,对护士的培训不到位。没有明确血培养采血操作和普通抽血的区别,消毒时间不到位。无论是否怀疑导管相关性血流感染,均从导管直接留取血培养。因此,耐药监测网各成员单位医院要加强皮肤消毒的管理,通过不断培训,提高护士采集血培养标本的意识,降低血培养污染。
本研究MRSA检出率为46.3%,与中国细菌耐药监测网监测数据统计结果相似[3];粪肠球菌和屎肠球菌对替考拉宁耐药率分别为0.6%和1.9%,对万古霉素耐药率分别为0.0%和1.4%,而对利奈唑胺耐药率却分别为1.1%和0.4%,粪肠球菌对利奈唑胺的耐药率高于屎肠球菌,与李光辉等[3]报道的血培养中肠球菌的耐药情况相似。目前明确的肠球菌对利奈唑胺的耐药机制主要有4种:23S rRNA基因突变、核糖体蛋白L3与L4氨基酸突变、cfr介导的多重耐药和optrA基因介导的耐药[4]。然而,有报道认为粪肠球菌耐利奈唑胺的机制比屎肠球菌更加复杂,可能是生物膜起了重要的作用[5-6]。本研究利奈唑胺耐药的粪肠球菌检出率高于屎肠球菌,具体耐药机制不详,有待收集菌株进行耐药机制探讨。此外,本研究发现屎肠球菌和粪肠球菌对替考拉宁的耐药率均高于万古霉素,这与其他文献报道不同[7-8]。导致这一结果的原因,笔者将对相关菌株的耐药数据进行复核后再进行具体分析。细菌耐药数据统计分析对于发现不常见的耐药规律或机制具有重要意义。
本研究结果显示,2016—2017年肺炎克雷伯菌ESBL的分离率为43.8%,大肠埃希菌为65.4%。肺炎克雷伯菌对碳青霉烯类抗生素的耐药率远高于其他肠杆菌科细菌,成为当前最重要的耐药菌,应引起广泛关注。胡付品[9]总结了2005—2014年肺炎克雷伯菌中碳青霉烯类耐药株由2.4%上升至13.4%。2015—2016年河北医科大学第二医院监测结果显示,2015年肺炎克雷伯菌对亚胺培南耐药率为19.3%,2016年达到24.2%,肺炎克雷伯菌对美罗培南耐药率2015年为18.5%,2016年上升到23.1%[10]。由于产碳青霉烯酶肺炎克雷伯菌引起的血流感染病死率较高,早期确认碳青霉烯酶的类型具有重要意义[11-12]。本课题组前期研究表明,碳青霉烯类耐药肺炎克雷伯菌中碳青霉烯酶基因检测以KPC-2为主,占70%,其次为NDM-1,还有IMP-4。与有关报道相似[13-15]。目前对于碳青霉烯类耐药的肺炎克雷伯菌的治疗,仍然主张如果碳青霉烯类MIC<8 mg/L,可以联合替加环素,对于产金属酶的菌株可以联合使用氨曲南,对于酶抑制剂敏感的菌株可以选择复合制剂。对具有不同耐药机制的感染菌株应采用不同的治疗方案,故建议微生物实验室采用多种方法进行耐药性的检测以满足临床的需要,必要时检测耐药基因。
本研究鲍曼不动杆菌美罗培南和亚胺培南的耐药率高达53.8%和60.9%,对头孢哌酮/舒巴坦和米诺环素的耐药率均为19.3%。山东省细菌耐药监测网统计结果显示,血培养分离鲍曼不动杆菌对美罗培南和亚胺培南的耐药率为46.8%和45.9%[7]。鲍曼不动杆菌相关感染多有易感因素,如严重基础疾病、抵抗力低下、高龄、抗生素使用史等,近年来耐药性升高严重。鲍曼不动杆菌对碳青霉烯类抗生素的耐药性已经成为威胁人类的最受关注的问题之一。因为其耐药机制复杂、抗生素选择局限、临床定植率高等特点,使得其引起的感染在临床上常难以控制[16]。而且这类细菌一旦进入血液,将导致全身播散性感染,使治疗更加困难,临床上可选择的药物非常有限,多黏菌素虽然耐药率低,但其价格昂贵,不良反应大,尤其对老年人和儿童的应用更加局限。
综上所述,河北省血培养检出菌的耐药情况仍比较严重。由于血流感染,尤其是碳青霉烯类耐药肺炎克雷伯菌和鲍曼不动杆菌引起的血流感染病死率高,故临床微生物人员应该提高警惕。动态监测本地区血培养病原菌构成及其耐药情况,可为指导临床合理应用抗菌药物、降低血流感染病死率提供数据依据。
[1] 刘永芳,陈金文,周凤,等.血流感染病原菌构成及其多重耐药性分析[J].中国抗生素杂志,2017,42(12):1056-1060.
[2] 张保华,江燕,潘泓,等.血培养分离菌的菌种分布及耐药性变迁[J].国际检验医学杂志,2018,39(12):1516-1519.
[3] 李光辉,朱德妹,汪复,等.2012年中国C H IN E T血培养临床分离菌的分布及耐药性[J].中国感染与化疗杂志,2014,14(6):474-481.
[4] Gawryszewska I,Zabicka D,Hryniewicz W,et al. Linezolid-resistantenterococci in Polishhospitals:species,clonality and determinants oflinezolid resistance[J]. Eur J Clin Micrubiol Infect Dis,2017,36(7):1279-1286.
[5] Tian Y,Li T,Zhu Y,et al. Mechanisms of linezolid resistance in staphylococci and enterococci isolated from two teaching hospital in Shanghai,China[J]. BMC Microbiol,2014,14:292.
[6] 刘畅,孙宏莉.利奈唑胺耐药肠球菌流行病学及耐药机制研究进展[J].临床检验杂志,2018,36(1):40-42.
[7] 王翠翠,张静,金炎,等.2013-2014年山东省细菌耐药监测网血液标本细菌分布及耐药性分析[J].中国感染与化疗杂志,2016,16(6):706-715.
[8] 胡付品,朱德妹,汪复,等.2013年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志,2014,14(5):365-374.
[9] 胡付品.2005-2014年CHINET中国细菌耐药性监测网5种重要临床分离菌的耐药性变迁[J].中国感染与化疗杂志,2017,17(1):93-99.
[10] 李继红,时东彦,李媛媛,等.2015-2017年耐碳青霉烯类肺炎克雷伯菌耐药监测及流行特征[J].中国抗生素杂志,2018,43(5):572-576.
[11] 瞿金龙,王虑,赵良,等.产碳青霉烯酶肺炎克雷伯菌血流感染患者的临床分析[J].中华医院感染学杂志,2016,26(21):4817-4819.
[12] 刘萍.产碳青霉烯酶肠杆菌科细菌的研究进展及治疗策略[J].检验医学,2016,31(7):618-622.
[13] 杨靖,时东彦,赵建宏,等.不同底物在CIM试验检测革兰阴性杆菌碳青霉烯酶中的应用评价[J].临床检验杂志,2016,34(8):575-578.
[14] Hu F,Chen S,Xu X,et al. Emergence of carbapenem-resistant clinical Enterobacteriaceae isolates from a teaching hospital in Shanghai,China[J]. J Med Microbiol,2012,61(Pt 1):132-136.
[15] Chen S,Hu F,Xu X,et al. High prevalence of KPC-2-Type carbapenemase coupled with CTX-M-Type extended-spectrum β-lactamases in carbapenem-resistant klebsiella pneumoniae in a teaching hospital in China[J]. Antimicrob Agents Chemother,2011,55(5):2493-2494.
[16] 刘秋萍,徐凌.鲍曼不动杆菌耐药机制的研究进展[J].中国抗生素杂志,2018,43(10):1179-1187.