抗血小板药物是一类常见的用于治疗心血管疾病的药物,尤其在急性心肌梗死、冠状动脉粥样硬化性心脏病中,肠溶阿司匹林、氯吡格雷为代表的抗血小板聚集药物应用十分广泛[1]。老龄化的加剧使低剂量的阿司匹林成为了我国老年人常用的处方。报道显示近60%的人每周至少服用1次阿司匹林[2]。在美国,10%~20%的65岁以上的人使用抗血小板药物,而中国人中的使用水平与其类似,阿司匹林在治疗心脑血管疾病的一级和二级预防中发挥了重要作用[3-4]。尽管抗血小板药物取得了较好的疗效,但其会引起患者出现不同程度的药物不良反应,最为严重的是上消化道出血。胃肠道出血是阿司匹林的一种严重不良反应,小剂量阿司匹林促发胃肠黏膜损伤,导致糜烂、溃疡甚至出血时有发生。本研究分析抗血小板药物致上消化道出血的影响因素,旨在为消化道出血预防及心血管疾病的合理治疗提供参考,报告如下。
1 资料与方法
1.1 一般资料 选取2016年1月—2018年6月我院服用抗血小板药物阿司匹林导致上消化道出血的住院患者85例作为观察组,其中男性 56例,女性29例,年龄35~82岁,平均(62.11±7.88)岁。选取同期服用抗血小板药物未出现上消化道出血的患者98例作为对照组,其中男性66例,女性32例,年龄35~85岁,平均(62.45±7.26)岁。2组年龄、性别差异均无统计学意义(P>0.05)。所选患者自愿参与本研究,均签署知情同意书,观察组服用的抗血小板药物与对照组一致。上消化道出血诊断标准:符合中华内科杂志等制定的急性非静脉曲张性上消化道出血诊断标准[5],患者入院前均出现呕血、柏油样便、血便或便潜血试验阳性等症状。排除标准:①信息不完整者;②严重肝、肾功能不全者;③合并严重感染、恶性肿瘤及血液系统疾病者。
1.2 研究方法 收集2组一般情况及临床资料:一般资料包括患者性别、年龄、疾病史、吸烟史、饮酒史、使用抗血小板聚集药物的时间等;临床资料包括患者的幽门螺杆菌(Hpylori,Hp)感染、临床检查(血常规、内镜检查)结果等。通过13C呼气试验检测Hp阳性率,使用13C尿素呼气试验诊断试剂盒进行检测,DOB≥4.0即为阳性;应用全自动生化分析仪测定血清总胆固醇(total cholesterol ,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、C反应蛋白(C-reactive protein,CRP)及肌酐(creatinine,Cr);胃镜检查受检者术前均禁食 12 h,予以常规胃镜检查,对异常病变组织进行活检。对上述数据进行统计学分析,进而得出抗血小板聚集药物对上消化道出血的影响。
1.3 统计学方法 应用SPSS 21.0统计软件分析数据。计量资料比较采用两独立样本的t检验;计数资料比较采用χ2检验;危险因素确定采用多元Logistic回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1 2组一般资料比较 观察组与对照组性别、年龄、高血压病史、糖尿病病史差异均无统计学意义(P>0.05);而2组服药病程、消化道病史、吸烟史和饮酒史差异均有统计学意义(P<0.05)。见表1。
表1 2组一般资料比较
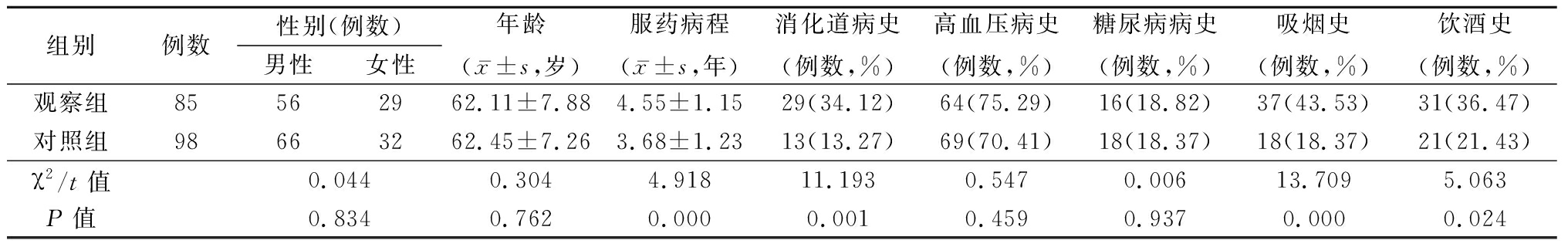
组别例数性别(例数)男性女性年龄(x-±s,岁)服药病程(x-±s,年)消化道病史(例数,%)高血压病史(例数,%)糖尿病病史(例数,%)吸烟史(例数,%)饮酒史(例数,%)观察组85562962.11±7.884.55±1.1529(34.12)64(75.29)16(18.82)37(43.53)31(36.47)对照组98663262.45±7.263.68±1.2313(13.27)69(70.41)18(18.37)18(18.37)21(21.43)χ2/t值0.0440.3044.91811.1930.5470.00613.7095.063P值0.8340.7620.0000.0010.4590.9370.0000.024
2.2 2组生化指标比较 2组TC、TG、LDL-C差异均无统计学意义(P>0.05);观察组CRP、Cr高于对照组,差异有统计学意义(P<0.05)。见表2。
表2 2组临床生化指标比较
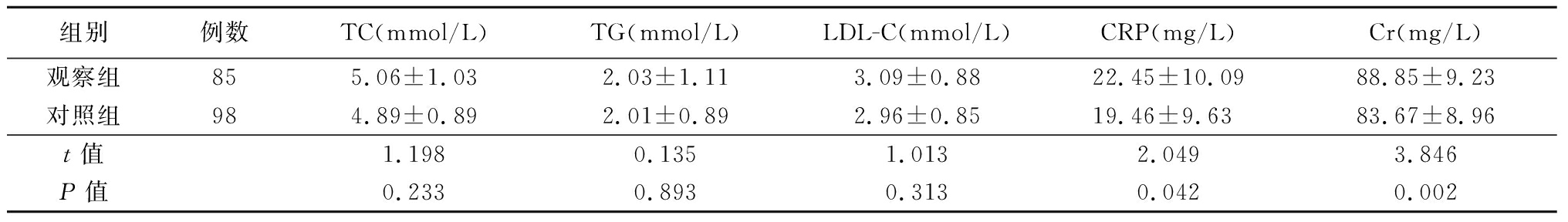
组别例数TC(mmol/L)TG(mmol/L)LDL-C(mmol/L)CRP(mg/L)Cr(mg/L)观察组855.06±1.032.03±1.113.09±0.8822.45±10.0988.85±9.23对照组984.89±0.892.01±0.892.96±0.8519.46±9.6383.67±8.96t值1.1980.1351.0132.0493.846P值0.2330.8930.3130.0420.002
2.3 2组内镜检查及Hp感染情况比较 观察组胃溃疡和胃黏膜病变检出率及Hp感染率均高于对照组,差异有统计学意义(P<0.05),见表3。
2.4 上消化道出血的多因素Logistic回归分析 以是否发生上消化道出血为因变量,以吸烟史、饮酒史、消化道病史及有无Hp感染作为自变量进行Logistic回归分析,结果显示吸烟史、饮酒史、消化道病史及存在Hp感染为上消化道出血的危险因素(P<0.05),见表4,5。
表3 2组内镜检查及Hp感染情况比较 (例数,%)
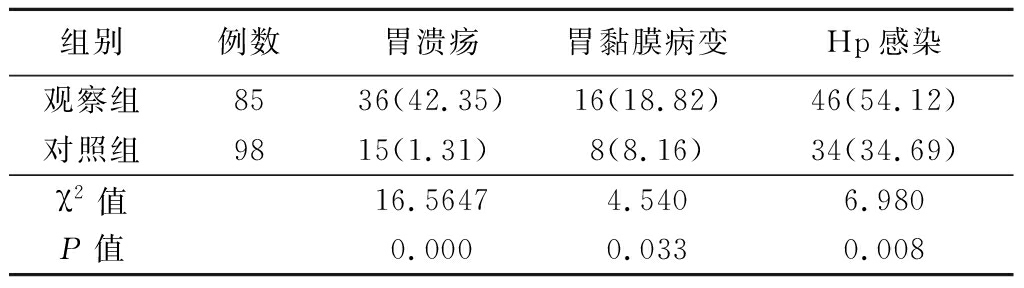
组别例数胃溃疡胃黏膜病变Hp感染观察组8536(42.35)16(18.82)46(54.12)对照组9815(1.31) 8(8.16)34(34.69)χ2值16.56474.5406.980P值0.0000.0330.008
表4 Logistic回归分析变量赋值

变量名定义变量名赋值说明上消化道出血Y 是=0,否=1吸烟史 X1有=0,无=1饮酒史 X2有=0,无=1消化疾病史 X3有=0,无=1Hp感染 X4有=0,无=1
表5 上消化道出血相关因素的Logistic回归分析
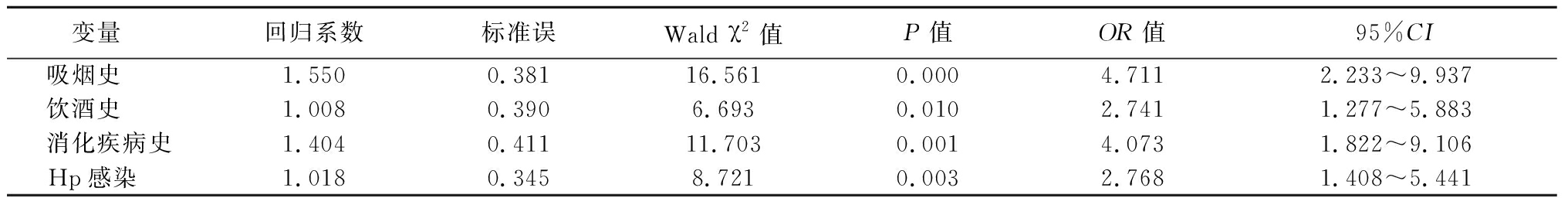
变量 回归系数标准误Wald χ2值P值OR值95%CI吸烟史 1.5500.38116.5610.0004.7112.233~9.937饮酒史 1.0080.3906.6930.0102.7411.277~5.883消化疾病史1.4040.41111.7030.0014.0731.822~9.106Hp感染 1.0180.3458.7210.0032.7681.408~5.441
3 讨 论
以阿司匹林、氯吡格雷为主的抗血小板药物是治疗心脑血管血栓性疾病的重要治疗方案。出血和不良心血管事件是抗血小板治疗的主要并发症[6]。非静脉曲张性上消化道出血是发生在食管、胃或十二指肠近端的出血。其发生最常见的原因包括Hp感染以及使用非甾体抗炎药和低剂量阿司匹林。近20年来,上消化道出血的预防和管理取得了很大的进展,发病率逐渐下降,但其仍是一个常见的临床问题。每年全世界发病率为(40~150)/10万人,病死率在1%~5%[7]。国内尚无大规模流行病学调查资料,但有数据显示急性非静脉曲张性上消化道出血发病率为(19.4~57.0)/10万人,病死率为8.6%[8]。在美国和欧洲,40%~66%的75岁以上老人每天均在服用阿司匹林或其他抗血小板药物,抗血小板药物的使用增加了胃肠道出血的风险[9-10]。抗血小板药物引起上消化道出血可能机制为:对血栓素A2介导的血小板凝集抑制作用,诱发胃黏膜出血;对前列腺素E2和前列腺素I2介导的胃黏膜保护作用的破坏,前列腺素可增加胃黏膜血流量,促进上皮细胞增生,对胃黏膜进行保护。
最近的一项对1 008例因胃肠道出血住院的患者病例对照研究提示,使用非甾体抗炎药、低剂量阿司匹林、其他抗血小板药物和抗凝剂治疗,均增加了上消化道出血的风险[11]。如既往有胃肠道出血、消化性溃疡出血、未经治疗的Hp感染,酒精更增加了出血的风险[12-13]。抗血小板药物消化道损伤中国专家共识也指出:高龄、消化道溃疡或出血病史、合并Hp感染、联合抗血小板治疗或抗凝治疗等是消化道出血的高危因素。本研究结果显示,吸烟史、饮酒史、消化道病史及存在Hp感染为上消化道出血的危险因素。
本研究观察组与对照组性别、年龄、高血压病史、糖尿病病史差异均无统计学意义,而服药病程、消化道病史、吸烟史和饮酒史差异均有统计学意义。表明服药病程长、消化道病史、吸烟史和饮酒史增加了上消化道出血的风险。长期吸烟会造成胃壁细胞出现异常增生,抑制胰腺分泌离子,从未对十二指肠黏膜的前列腺素合成产生阻碍作用,对胃黏膜保护屏障造成损伤[1]。也有研究显示吸烟与患者体内多胺合成密切相关,长期吸烟者体内多胺的合成明显减少,多胺的合成减少促使体内鸟氨酸脱羟合成减少,鸟氨酸脱羟合成对机体消化道黏膜具有很好的保护作用[14]。长期饮酒可能导致血小板数目异常,引起炎性反应,酒精会导致机体凝血功能出现障碍,增加出血的风险。研究提示酒精可对胃黏膜有直接的损伤作用,促使上消化道黏膜损伤和其出血的风险大大增加。本研究观察组CRP和Cr水平均高于对照组,差异有统计学意义。CRP一直被用来作为感染或心血管疾病的主要检测标志,提示可能与机体炎症反应有关。Cr异常会促使患者血管上皮细胞释放大量炎性因子,引发炎性反应,延缓溃疡愈合,最终对胃黏膜造成损坏,增加出血的风险;同时提示肾功能不全的患者在服用抗血小板药物后出血风险增加[1,14]。本研究观察组胃溃疡与胃黏膜病变检出率均高于对照组,以胃溃疡最常见,发生率为42.35%。与一些研究结果不同[7]。本研究观察组Hp感染率高于对照组,差异有统计学意义。Hp感染会加重抗血小板药物对消化道的损伤作用,Hp可以释放多种物质破坏胃黏膜屏障,致使胃功能出现障碍,主要物质包括蛋白酶、酯酶、磷脂酶A等,可通过影响营养吸收,诱发或加重消化道出血。因此,建议在长期抗血小板药物治疗之前,常规检测并根除Hp,以预防出血发生。
综上所述,吸烟史、饮酒史、消化道病史及存在Hp感染为上消化道出血的危险因素,因而在长期抗血小板药物治疗之前,应当识别出能引起出血的高危人群,建议其戒烟戒酒同时筛查根除Hp,这对减少上消化道出血有积极的意义。
[1] 何菡,贾明磊,赫明萍.抗血小板药物治疗老年冠心病致上消化道出血的影响因素分析[J].老年医学与保健,2018,24(2):184-187.
[2] Sadeghi A,Biglari M,Fayaz F,et al. Anti-platelet therapy and the risk of upper gastrointestinal bleeding[J]. Govaresh,2018,23(1):53-57.
[3] Chi TY,Zhu HM,Zhang M. Risk factors associated with nonsteroidal anti-inflammatory drugs(NSAIDs)-induced gastrointestinal bleeding resulting on people over 60 years old in Beijing[J]. Medicine,2018,97(18):e0665.
[4] Chi TY,Liu Y,Zhu HM,et al. Thromboelastography derived parameters for the prediction of acute thromboembolism following non steroidal anti inflammatory drug induced gastrointestinal bleeding:a retrospective study[J]. Exp Ther Med,2018,16(3):2257-2266.
[5] 中华内科杂志,中华医学杂志,中华消化杂志,等.急性非静脉曲张性上消化道出血诊治指南(2015年,南昌)[J].中华医学杂志,2016,96(4):254-259.
[6] 彭凌云,丁怀胜,李原,等.氯吡格雷低反应的高危冠心病患者改用替格瑞洛抗血栓治疗效果观察[J].河北医科大学学报,2016,37(12):1370-1373,1382.
[7] Gralnek IM,Dumonceau JM,Kuipers EJ,et al. Diagnosis and management of nonvariceal upper gastrointestinal hemorrhage:European Society of Gastrointestinal Endoscopy (ESGE) Guideline[J]. Endoscopy,2015,47(10):a1-46.
[8] 柏愚,李兆申.急性非静脉曲张性上消化道出血诊治——老问题,新观念,新指南,新解读[J].胃肠病学,2017,22(8):449-451.
[9] Li L,Geraghty OC,Mehta Z,et al. Age-specific risks,severity,time course,and outcome of bleeding on long-term antiplatelet treatment after vascular events:a population-based cohort study[J]. Lancet,2017,390(10093):490-499.
[10] Li YH,Fang CY,Hsieh IC,et al. 2018 Expert consensus on the management of adverse effects of antiplatelet therapy for acute coronary syndrome in Taiwan[J]. Acta Cardiol Sin,2018,34(3):201-210.
[11] Lué A,Lanas A. Protons pump inhibitor treatment and lower gastrointestinal bleeding:balancing risks and benefits[J]. World J Gastroenterol,2016,22(48):10477-10481.
[12] Carlin N,Asslo F,Sison R,et al. Dual antiplatelet therapy and the severity risk of lower intestinal bleeding[J]. J Emerg Trauma Shock,2017,10(3):98-102.
[13] Shaukat A,Waheed S,Alexander E,et al. Etiology of gastrointestinal bleeding in patients on dual antiplatelet therapy[J]. J Dig Dis,2018,19(2):66-73.
[14] 牛浩.抗血小板聚集药物致上消化道出血的影响因素研究[J].中国实用医药,2016,11(20):10-11.