脓毒症是宿主对感染的反应失控导致危及生命的器官功能衰竭,是一种严重威胁人类健康的危重急症,极易发展为严重脓毒症和脓毒症休克,病死率高[1]。脓毒症作为一种系统性炎症失衡,可累及多种靶器官,而肺脏便是其中一种最易累及的靶器官,可引发急性肺损伤。急性肺损伤发病中心环节为肺血管通透性增高,会给呼吸功能造成不利影响,故治疗期间需改善肺血管通透性。近年来,临床开始越来越多地关注肺血管通透性增高中氧化应激的作用,认为氧化应激过程中释放的大量活性氧自由基,可作用于肺微血管内皮细胞,促使肺血管通透性增高,进一步影响肺泡气体交换,产生顽固性缺氧,引发急性肺损伤。故探寻有效抗氧化物质,控制活性氧自由基对肺泡上皮细胞的攻击,减轻脓毒血症所致急性肺损伤病情,具有重要临床意义。研究发现,氢气能有效减少细胞中有害自由基、羟自由基和过氧亚硝酸盐,促使组织氧化应激损伤减轻,且在缺血再灌注、急性胰腺炎、急性肝损伤等严重氧化应激反应疾病的治疗中,氢分子均发挥重要作用[2]。目前,富氢生理盐水治疗脓毒症的研究大多基于盲肠结扎穿孔术大鼠模型,且生理盐水的氢含量局限于0.6 mg/L,对高剂量腹腔注射脂多糖诱导严重脓毒症肺损伤模型的研究较少。本研究旨在探讨高浓度富氢生理盐水(2.4 mg/L)对高剂量脂多糖引起的脓毒症急性肺损伤的影响。
1 材料与方法
1.1 动物模型 选取购自河北省实验动物中心的60只清洁级SD雄性大鼠,合格证编号为1108064,实验动物许可证号为SCXK(冀)2013-1-003。体重250~300 g;周龄6~8周。昼夜各12 h温度(25±1) ℃,湿度45%~55%,自由进食水。随机分为空白组、富氢生理盐水组、脂多糖组、脂多糖+富氢生理盐水组,每组15只。
1.2 方法
1.2.1 高浓度富氢生理盐水的制备 应用纳诺巴伯氢气溶解系统(NHDS-I,上海纳诺巴伯纳米科技有限公司)制备高浓度富氢生理盐水,亚甲蓝氢浓度测定溶液(上海汇康氢医学研究中心)测定制备后的富氢生理盐水含氢量2.2 mg/L。
1.2.2 动物建模 术前禁食12 h,自由饮水,脂多糖组、脂多糖+富氢生理盐水组大鼠行腹腔注射脂多糖10 mg/kg,空白组、富氢生理盐水组腹腔注射等剂量生理盐水。富氢生理盐水组、脂多糖+富氢生理盐水组,分别于术后即刻、3 h、6 h、12 h、18 h腹腔注射5 mL/kg富氢生理盐水,空白组、脂多糖组则给予5 mL/kg生理盐水。术后24 h,每组处死5只大鼠,取肺泡灌洗液和肺组织(部分冻存,部分固定)进行后续实验;另一部分大鼠用于观察存活率。
1.2.3 光镜下观察支气管肺泡灌洗液(bronchoaveolar lavage fluid,BALF)中性粒细胞计数 以10%水合氯醛3 mL/kg腹腔麻醉。经颈部正中切开皮肤,逐层暴露气道,行气管切开,用16号气管导管进行插管,暴露气管至隆突,夹闭右主支气管,以4 ℃无菌PBS液1 mL灌洗左侧肺脏,持续3次,精确回收BALF。4 ℃条件下,800 r/min离心,持续5 min,取上清液,置于-80 ℃冰箱内保存。沉淀中,以1 mL红细胞裂解液加入,重悬4 ℃条件下,800 r/min离心,持续5 min,弃上清液,1 mL PBS液重悬,1 200 r/min离心,持续10 min,制备细胞甩片。自然干燥固定,分别滴加瑞氏染液Ⅰ、Ⅱ,固定,染色。染液以流水冲去,自然干燥。光镜下观察BALF中性粒细胞计数。
1.2.4 HE染色和干湿比测定 切除右肺部分中叶组织并立即称重,然后在90 ℃的培养箱中干燥24 h后重新称重,计算干湿比。取剩余中叶肺组织固定于10%中性甲醛溶液中。石蜡包埋切片,脱蜡至水,苏木素(索莱宝,中国)染色5 min,蒸馏水中浸泡5 min,1 %盐酸酒精分化3 s,自来水流水冲20 min,蒸馏水中浸泡2 min,伊红(生工,中国)染色3 min,脱水、透明、封片,于显微镜(OLYMPUS,日本)下观察染色效果。
1.2.5 超氧化物歧化酶(superoxide dismutas,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)活性和丙二醛(malondialdehyde,MDA)含量测定 取右肺下叶组织称重,按重量(g)∶体积(mL)=1∶9的比例加入9倍的生理盐水,冰浴条件下机械匀浆,421 r/min,离心持续10 min,制备成10%的匀浆上清液,应用BCA蛋白浓度测定试剂盒(碧云天,中国)测定蛋白浓度。GSH-Ps、SOD、CAT、MDA含量的测定按照试剂盒说明书进行操作,试剂盒购买自南京建成生物工程研究所(中国)。
1.2.6 蛋白质免疫印迹(Western blot)法检测肺组织中核因子E-2-相关因子2(nuclear factor erythroid-2-related factor-2,Nrf2)和血红素加氧酶1(hemeoxygenase-1,HO-1)的表达 提取样本总蛋白和核蛋白,应用BCA蛋白浓度测定试剂盒(碧云天,中国)对蛋白进行定量,取20~40 μg蛋白上样,进行SDS-PAGE电泳并转印至PVDF膜(Millipore,美国),经5%(M/V)脱脂奶粉封闭1 h后,放入一抗工作液中4 ℃过夜孵育,TBST缓冲液清洗PVDF膜,放入IgG-HRP二抗工作液中37 ℃孵育45 min,ECL底物发光,采用凝胶图象处理系统(Gel-Pro-Analyzer软件)分析目标条带光密度值。
1.3 统计学方法 应用SPSS 16.0统计软件分析数据。计量资料比较分别采用两独立样本的t检验、F检验和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠生存分析 与脂多糖组比较,脂多糖+富氢生理盐水组大鼠7 d平均生存时间延长[(3.500±0.620) d vs(5.600±0.587) d,t=4.193,P=0.041],差异有统计学意义。
2.2 富氢生理盐水干预后肺组织HE染色组织切片 光镜下可见,空白组及富氢生理盐水组肺组织结构完整,肺间隔无明显增厚,支气管形态完好,肺泡结构完整,肺泡内及间质未见炎性细胞浸润;脂多糖组肺泡间隔增厚,细胞水肿,可见中性粒细胞浸润,肺泡壁毛细血管淤血明显,肺泡充盈差,部分肺泡腔内可见粉染蛋白水肿液、红细胞。脂多糖+富氢生理盐水组仍然可见炎性细胞浸润,肺泡间质水肿、充血,但病理改变明显减轻(图1)。
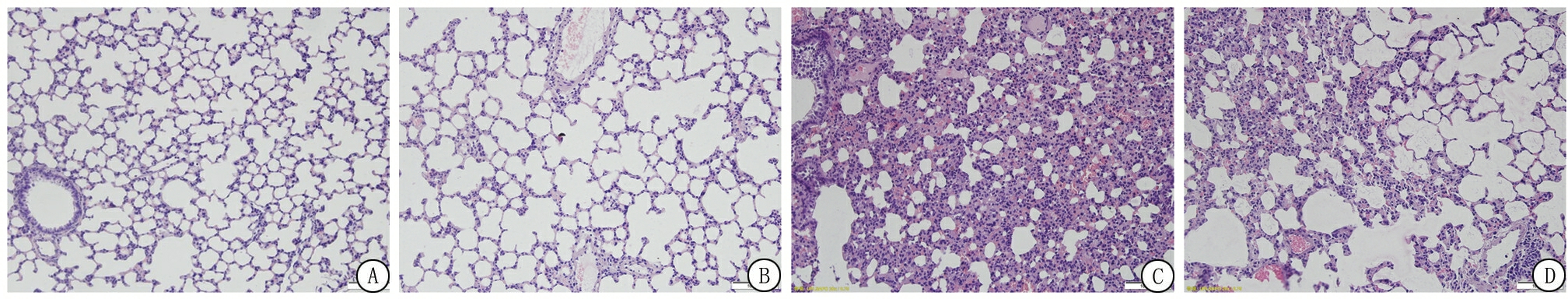
图1 肺组织病理切片(HE染色 ×200)
A.空白组;B.富氢生理盐水组;C.脂多糖组;D.脂多糖+富氢生理盐水组
Figure 1 Pathological section of lung tissue (HE staining ×200)
2.3 4组BALF中性粒细胞计数及干湿比比较 空白组、富氢生理盐水组BALF中性粒细胞数、干湿比差异均无统计学意义(P>0.05);与空白组比较,脂多糖组BALF中性粒细胞计数、干湿比均明显升高(P<0.05);与脂多糖组比较,脂多糖+富氢生理盐水组BALF中性粒细胞计数、干湿比均明显降低(P<0.05)。见表1。
2.4 高浓度富氢生理盐水对肺组织中氧化应激反应的影响 空白组与富氢生理盐水组大鼠肺组织MDA含量及SOD、CAT、GSH-Px活性差异均无统计学意义(P>0.05);与空白组比较,脂多糖组MDA含量明显增加,SOD、CAT和GSH-Px活性均明显降低(P<0.05);与脂多糖组比较,脂多糖+富氢生理盐水组MDA含量明显减少,SOD、CAT和GSH-Px活性均明显增加(P<0.05)。见表2。
2.5 高浓度富氢生理盐水对肺组织Nrf2和HO-1的影响 Western blot检测肺组织中Nrf2(细胞核中)和HO-1的表达。与空白组对比,脂多糖组核Nrf2和HO-1蛋白表达量均明显升高(P<0.05);高浓度富氢生理盐水处理后,脂多糖+富氢生理盐水组较脂多糖组核Nrf2和HO-1蛋白表达量均进一步升高(P<0.05)。见表3。
表1 4组BALF中性粒细胞计数、肺干湿比比较
Table 1 Comparison of neutrophil count and lung dry-wet ratio in four BALF groups![]()
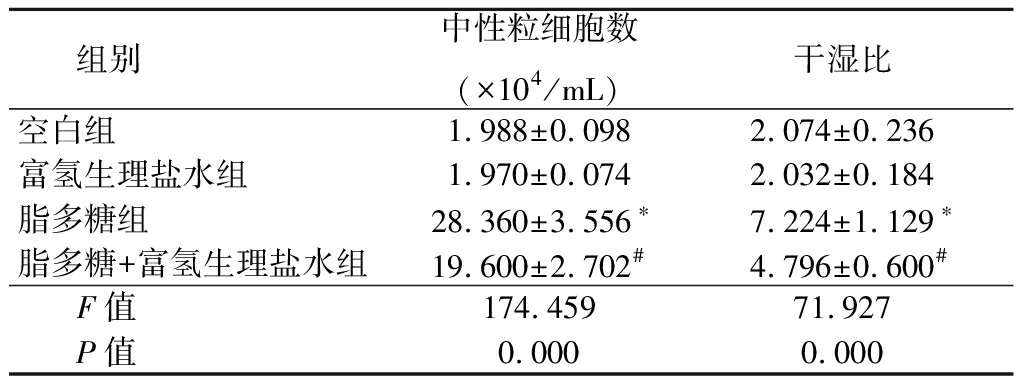
组别中性粒细胞数(×104/mL)干湿比空白组1.988±0.0982.074±0.236富氢生理盐水组1.970±0.0742.032±0.184脂多糖组28.360±3.556∗7.224±1.129∗脂多糖+富氢生理盐水组19.600±2.702#4.796±0.600#F值174.45971.927P值 0.0000.000
*P值<0.05与空白组比较 #P值<0.05与富氢生理盐水组比较(SNK-q检验)
表2 4组大鼠肺组织MDA含量及SOD、CAT、GSH-Px活性比较
Table 2 Comparison of MDA content,and SOD,CAT,GSH-Px activity in lung tissue of four groups of rats![]()
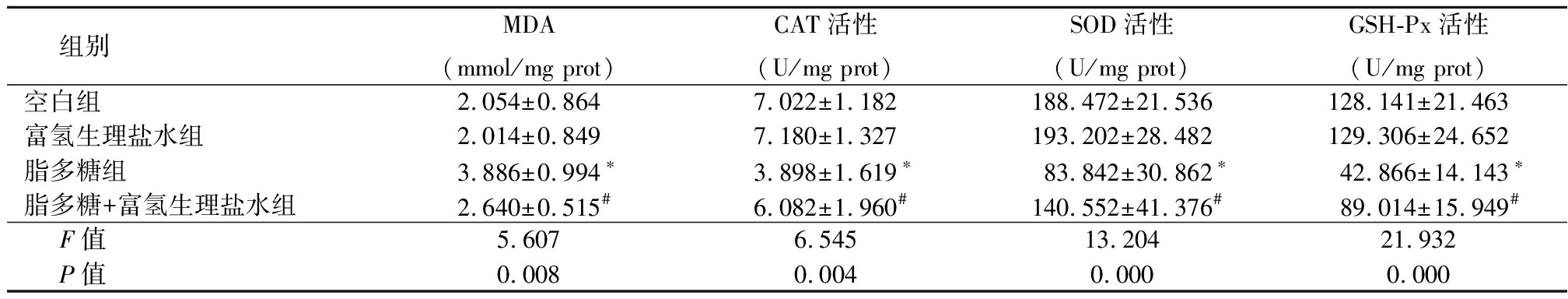
组别MDA(mmol/mg prot)CAT活性(U/mg prot)SOD活性(U/mg prot)GSH-Px活性(U/mg prot)空白组2.054±0.8647.022±1.182188.472±21.536128.141±21.463富氢生理盐水组2.014±0.8497.180±1.327193.202±28.482129.306±24.652脂多糖组3.886±0.994∗3.898±1.619∗ 83.842±30.862∗ 42.866±14.143∗脂多糖+富氢生理盐水组 2.640±0.515#6.082±1.960# 140.552±41.376#89.014±15.949#F值5.6076.54513.20421.932P值0.0080.0040.0000.000
*P值<0.05与空白组比较 #P值<0.05与富氢生理盐水组比较(SNK-q检验)
表3 4组大鼠Nrf2和HO-1水平比较
Table 3 Comparison of Nrf2 and HO-1 levels in rats of four groups ![]() 值)
值)
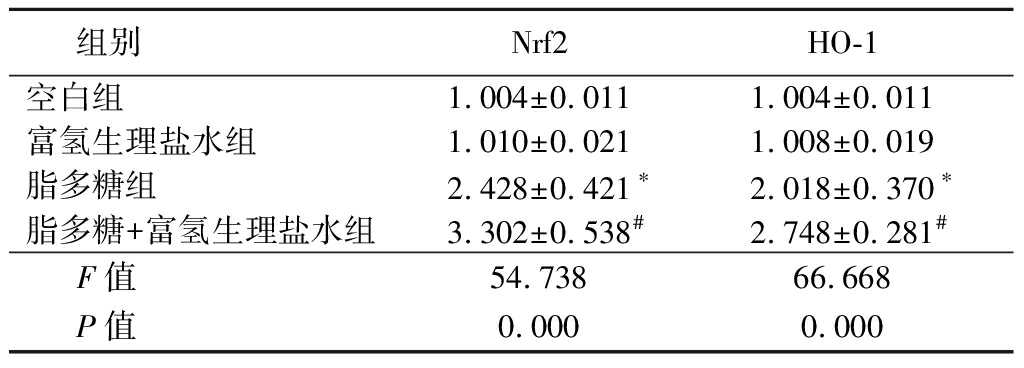
组别Nrf2HO-1空白组1.004±0.0111.004±0.011富氢生理盐水组 1.010±0.0211.008±0.019脂多糖组 2.428±0.421∗2.018±0.370∗脂多糖+富氢生理盐水组3.302±0.538# 2.748±0.281#F值54.73866.668P值0.0000.000
*P值<0.05与空白组比较 #P值<0.05与富氢生理盐水组比较(SNK-q检验)
3 讨 论
脓毒症属于临床常见全身炎症反应综合征,大多由感染所致。随着脓毒血症病情进展,可累及肺脏,增加急性肺损伤发生风险。严重脓毒症引发的急性肺损伤治疗棘手,病死率高。应明确脓毒血症诱发急性肺损伤机制,并采取积极治疗策略,控制患者病死率,改善预后。目前认为,脓毒症所致急性肺损伤发生中炎症细胞、氧化应激发挥重要作用[3-4]。
MDA是膜脂过氧化的终产物之一,MDA表达水平与氧自由基的生成呈正相关,反映了组织脂质过氧化的程度。SOD是一种重要的抗氧化酶,在清除多种氧自由基方面发挥着重要作用,组织中SOD活性间接反映了组织的抗氧化活性[5]。过氧化氢是氧化酶催化的氧化还原反应中产生的细胞毒性物质,在脓毒症过程中,氧化应激明显,过氧化物大量释放,对细胞产生破坏,而过CAT的作用是催化过氧化氢的分解,可对细胞起保护作用,使细胞免受过氧化氢的危害。 GSH-Px使有毒的过氧化物还原成无毒的羟基化合物,从而保护细胞膜的结构和功能不受过氧化物的干扰及损害[6]。因此,MDA水平,SOD、CAT、GSH-Px活性是氧化应激水平的良好指标。
氢气无色无味,含量丰富,存在一定选择性抗氧化生理特性,且无毒、无残留。低浓度氢气吸入能使各类因素所致器官功能障碍得以改善,故应用前景广泛。研究显示氢能对离体培养神经元细胞内羟自由基(·OH)、过氧亚硝基(ONOO-)进行选择性清除,发挥抗氧化应激作用[7]。目前,氢分子对多种与氧化应激相关的疾病有治疗作用,如神经系统疾病、急性心肌梗死再灌注损、急性肾损伤、急性肺损伤、脓毒症、肝移植等[2,8-9]。氢可以对脓毒症诱发的多个器官损伤产生保护作用。由于氢气与氧气混合存在易燃性,氢的临床应用安全性受到了挑战。富含氢气的等渗生理盐水,可克服氢气易燃易爆弊端,减轻重要器官氧化应激、炎症反应,从而保护器官功能。多项研究发现低浓度富氢液能够通过降低水通道表达水平,对脓毒症相关损伤产生保护作用,但实验所应用的富氢生理盐水制备方法所制备的氢含量较低,损伤模型病变程度较轻[10]。本研究应用的富氢生理盐水的制备设备可产出高浓度富氢生理盐水,最高氢含量可达2.4 mg/L,既往对此种高浓度富氢生理盐水的研究较少。本研究结果显示,高浓度富氢生理盐水降低腹腔注射高剂量脂多糖肺损伤大鼠模型的病死率,HE染色显示肺损伤程度减轻,肺水含量减少,BALF中性粒细胞明显减少,MDA水平降低,SOD、CAT、GSH-Px活性升高,说明给予高浓度富氢液腹腔注射可通过改善氧化应激水平,减轻炎症细胞肺内聚集,明显减轻急性肺损伤程度。
研究表明,Nrf2、JNK、p38MAPK、Rho/ROCK等多种信号通路调控HO-1表达,进而影响SOD、CAT、GSH-Px活性及MDA水平[11-13]。其中Nrf2/HO-1作为重要的抗氧化通路,对脓毒症相关性肺损伤也发挥着重要的作用。Yu等[14-15]证实氢气通过Nrf2/HO-1通路对脓毒症相关性肺损伤存在保护作用,亦可通过非Nrf2调节的HO-1通路对小鼠肠损伤存在保护作用。本研究同样证实高浓度富氢生理盐水通过上调Nrf2/HO-1,提升大鼠体内SOD等抗氧化活性,减轻肺损伤程度。
综上所述,本研究证实高浓度富氢液腹腔注射可降低脂多糖所致大鼠脓毒症相关病死率,减轻急性肺损伤程度,这可能与氢上调Nrf2/HO-1通路、提升抗氧化能力、抑制氧化应激反应、降低炎症反应有关。此外,本研究证明的Nrf2/HO-1通路不是唯一调节通路,尚有Rho/ROCK、JNK、p38MAPK等多种信号通路,这些通路可能也参与了氢对脓毒症的调节。随后,笔者将对其他分子展开讨论,以进一步明确氢的治疗作用相关机制。
[1] Grek A,Booth S,Festic E,et al. Sepsis and shock response team:impact of a multidisciplinary approach to implementing surviving sepsis campaign guidelines and surviving the process[J]. Am J Med Qual,2017,32(5):500-507.
[2] Ge L,Yang M,Yang NN,et al. Molecular hydrogen:a preventive and therapeutic medical gas for various diseases[J]. Oncotarget,2017,8(60):102653-102673.
[3] Prauchner CA. Oxidative stress in sepsis:pathophysiological implications justifying antioxidant co-therapy[J]. Burns,2017,43(3):471-485.
[4] Pei X,Zhang XJ,Chen HM. Bardoxolone treatment alleviates lipopolysaccharide(LPS)-induced acute lung injury through suppressing inflammation and oxidative stress regulated by Nrf2 signaling[J]. Biochem Biophys Res Commun,2019,516(1):270-277.
[5] 金玉珍,曹平.安宫牛黄丸对脂多糖致急性肺损伤大鼠肺组织Nrf2蛋白表达的影响[J].海南医学,2017,28(5):689-692.
[6] Esmaeilnejad B,Tavassoli M,Samiei A,et al. Evaluation of oxidative stress and antioxidant status,serum trace mineral levels and cholinesterases activity in cattle infected with Anaplasma marginale[J]. Microb Pathog,2018,123:402-409.
[7] Ohsawa I,Ishikawa M,Takahashi K,et al. Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals[J]. Nat Med,2007,13(6):688-694.
[8] Dong A,Yu Y,Wang Y,et al. Protective effects of hydrogen gas against sepsis-induced acute lung injury via regulation of mitochondrial function and dynamics[J]. Int Immunopharmacol,2018,65:366-372.
[9] Uto K,Sakamoto S,Que W,et al. Hydrogen-rich solution attenuates cold ischemia-reperfusion injury in rat liver transplantation[J]. BMC Gastroenterol,2019,19(1):25.
[10] Lu R,Liu Y,Wang D. Protective effect of hydrogen-rich water on oxidative stress cell model and the impact of the phosphatidylinositol 3 kinase/protein kinase B pathway[J]. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue,2019,31(6):762-767.
[11] Cheng Y,Li X,Tse HF,et al. Gallic Acid-L-Leucine conjugate protects mice against LPS-Induced inflammation and sepsis via correcting proinflammatory lipid mediator profiles and oxidative stress[J]. Oxid Med Cell Longev,2018,2018:1081287.
[12] Wang X,Chen T,Ma X,et al. Progress on nuclear factor-E2 related factor 2 transcription factors in sepsis[J]. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue,2018,30(8):810-814.
[13] Chowdhury A,Lu J,Zhang R,et al. Mangiferin ameliorates acetaminophen-induced hepatotoxicity through APAP-Cys and JNK modulation[J]. Biomed Pharmacother,2019,117:109097.
[14] Yu Y,Yang Y,Yang M,et al. Hydrogen gas reduces HMGB1 release in lung tissues of septic mice in an Nrf2/HO-1-dependent pathway[J]. Int Immunopharmacol,2019,69:11-18.
[15] Yu Y,Yang Y,Bian Y,et al. Hydrogen gas protects against intestinal injury in wild type but not NRF2 knockout mice with severe sepsis by regulating HO-1 and HMGB1 release[J]. Shock,2017,48(3):364-370.