巨细胞病毒(cytomegalovirus,CMV)感染广泛存在于世界各地,大多数人感染后无临床症状,成为病毒携带者,是CMV肺炎的重要传染源。当人免疫力低下或接受免疫抑制治疗时,发生CMV肺炎概率大大增加,且病死率相对较高[1-3]。本研究针对CMV肺炎患者的临床资料,进行危险因素、临床表现及预后分析,旨在为CMV肺炎患者的临床诊治提供指导。
1 资料与方法
1.1 实验设计 采用回顾性分析的方法,收集2016年1月—2018年10月河北医科大学第二医院呼吸内科病房收治的68例非获得性免疫缺陷病毒(human immunodeficiency virus,HIV)感染免疫抑制CMV肺炎患者的临床资料,包括:①一般情况(性别、年龄、体重指数、临床症状、生命体征、诊断、住院时间等);②应用糖皮质激素及免疫抑制剂的基础疾病情况;③并发症情况;④病原学资料(痰或支气管肺泡灌洗液培养、血培养及尿培养等);⑤入院后患者病情转归情况。根据患者最终转归情况分为存活组及死亡组(院内死亡),对上述资料进行分析,并探讨对预后的影响。
1.2 免疫抑制标准 ①存在免疫抑制相关疾病:自身免疫性疾病、肾脏疾病、间歇性肺疾病、血液病、实体恶性肿瘤、皮肤病、器官移植等;②正在接受激素、免疫抑制剂、放化疗等相关免疫抑制治疗;③CD4+ T 淋巴细胞≤500×106/L[4]。
1.3 CMV感染定义 患者在住院期间进行全血或肺泡灌洗液CMV-DNA检测,结果阳性者确诊为CMV感染[4-7]。本研究纳入病例均为全血CMV-DNA检测阳性。CMV肺炎诊断依据:①发热,体温>38.0 ℃,持续时间>3 d;②咳嗽,痰少,呼吸困难,低氧血症进行性加重;③典型的胸部影像学改变,胸部X线片以间质性改变为主要表现,胸部CT表现为磨玻璃阴影、直径<1 cm的小结节影,缺乏大的结节影及有支气管充气征的实变阴影;④CMV实验室检查:血清CMV抗体、全血CMV-DNA阳性和(或)CMV-pp65抗原阳性,痰液、支气管肺泡灌洗液CMV-DNA阳性;⑤发热早期,其他病原体检查均为阴性;⑥肺活组织检查发现CMV包涵体。若符合①~⑤项诊断标准中任何1项及第⑥项诊断标准,或符合 ①~⑤项诊断标准,均可诊断CMV肺炎[4-9]。
1.4 排除标准 ①儿童或婴幼儿;②入院后24 h内死亡或出院;③妊娠期或哺乳期妇女;④临床资料丢失者。
1.5 统计学方法 应用 SPSS 22.0统计软件分析数据。计量资料比较采用两独立样本的t检验;计数资料比较采用χ2检验。P<0.05差异有统计学意义。
2 结 果
68例患者均为非HIV感染,免疫抑制为应用糖皮质激素或者免疫抑制剂所致,基础疾病为肾脏疾病(33.82%)、风湿性疾病(27.94%)、血液系统疾病(20.59%),合并其他疾病者(60.29%);超过70%患者为混合感染,合并细菌、真菌或其他病原体感染。68例患者中死亡23例,存活45例。总体死亡率较高(33.82%)。对比死亡患者和存活患者,发现因皮肤疾病应用药物所致免疫抑制患者3例全部死亡,病死率较高(P<0.05),合并疾病在死亡组更为多见(P<0.05);肺部合并革兰染色阳性球菌感染或发生血流感染者,预后更差(P<0.05)。见表1,2。
表1 死亡组与存活组临床资料比较
Table 1 Comparison of general clinical data
between death group and survival group
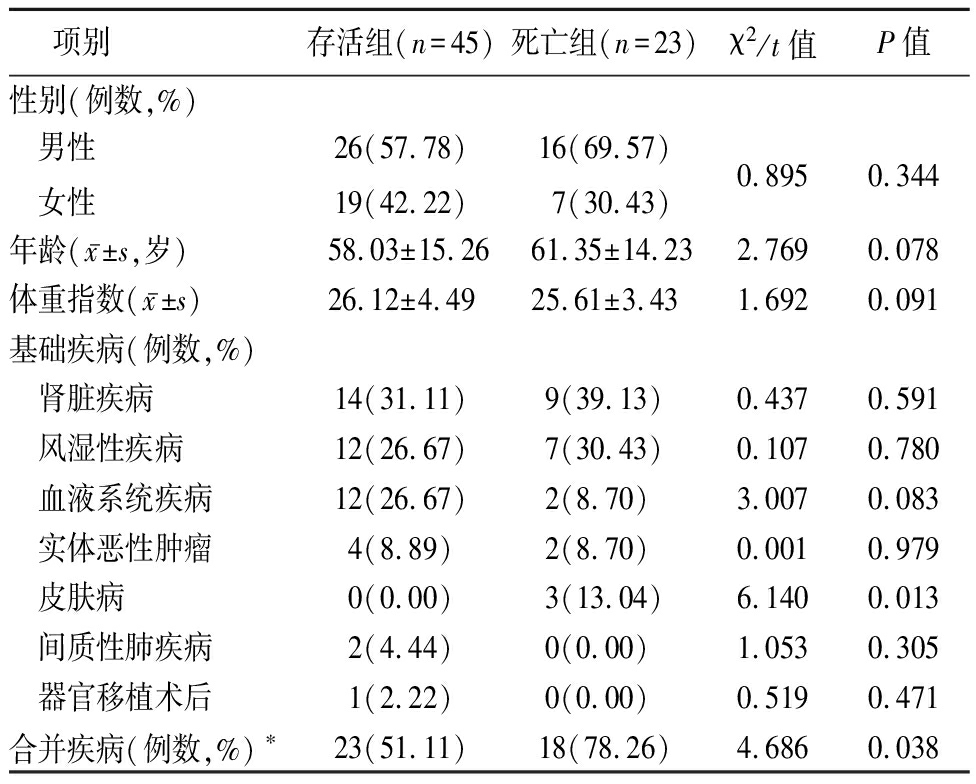
项别 存活组(n=45)死亡组(n=23)χ2/t值P值性别(例数,%) 男性 女性26(57.78)19(42.22)16(69.57)7(30.43)0.8950.344年龄(x-±s,岁)58.03±15.2661.35±14.232.7690.078体重指数(x-±s) 26.12±4.4925.61±3.431.6920.091基础疾病(例数,%) 肾脏疾病14(31.11)9(39.13)0.4370.591 风湿性疾病12(26.67)7(30.43)0.1070.780 血液系统疾病12(26.67)2(8.70) 3.0070.083 实体恶性肿瘤4(8.89)2(8.70) 0.0010.979 皮肤病0(0.00)3(13.04)6.140 0.013 间质性肺疾病2(4.44)0(0.00) 1.0530.305 器官移植术后1(2.22)0(0.00) 0.5190.471合并疾病(例数,%)∗23(51.11)18(78.26)4.6860.038
*合并疾病包括冠心病、心力衰竭、糖尿病、慢性阻塞性肺疾病、脑梗死
表2 死亡组与存活组合并感染病原体情况比较
Table 2 Comparison of pathogens between
death group and survival group (例数,%)
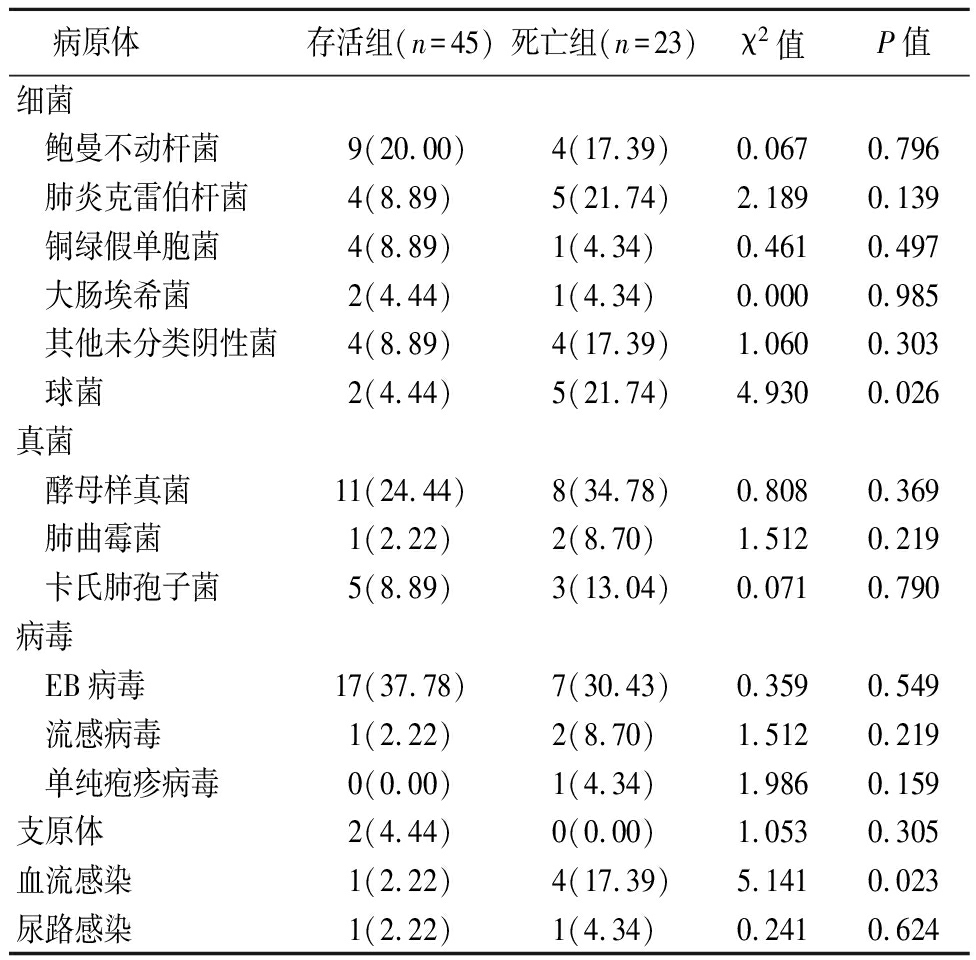
病原体 存活组(n=45)死亡组(n=23)χ2值P值细菌 鲍曼不动杆菌9(20.00)4(17.39)0.0670.796 肺炎克雷伯杆菌4(8.89)5(21.74)2.1890.139 铜绿假单胞菌4(8.89)1(4.34)0.4610.497 大肠埃希菌2(4.44)1(4.34)0.000 0.985 其他未分类阴性菌4(8.89)4(17.39)1.060 0.303 球菌2(4.44)5(21.74)4.930 0.026 真菌 酵母样真菌11(24.44)8(34.78)0.8080.369 肺曲霉菌1(2.22)2(8.70)1.5120.219 卡氏肺孢子菌5(8.89)3(13.04)0.0710.790 病毒 EB病毒 17(37.78)7(30.43)0.3590.549 流感病毒1(2.22)2(8.70)1.5120.219 单纯疱疹病毒0(0.00)1(4.34)1.9860.159支原体2(4.44)0(0.00)1.0530.305血流感染1(2.22)4(17.39)5.1410.023 尿路感染1(2.22)1(4.34)0.2410.624
3 讨 论
尽管CMV感染在免疫抑制患者中十分常见,但由于其临床表现缺乏明显特异性,且部分感染患者与某些基础疾病病情活动难以区分,故病原学检查对临床上确诊CMV感染十分重要[10]。本研究所有患者外周全血CMV-DNA阳性,结合临床表现诊断CMV肺炎可靠性高。
患者免疫力低下是CMV易感的主要因素。本研究患者存在基础疾病,故需行糖皮质激素、免疫抑制剂治疗原发疾病。研究表明,在发病前1个月内应用糖皮质激素可使机体免疫水平降低,并诱导CMV再活化,促进其增殖。有研究报道,患者感染的严重程度与免疫抑制的类型及免疫抑制应用时间相关[11-12]。
本研究患者基础疾病中,肾脏疾病居首位,肾脏疾病患者除应用激素或免疫抑制剂治疗造成免疫抑制外,大量蛋白尿使血白蛋白水平明显降低,输注血浆或人血白蛋白治疗效果相对较差,且部分患者存在血肌酐高、严重贫血等,上述情况均可加重自身病情,免疫力进一步降低,使患者对CMV易感性增加[13];基础疾病第2位为风湿性疾病,风湿性疾病为自身免疫性疾病,患者本身免疫系统常存在功能紊乱或低下,糖皮质激素及免疫抑制剂可降低患者的免疫力[14-16];基础疾病第3位为血液系统疾病(包括白血病、淋巴瘤及骨髓增生异常综合征等),克隆性白血病细胞、异常淋巴细胞在骨髓和其他造血组织中大量增殖累积,并浸润其他非造血组织和器官,同时抑制正常造血功能,致髓系细胞分化及发育异常,故带来相关的免疫受损容易引发CMV感染及混合感染。
免疫抑制患者容易发生机会感染,CMV肺炎患者在疾病进展和住院(或住ICU)治疗过程中还常合并细菌、真菌等其他病原体感染。本研究中对患者的痰或支气管肺泡灌洗液进行培养,结果显示大部分患者存在混合感染,合并鲍曼不动杆菌患者最多,其次为肺炎克雷伯杆菌、铜绿假单胞菌,真菌感染以酵母样真菌最为常见,还有少部分患者存在血流感染、尿路感染。本研究对死亡组和存活组肺部合并其他病原体感染种类进行分析,除合并革兰染色阳性球菌感染之外,对于患者预后无明显差别,故推断混合感染可能不是CMV患者死亡的主要危险因素。但是ICU感染革兰染色阳性球菌常常为多重耐药球菌如耐甲氧西林金黄色葡萄球菌、耐万古霉素肠球菌等,常用的抗生素如头孢菌素、喹诺酮类,甚至碳青霉稀类抗生素均无效,这或许是造成病死率高的原因。因此,对于此类患者应该警惕革兰染色阳性球菌的可能,加强病原学检查的力度,必要时经验性治疗[17]。另外,本研究死亡组血流感染比例明显高于存活组,差异有统计学意义。说明死亡组患者免疫力更为低下,肺部感染或者ICU的有创性治疗如深静脉导管等更易发生血流的系统性感染,并导致病死率增加[18]。
综上所述,肾脏疾病、风湿性疾病、血液系统疾病并接受糖皮质激素或免疫抑制剂治疗的患者,容易发生CMV肺炎且总体病死率较高;CMV肺炎患者还常合并细菌、真菌等其他病原体感染,且合并革兰阳性球菌感染或发生血流感染者病死率较高。因此,针对CMV肺炎的治疗除了抗病毒治疗外,适当的抗生素针对合并感染可能是治疗成功的关键。
[1] Li G,Nguyen CC,Ryckman BJ,et al. A viral regulator of glycoprotein complexes contributes to human cytomegalovirus cell tropism[J]. Proc Natl Acad Sci USA,2015,112(14):4471-4476.
[2] Letourneau AR,Issa NC,Baden LR. Pneumonia in the immunocompromised host[J]. Curr Opin Pulm Med,2014,20(3):272-279.
[3] Manicklal S,Emery VC,Lazzarotto T,et al. The “silent” global burden of congenital cytomegalovirus[J]. Clin Micmbiol Rev,2013,26(1):86-102.
[4] 李秋钰,路明,姚婉贞.造血干细胞移植患者巨细胞病毒肺炎的诊治进展[J].中华结核和呼吸杂志,2019,42(2):134-137.
[5] 中华医学会器官移植学分会.器官移植受者巨细胞病毒感染临床诊疗规范(2019版)[J].器官移植,2019,10(2):142-148.
[6] Boeckh M,Stevens-Ayers T,Travi G,et al.Cytomegalovirus(CMV) DNA quantitation in bronchoalveolar lavage fluid from hematopoietic stem cell transplant recipients with CMV pneumonia[j]. j infect dis,2017,215(10):1514-1522.
[7] lee hy,rhee ck,choi jy,et al.diagnosis of cytomegalovirus pneumonia by quantitative polymerase chain reaction using bronchial washing fluid from patients with hematologic malignancies[J]. Oncotarget,2017,8(24):39736-39745.
[8] Lino K,Trizzotti N,Carvalho FR,et al.Pp65 antigenemia and cytomegalovirus diagnosis in patients with lupus nephritis: report of a series[J]. J Bras Nefrol,2018,40(1):44-52.
[9] Lodding IP,Schultz HH,Jensen JU,et al. Cytomegalovirus viral load in bronchoalveolar lavage to diagnose lung transplant associated cmv pneumonia[J]. Transplantation,2018,102(2):326-332.
[10] Yi F,Zhao J,Luckheeram RV,et al. The prevalence and risk factors of cytomegalovirus infection in inflammatory bowel disease in Wuhan,Central China[J]. Virol J,2013,10:43.
[11] Henmi Y,Kakimoto K,Inoue T,et al.Cytomegalovirus infection in ulcerative colitis assessed by quantitative polymerase chain reaction: risk factors and effects of immunosuppressants[J]. J Clin Biochem Nutr,2018,63(3):246-251.
[12] Marsico C,Kimberlin DW. Congenital Cytomegalovirus infection: advances and challenges in diagnosis,prevention and treatment[J]. Ital J Pediatr,2017,43(1):38.
[13] 王心晓,齐见旭.肾脏疾病免疫抑制剂治疗后继发巨细胞病毒(cMV)肺炎的救治研究[J].临床肺科杂志,2014,19(11):2053-2054.
[14] 张祎,黄絮,易丽,等.成人Still病合并肺孢子菌肺炎和巨细胞病毒肺炎5例临床分析[J].心肺血管病杂志,2018,37(7):629-634.
[15] Xue Y,Jiang L,Wan WG,et al.Cytomegalovirus pneumonia in patients with rheumatic diseases after immunosuppressive therapy:a single center study in China[J]. Chin Med J(Engl),2016,129(3):267-273.
[16] 任立敏,李妍,张春芳,等.系统性风湿病合并巨细胞病毒感染的临床特点及其相关危险因素分析[J].中华医学杂志,2016,96(35):2772-2776.
[17] 李洋,石志红,杨岚,等.免疫损害宿主肺炎病原学分布特征及耐药情况分析[J].西安交通大学学报:医学版,2016,37(3):423-427,431.
[18] 顾莹,潘文森,于婧,等.非HIV感染免疫抑制重症肺炎患者的病原学分析[J].河北医科大学学报,2018,39(10):1143-1148.