胃癌是严重威胁我国大众健康的重大肿瘤疾病,其发病率和病死率位居所有恶性肿瘤的第2位,其中发病和死亡例数均占全球病例的50%左右[1]。目前胃癌的治疗手段仍是以手术为主,放化疗为辅,我国胃癌的5年生存率仅有30%左右,近年来对胃癌的认识已经从宏观的细胞学、组织学深入到微观的遗传学与分子生物学领域,基于分子生物学的靶向治疗取得了突破性进展,对具有Her2阳性突变基因的胃癌患者采用靶向治疗可以显著延长患者生存期,但大多数胃癌患者仍未找到合适的治疗靶点。Polo样激酶家族(polo-like kinases,PLKs)是一类高度保守的丝/苏氨酸蛋白激酶,包含PLK1、PLK2、PLK3和PLK4[2],在细胞周期的每个阶段发挥至关重要的调控作用,其中人们对PLK1的研究最为深入。PLK1与细胞周期有丝分裂过程密切相关,影响细胞的增殖过程,能够促进肿瘤进行转化,在肿瘤发生发展中发挥着重要作用,研究发现PLK1在前列腺癌[3]、乳腺癌[4]和头颈部鳞癌[5]等多种恶性肿瘤组织中存在高表达,通过各种措施抑制PLK1表达后可以显著减少细胞增殖,促进肿瘤凋亡[6]。目前国内外关于PLK1和胃癌关系的研究主要集中在细胞周期方面,而与胃癌细胞侵袭转移的研究较少。为进一步明确PLK1与胃癌肿瘤生物学行为的关系,本研究应用反义RNA技术抑制PLK1基因的表达,分析PLK1表达与胃癌细胞周期和侵袭转移的密切关系,并对其机制进行初步探讨。
1 材料与方法
1.1 材料 人胃腺癌细胞株AZ521细胞由河北医科大学第四医院肿瘤研究所保存提供,胎牛血清购自上海江林生物科技有限公司,EMEM培养液购自上海中乔新舟生物科技公司,SilencerTMSelect PLK1和control siRNA购自美国Life Technologies公司,TaqMan PLK1引物和探针(Hs00983227_m1)、TaqManGAPDH引物和探针购自杭州禾船生物科技有限公司,LipofectamineTM RNAiMAX转染试剂盒购自上海浩然生物技术有限公司,Opti-MEM培养基购自美国Invitrogen公司,iScriptTM cDNA合成试剂盒购自赛默飞世尔科技(中国)有限公司,TaqMan基因表达预混液购自北京诺博莱德科技有限公司,Tris/甘氨酸缓冲液、Tris/甘氨酸/蛋白电泳缓冲液购自上海沪震实业有限公司,总RNA提取试剂盒购自武汉艾美捷科技有限公司,E-cadherin、Vimentin、PLK1和GAPDH单克隆抗体均购自北京奥维亚生物技术有限公司,兔抗人MMP-9单克隆抗体购自艾美捷科技有限公司,West Femto最高灵敏度化学发光底物试剂盒购自美国Thermo Scientific公司,Pierce-BCA蛋白分析试剂盒购自上海子起生物科技有限公司,Transwell膜嵌套购自上海百赛生物技术股份有限公司。Synergy-HT多功能酶标仪购自美国伯腾仪器有限公司,ABI Prism 7900HT型荧光定量PCR仪购自北京义翘神州科技有限公司,低温高速离心机购自美国Beckman Coulter公司,NanoDrop 8000全光谱紫外-可见光分光光度计购自美国赛默飞世尔公司。
1.2 方法
1.2.1 细胞培养和转染 AZ521细胞在10%胎牛血清的EMEM培养基在37 ℃、5%CO2培养箱中培养,待细胞融合达80%左右进行传代培养。将生长状态良好的胃癌AZ521细胞按一定细胞数接种于6孔板上待融合生长达70%~80%时设control组(空白对照组)和siRNA(实验组),更换无血清培养基。参照LipofectamineTM RNAiMAX转染试剂说明书将Lipofectamine 2000、siRNA、Opti-MEM溶液均匀混合,室温放置20 min,加入到含有AZ521细胞的6孔板内,每组设3个副孔。调整siRNA组和control组的终浓度均为100 nmol/L,转染6 h,更换培养基培养48 h。
1.2.2 实时荧光定量PCR法检测PLK1基因表达 用PBS洗涤转染好的胃癌AZ521细胞并根据试剂盒说明书提取每组总RNA,纯化后应用分光光度计检测RNA浓度。接着参照iScriptTMcDNA合成试剂盒说明书进行反转录生成cDNA,然后用无R-Nase水稀释cDNA作为模板,将相应预混液、探针、cDNA放到一起,每孔共5 μL,放到ABI荧光定量PCR仪专用384孔板上,瞬时离心后进行PCR扩增,95 ℃预变性5 min,95 ℃变性5 s,60 ℃退火10 s,72 ℃延伸10 s,40 个循环。用2-△Ct 法对结果进行数据分析。
1.2.3 Western blot法检测研究蛋白表达结果 用PBS洗涤转染好的胃癌AZ521细胞,用胰蛋白酶消化细胞5~8 min,加入培养基,制成单细胞悬液,上机离心去上清液,加入蛋白裂解液,上机取上清液,提取样本的细胞总蛋白,用BCA法(即用BCA试剂盒检测,制备牛血清白蛋白标准曲线,再检测每组样本的吸光度值,对照标准曲线根据吸光度值得到对应样本的蛋白浓度)测定蛋白浓度。在转印槽中加上Tris/甘氨酸/蛋白电泳液,接着进行制胶:在Mini-PROTEAN TGX预制胶中每组样本加12 μL蛋白,进行电泳达标后,使用双蒸水短暂冲洗凝胶,再用水和转膜缓冲液冲洗摇动15 min;转膜:在Tris/甘氨酸缓冲液中将其转至PVDF膜(冰浴),注意赶出气泡,转膜条件电压100 V,时间40 min。室温TBST液封膜1 h,加入各对应指标PLK1、MMP-9、E-cadherin、Vimentin、GAPDH相应浓度的一抗,4 ℃摇床振荡过夜。第2天TBST洗膜3次,每次10 min,加入二抗室温振荡1 h,TBST洗膜,将ECL发光液A液和B液1∶1混合后滴于PVDF膜上于X室曝光显影,以GAPDH作为内参照,用Image软件测量灰度值。
1.2.4 流式细胞术检测细胞周期变化 用PBS洗涤各组转染好的胃癌AZ521细胞,用胰酶消化细胞,PBS清洗,离心弃上清,重复2次,接着重悬细胞于PBS中,缓慢加入冰乙醇放到振荡器上搅拌固定过夜。次日离心弃上清用冷PBS洗去乙醇,重悬细胞并加入RNaseA消化1 h再加入碘化丙啶避光染色。上机进行分析。
1.2.5 Transwell侵袭实验 Matrigel胶液化与4 ℃预冷的无血清培养基稀释,然后将Matrigel胶平铺于聚碳酸酯膜,将转染好的胃癌AZ521细胞以1×105个细胞的RPMI 200 μL加入Transwell小室上室,下室加含500 μL的RPMI 1640培养液,然后放到恒湿恒温箱内24 h,然后甲醇室温固定30 min并干燥后用结晶紫对其进行染色10 min,清水漂洗晾干,随机用高倍镜观察4个视野进行计数。
1.3 统计学方法 应用SPSS 17.0统计软件分析数据。计量资料比较采用两独立样本的t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 PCR法检测转染后胃癌AZ521细胞中的PLK1基因表达结果 siRNA组PLK1 mRNA表达水平为0.17±0.03,明显低于control组的1.00±0.02,差异有统计学意义(t=44.542,P=0.000)。
2.2 Western blot法检测蛋白表达结果 用Image软件测量AZ521细胞PLK1、E-cadherin、Vimentin和MMP-9蛋白灰度值。siRNA组PLK1、Vimentin、MMP-9蛋白表达明显低于control组,E-cadherin蛋白表达明显高于control组,差异均有统计学意义(P<0.05),见表1。
表1 2组PLK1、E-cadherin、Vimentin和
MMP-9蛋白表达水平比较
Table 1 Comparison of protein expression levels of PLK1,
E-cadherin,Vimentin and MMP-9![]()
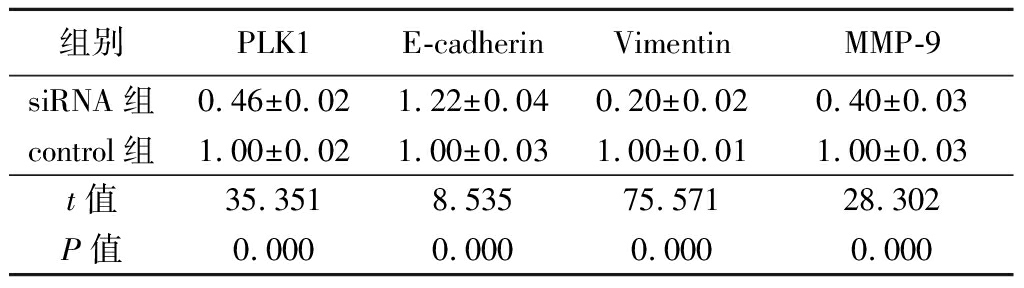
组别PLK1E-cadherinVimentinMMP-9siRNA组0.46±0.021.22±0.040.20±0.020.40±0.03control组1.00±0.021.00±0.031.00±0.011.00±0.03t值35.3518.53575.57128.302P值0.0000.0000.0000.000
2.3 流式细胞术检测AZ521细胞不同周期表达量变化 siRNA组G2/M期细胞表达量明显高于control组,S期细胞表达量明显低于control组,差异有统计学意义(P<0.05);2组G0/G1期细胞表达量差异无统计学意义(P>0.05)。见表2。
表2 2组AZ521细胞不同周期表达量比较
Table 2 Comparison of expression in different
AZ521 cell cycle![]()
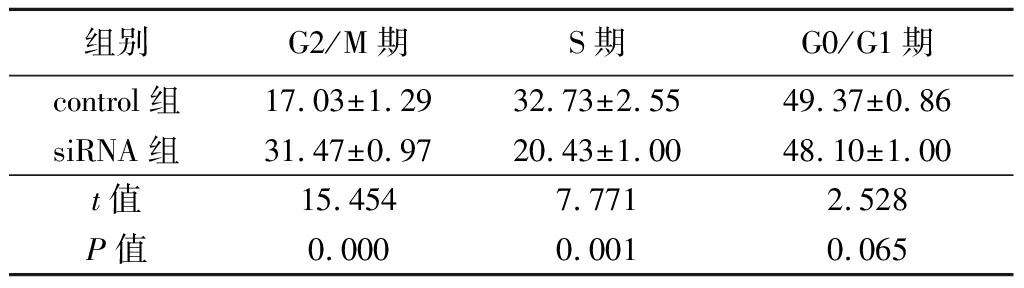
组别G2/M期S期G0/G1期control组17.03±1.2932.73±2.5549.37±0.86siRNA组31.47±0.97 20.43±1.00 48.10±1.00t值15.4547.7712.528P值0.0000.0010.065
2.4 Transwell侵袭实验 siRNA组AZ521细胞穿膜细胞数为(47.00±4.00)个,明显少于control组(95.00±4.04)个,差异有统计学意义(t=14.824,P=0.000)。
3 讨 论
我国每年胃癌新发病例和死亡病例位居世界首位,胃癌早期并无明显症状,多数发现时已为中晚期,即使采取已手术为主的综合治疗,5年生存率低于30%[7]。近年来靶向治疗的开展,为胃癌治疗燃起了新的希望。PLK1是PLK家族研究最多的成员,最初在果蝇中被发现,研究显示其与中心体成熟、纺锤体动力学、染色体分离和胞质分裂等过程密切相关。PLK1在头颈癌和食管癌等多种肿瘤的早期阶段促进肿瘤的发展,其表达与患者生存率成反比,PLK1已经成为了多种恶性肿瘤的新预后标记物,被认为是有潜力的治疗靶点。肿瘤的增殖发展与细胞的有丝分裂密不可分,细胞的有丝分裂是一个受许多关键调节因子控制的精致而复杂的过程,其中PLK1作为重要的一个调节因子在细胞有丝分裂的不同时期发挥着多种重要作用[8-9]。Pezuk等[10]采用PLK1抑制剂处理成神经管细胞瘤细胞,结果发现PLK1抑制剂可以显著降低细胞增殖、克隆能力、细胞入侵和黏附性,并且显著阻滞细胞于G2/M期,肿瘤细胞凋亡显著增加。本研究应用siRNA沉默AZ521细胞PLK1基因表达,结果显示RNA干扰可显著减少AZ521肿瘤细胞的PLK1 mRNA和蛋白表达;应用流式细胞仪检测细胞周期结果显示PLK1 siRNA组与control组相比,G2/M期细胞明显增多。表明PLK1在胃癌细胞生长增殖过程中起到重要的细胞周期调控作用。
恶性肿瘤的侵袭、转移是恶性肿瘤患者死亡的首要原因,其相关机制是多因素相互作用的复杂过程,包括肿瘤微环境、各种细胞因子和多种信号通路活化等因素。其中上皮-间质转化(epithelialt-mesenchymal transition,EMT)是近年来抗肿瘤领域的研究热点,EMT是指在特定病理状态下肿瘤细胞从上皮表型转变为间质表型,从原发灶脱落经淋巴系统、血液系统或其他转移途径,最终转移至其他部位的过程,这一过程伴随着多种蛋白标志物的改变与相关信号传导通路的活化或抑制。此转化过程中以上皮型钙黏蛋白E-cadherin表达缺失或下调,间质表型蛋白Vimentin、N-cadherin等表达上调以及具有锌指结构的转录因子Snail、slug等活化为特征[11-12]。MMPs是一类在生理和病理过程中能够降解细胞外基质各种成分并重塑细胞外基质的一种蛋白水解酶,其中MMP-9可促进肿瘤细胞对细胞外基质和肿瘤基底膜的浸润力,对肿瘤的侵袭和远处转移起着重要作用,Meta分析显示MMP-9启动子多态性与胃癌关系密切[13]。Jang等[14]研究发现,在结肠癌细胞中敲除MMP-7或使用GM6001抑制MMP-7活性均显着降低了E-cadherin的转变,影响了细胞的脱落。表明MMP-7介导了E-cadherin的转变,进而影响了细胞的上皮间质转化过程及细胞的侵袭转移。
Yan等[15]研究发现PLK1可通过调节STAT3信号促进肺腺癌A549细胞迁移。Wu等[16`]通过对前列腺癌细胞研究发现,PLK1可以通过CRAF/ERK信号传导通路诱导细胞发生EMT过程而促进肿瘤细胞转移。本研究结果显示,沉默PLK1后siRNA组E-cadherin蛋白表达高于control组,Vimentin和MMP-9蛋白表达低于control组。表明PLK1可以通过影响E-cadherin、Vimentin和MMP-9蛋白表达促进胃癌细胞上皮-间质转化,进而影响细胞的侵袭转移。Transwell侵袭实验显示,siRNA组胃癌细胞穿膜细胞数明显少于control组。表明侵袭能力显著降低。
综上所述,PLK1与胃癌细胞周期调控及肿瘤侵袭转移密切相关,可为胃癌的个体化治疗提供一个新的有希望的治疗靶点,但PLK1如何调控胃癌EMT和侵袭转移的详细作用机制还有待下一步研究。
[1] Chen W,Zheng R,Baade PD,et al. Cancer statistics in China,2015[J]. CA Cancer J Clin,2016,66(2):115-132.
[2] TTalati C,Griffiths EA,Wetzler M,et al. Polo-like kinase inhibitors in hematologic malignancies[J]. Crit Rev Oncol Hematol,2016,98:200-210.
[3] Mao F,Li J,Luo Q,et al. Plk1 inhibition enhances the efficacy of BET epigenetic reader blockade in castration-resistant prostate cancer[J]. Mol Cancer Ther,2018,17(7):1554-1565.
[4] Saatci Ö,Borgoni S,Akbulut Ö,et al. Targeting PLK1 overcomes T-DM1 resistance via CDK1-dependent phosphorylation and inactivation of Bcl-2/xL in HER2-positive breast cancer[J]. Oncogene,2018,37(17):2251-2269.
[5] de Boer DV,Martens-de Kemp SR,Buijze M,et al. Targeting PLK1 as a novel chemopreventive approach to eradicate preneoplastic mucosal changes in the head and neck[J]. Oncotarget,2017,8(58):97928-97940.
[6] Cholewa BD,Ndiaye MA,Huang W,et al. Small molecule inhibition of polo-like kinase 1 by volasertib(BI 6727) causes significant melanoma growth delay and regression in vivo[J]. Cancer Lett,2017,385:179-187.
[7] 张小蓓,张保贵.microRNA与胃癌肿瘤干细胞研究进展[J].癌症进展,2018,16(8):929-931,947.
[8] de C rcer G,Venkateswaran SV,Salgueiro L,et al. Plk1 overexpression induces chromosomal instability and suppresses tumor development[J]. Nat Commun,2018,9(1):3012.
rcer G,Venkateswaran SV,Salgueiro L,et al. Plk1 overexpression induces chromosomal instability and suppresses tumor development[J]. Nat Commun,2018,9(1):3012.
[9] Fern ndez-Ace
ndez-Ace ero MJ,Cortés D,Gómez del Pulgar T,et al. PLK-1 expression is associated with histopathological response to neoadjuvant therapy of hepatic metastasis of colorectal carcinoma[J]. Pathol Oncol Res,2016,22(2):377-383.
ero MJ,Cortés D,Gómez del Pulgar T,et al. PLK-1 expression is associated with histopathological response to neoadjuvant therapy of hepatic metastasis of colorectal carcinoma[J]. Pathol Oncol Res,2016,22(2):377-383.
[10] Pezuk JA,Brassesco MS,Ramos PMM,et al. Polo-like kinase 1 pharmacological inhibition as monotherapy or in combination:comparative effects of polo-like kinase 1 inhibition in medulloblastoma cells[J]. Anticancer Agents Med Chem,2017,17(9):1278-1291.
[11] Malgulwar PB,Nambirajan A,Pathak P,et al. Epithelial-to-mesenchymal transition related transcription factors are upregulated in ependymomas and correlate with a poor prognosis[J]. Hum Pathol,2018,82:149-157.
[12] Zidar N,Boštjanĉiĉ E,Malgaj M,et al. The role of epithelial-mesenchymal transition in squamous cell carcinoma of the oral cavity[J]. Virchows Arch,2018,472(2):237-245.
[13] Peng Z,Jia J,Gong W,et al. The association of matrix metalloproteinase-9 promoter polymorphisms with gastric cancer risk:a meta-analysis[J].Oncotarget,2017,8(58):99024-99032.
[14] Jang B,Jung H,Chung H,et al. Syndecan-2 enhances E-cadherin shedding and fibroblast-like morphological changes by inducing MMP-7 expression in colon cancer cells[J]. Biochem Biophys Res Commun,2016,477(1):47-53.
[15] Yan W,Yu H,Li W,et al. Plk1 promotes the migration of human lung adenocarcinoma epithelial cells via STAT3 signaling[J]. Oncol Lett,2018,16(5):6801-6807.
[16] Wu J,Ivanov AI,Fisher PB,et al. Polo-like kinase 1 induces epithelial-to-mesenchymal transition and promotes epithelial cell motility by activating CRAF/ERK signaling[J]. Elife,2016,5.pii:e10734.