多形性腺瘤又称混合瘤,是涎腺肿瘤中最为常见的一种,多发生于腮腺组织。腮腺多形性腺瘤大部分呈结节性缓慢生长,但因其作为一种临界瘤,具有一定的侵袭性,约4%患者具有恶变倾向[1]。近年来有对于多形性腺瘤复发及恶变发病机制的实验研究,认为其可能与相关蛋白基因有一定关系[2]。本研究应用免疫组织化学方法检测腮腺良恶性多形性腺瘤组织中COX-2与Survivin的表达,探讨COX-2与Survivin的相关性,旨在为今后多形性腺瘤患者治疗选择合适个体化治疗方案提供理论支持。
1 资料与方法
1.1 一般资料 选取2010年9月—2014年6月河北省保定市第一中心医院病理科的良恶性多形性腺瘤患者存档石蜡标本84例,其中腮腺多形性腺瘤66例,恶性多形性腺瘤18例。纳入标准为病理学诊断明确,石蜡包埋组织完整,取材前无其他头颈部肿瘤史、无放化疗史或生物学治疗史。
1.2 方法 按照Seifert分型标准将多形性腺瘤标本分为4组。A组,基质丰富型20例;B组,其他型24例;C组,细胞丰富型22例;D组,恶性多形性腺瘤18例。采用免疫组织化学SP法检测各标本中COX-2和Survivin的表达情况。用PBS缓冲液替代一抗作为阴性对照,已知抗体阳性标本作为阳性对照。
1.3 结果判定 视野背景清晰,细胞胞膜、细胞浆、细胞核内呈现棕褐色和(或)棕黄色染色颗粒为阳性,无棕褐色和(或)棕黄色染色者为阴性。COX-2免疫组织化学阳性染色阳性为细胞膜及细胞浆中棕褐色和(或)棕黄色颗粒,偶见细胞核中棕褐色和(或)棕黄色颗粒。 Survivin免疫组织化学阳性染色80%为细胞浆中出现棕褐色或棕黄色颗粒,20%为细胞核中出现棕褐色或棕黄色颗粒。
1.4 统计学方法 应用SPSS 22.0统计软件处理数据。计数资料比较采用χ2检验;相关性采用Spearman相关性分析。P<0.05为差异有统计学意义。
2 结 果
2.1 4组COX-2蛋白阳性表达率比较 COX-2蛋白于肿瘤细胞的细胞浆中阳性表达,偶尔于细胞膜和细胞核中阳性表达。C组和D组COX-2蛋白阳性表达率高于A组(P<0.05),见表1。
2.2 4组Survivin蛋白阳性表达率比较 Survivin蛋白在腺管样导管上皮细胞及黏液样组织中阳性表达,于细胞浆和(或)细胞核中可见棕褐色颗粒状阳性表达。D组Survivin蛋白阳性表达率高于A组(P<0.05),见表2。
2.3 COX-2与Survivin表达的相关性 经Spearman相关性分析,COX-2与Survivin表达呈正相关(rs=0.560,P<0.01),Survivin表达水平越高的组织细胞中,COX-2表达水平增高。
表1 4组COX-2阳性表达率比较
Table 1 Comparison of COX-2 positive expression
rates in four groups (例数,%)
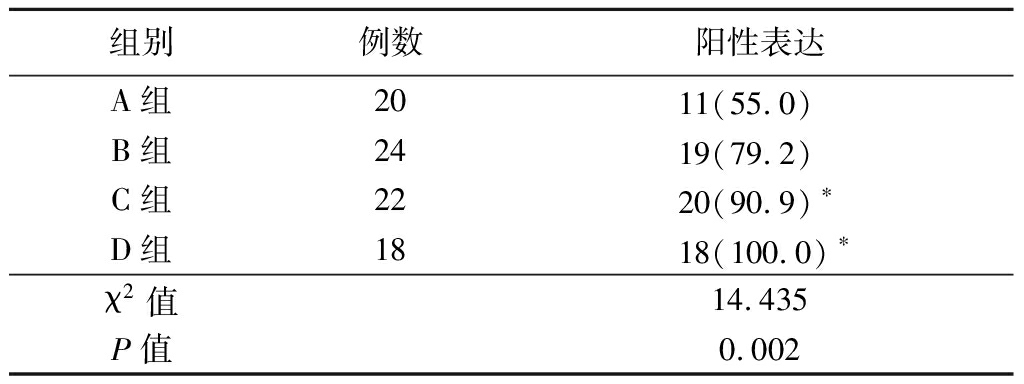
组别例数阳性表达A组2011(55.0) B组2419(79.2) C组2220(90.9)∗D组1818(100.0)∗χ2值14.435P值0.002
*P值<0.05与A组比较(χ2检验)
表2 4组Survivin阳性表达率比较
Table 2 Comparison of Survivin positive expression
rates in four groups (例数,%)

组别例数阳性表达A组2011(55.0) B组2417(70.8) C组2218(81.8) D组1817(94.4)∗χ2值8.664P值0.034
*P值<0.05与A组比较(χ2检验)
3 讨 论
涎腺肿瘤中约有70%发生于腮腺组织,其中良性肿瘤约占85%,而在良性肿瘤中多形性腺瘤占80%[3]。腮腺多形性腺瘤是上皮源性病变的一种良性肿瘤,因其组织形态多样性(富含肌上皮片块、导管样结构、黏液样与软骨样成分)也被称为腮腺混合瘤。腮腺多形性腺瘤治疗以手术切除为主,即便是临床手术治疗成功的患者,仍有 2%~3%复发,且多次复发后易导致癌变[4]。临床中腮腺多形性腺瘤的恶变可构成恶性多形性腺瘤疾病中来源的大部分,约占到90%以上。研究表明,腮腺多形性腺瘤的恶变是一个多因素与多基因变异的过程,除染色体的改变、基因的异常表达外,各种调控因子也从中起到一定的作用[5]。近期研究显示,COX-2和Survivin的阳性表达与多形性腺瘤恶变进展具有协同性,可能成为腮腺多形性腺瘤诊疗中新的生物学指标[6]。
COX-2是环氧合酶家族中的诱导性酶,基因定位于细胞膜,参与细胞诱导性表达[7]。COX-2基因存在于第1号染色体q25.2~q25.3上,全长约为8.3 kb,包含9个内含子与10个外显子,启动子和增强子含多个反应元件。COX-2作为花生四烯酸代谢中的重要限速酶,主要参与肿瘤、炎症等病态组织中前列腺素的合成,其在介导炎症反应与肿瘤发生、发展过程中发挥重要作用[8]。研究表明,COX-2在大多数正常组织中不表达或低表达,而在许多良性癌前病变及恶性肿瘤中存在表达上调[9]。COX-2 在乳腺癌、胰腺癌、肺癌等实体腺性肿瘤中均有相关表达,并且对预后转归存在负面影响[10]。COX-2 与肿瘤的生物学行为及预后有密切相关性,选择性COX-2抑制剂将在肿瘤临床治疗中发挥作用[11]。塞来昔布作为其选择性抑制剂对多种肿瘤组织细胞的增殖有抑制作用,在肿瘤疾病的治疗及化学预防方面存在一定应用的价值[12]。近年来研究实验显示,COX-2在交界性肿瘤与肿瘤病变中的表达明显高于良性肿瘤组织与正常组织,提示了COX-2与癌的早期形成有密切相关[13]。本研究结果表明,COX-2蛋白在腮腺多形性腺瘤A、B、C、D组中阳性表达率分别为55.0%、79.2%、90.9%、100.0%,差异有统计学意义(P<0.05),提示了COX-2在腮腺多形性腺瘤中的良恶性及病理分型中呈正相关。
Survivin做为凋亡抑制家族新成员,与人类肿瘤的发生及发展存在着密切的联系[14]。Survivin基因在正常人体组织中不表达或极少表达,而在肿瘤组织细胞中高表达,提示其既帮助对肿瘤预后的判断,又可作为靶向治疗肿瘤的靶点[15]。其在肿瘤细胞抗凋亡、促进增殖中发挥作用,在多条肿瘤存活信号转导通路中发挥作用[16]。Survivin基因定位在染色体17号q25区上,而且靠近端粒,包含有2个隐性外显子与3个内含子、4个外显子。其主要以抑制Capase3与Capase7的活性途径,达到阻碍细胞凋亡的作用[17]。同时其还可以通过调控G2/M细胞周期,进一步促进肿瘤细胞增殖[18]。Survivin在多种恶性肿瘤中均存在异常的高表达情况[19]。本研究结果显示,Survivin蛋白阳性表达主要见于癌组织细胞浆和(或)细胞核,在D组高度表达, C组、B组、A组中表达逐次降低,差异有统计学意义(P<0.05),提示Survivin蛋白表达与腮腺多形性腺瘤癌变程度以及病理分型有关。
COX-2蛋白与Survivin蛋白在肿瘤的发生、发展过程中具备的功能有不少相似之处,二者均存在局部细胞的凋亡抑制,细胞周期的调控参与、细胞分裂增殖的促进,以及肿瘤血管的生成参与等作用。肺腺癌、结直肠癌、涎腺腺样囊性癌[20-22]中COX-2与Survivin阳性高表达存在相关性。本研究结果显示,COX-2与Survivin在腮腺恶性多形性腺瘤均存在较高阳性表达,而且在恶性多形性腺瘤组与多形性腺瘤分型后各组中表达有差异,推测COX-2和Survivin蛋白在多形性腺瘤发生发展及恶变中可能具有重要作用,并可能与多形性腺瘤的生物学行为存在相关性。
综上所述,COX-2和Survivin蛋白在腮腺多形性腺瘤及恶性多形性腺瘤中表达程度呈正相关,存在协同作用,提示COX-2及Survivin蛋白可能共同参与了腮腺多形性腺瘤发生、发展过程。可将COX-2、Survivin作为潜在的多形性腺瘤标记物进一步深入研究,为临床治疗及预后提供参考依据。
[1] Singh K,Agarwal C,Pujani M,et al.Carcinoma ex pleomorphic adenoma:a diagnostic challenge on cytology[J]. Diagn Cytopathol,2017,45(7):651-654.
[2] 杜柏兴.RAGE与RECK在涎腺多形性腺瘤复发及恶变中的表达及意义[D].乌鲁木齐:新疆医科大学,2017.
[3] Andreasen S,Therkildsen MH,Bjørndal K,et al. Pleomorphic adenoma of the parotid gland 1985-2010:a Danish nationwide study of incidence,recurrence rate,and malignant transformation[J]. Head Neck,2016,38(Suppl 1):E1364-1369.
[4] 邓刚,李晓光,何悦,等.复发性腮腺多形性腺瘤的手术治疗及并发症预防[J].中国口腔颌面外科杂志,2016,24(3):227-230.
[5] 夏亮,田臻.唾液腺多形性腺瘤恶变分子机制研究进展[J].医学综述,2016,22(3):500-504.
[6] 乔柱,赵虎.Survivin与COX-2在腮腺良恶性多形性腺瘤中的表达及意义[J].现代口腔医学杂志,2019,33(4):204-206.
[7] 王铁延,陈修文,汤显斌,等.COX-2和survivin蛋白在非小细胞肺癌中的表达情况及临床意义[J].癌症进展,2018,16(3):375-378.
[8] Hamada T,Cao Y,Qian ZR,et al.Aspirin use and colorectal cancer survival according to tumor CD274(Programmed Cell Death 1 Ligand 1) Expression Status[J]. J Clin Oncol,2017,35(16):1836-1844.
[9] Roseweir AK,Powell AG,Bennett L,et al.Relationship between tumour PTEN/Akt/COX-2 expression,inflammatory response and survival in patients with colorectal cancer[J]. Oncotarget,2016,7(43):70601-70612.
[10] Marutha Muthu AK,Cheah PL,Koh CC,et al. Cyclooxygenase-2(COX2) expression in adenocarcinoma surpasses that of squamous cell carcinoma in the uterine cervix[J]. Malays J Pathol,2017,39(3):251-255.
[11] 阮宁,李文超.COX-2在口腔颌面部上皮性肿瘤中的研究进展[J].现代口腔医学杂志,2017,31(3):169-171.
[12] 石国一,刘玉玲,王敏.VEGF、HIF-1α、COX-2在非小细胞肺癌中的表达及意义[J].河北医科大学学报,2016,37(3):256-259.
[13] Kirkby NS,Chan MV,Zaiss AK,et al. Systematic study of constitutive cyclooxygenase-2 expression:Role of NF-κB and NFAT transcriptional pathways[J]. Proc Natl Acad Sci USA,2016,113(2):434-439.
[14] Rasool I,Afroze D,Wani KA,et al. Role of the functional polymorphism of survivin gene(-31G/C) and risk of breast cancer in a north indian population [J]. Clin Breast Cancer,2018,18(4):e671-676.
[15] 徐芝立,张丽红,张翼,等.RNA干扰肾癌Survivin基因表达降低786-O细胞增殖能力[J].河北医科大学学报,2017,38(11):1283-1286,1291.
[16] Peery RC,Liu JY,Zhang JT. Targeting survivin for therapeutic discovery:past,presen,and future promises[J]. Drug Discov Today,2017,22(10):1466-1477.
[17] 唐恩奇,汪丽燕,李滨,等.ICG-001在肝癌中对凋亡抑制蛋白Survivin的影响[J].安徽医科大学学报,2017,52(2):211-214.
[18] Luo Y,Tong L,Meng H,et al. MiR-335 regulates the chemo-radioresistance of small cell lung cancer cells by targeting PARP-1[J]. Gene,2016,600:9-15.
[19] 杨娇娇,金阿荣.凋亡抑制蛋白survivin在恶性肿瘤中的研究进展[J].内蒙古医学杂志,2017,49(6):679-682.
[20] 代萌,赵晓慧,江玲,等.肺腺癌中survivin和COX-2的表达及其对预后的影响[J].中国冶金工业医学杂志,2018,35(1):93-94.
[21] 刘振兴,梁金龙,杨雪峰,等.Survivin、COX-2和P-gp在结直肠癌中的表达及临床意义[J].现代医药卫生,2018,34(2):171-174.
[22] 李海峰,蒋秋英,卢丽仙,等.涎腺腺样囊性癌组织中COX-2,Survivin及livin的表达及临床意义[J].现代生物医学进展,2017,17(18):3509-3512,3539.