正常成年人的肠道菌群是一个稳定的微生态系统,存在厌氧和兼性需氧菌,其中90%以上为厌氧菌,以双歧杆菌、乳酸杆菌和类杆菌为主;兼性需氧菌以大肠埃希菌和肠球菌为主。正常肠道菌群间相互适应、相互制约,维持动态平衡状态。益生菌的概念被提出以后,其与疾病对机体损伤关系的研究逐渐增多。研究发现,益生菌通过刺激肠道黏膜的分泌功能调节肠道免疫屏障,从而调节机体的免疫功能[1]。炎症反应是烧伤早期重要的病理生理变化,与烧伤病程及严重程度关系密切。轻度炎症反应对伤口愈合有促进作用,过度的炎症反应则损伤组织细胞,甚至引起器官、系统功能障碍[2-5]。严重烧伤损伤浅表皮肤黏膜、肠道黏膜、黏膜下层、平滑肌等,使肠道屏障功能下降,导致肠道细菌移位。研究发现,肠道微生态环境在应用益生菌制剂后能够得到调整,肠道炎症反应得到缓解,可防止有害菌定植繁殖,有效保护肠道屏障功能[6]。抗生素是治疗烧伤感染的主要药物[7],而肠道菌群失调是抗生素治疗常见的并发症,可加重肠道功能紊乱,严重损伤肠道免疫屏障功能,导致肠道菌群入血,加重机体感染和炎症反应。本研究旨在评估益生菌改善重度烧伤炎症反应的疗效。
1 资料与方法
1.1 一般资料 选取2016年9月—2018年9月我院烧伤整形科收治的重度烧伤患者88例,根据是否应用益生菌制剂分为干预组和对照组。干预组33例,男性21例,女性12例;年龄20~60岁,平均(40.56±2.89);火焰烧伤30例,化学烧伤2例,电弧烧伤1例;面颈部躯干及四肢烧伤29例,四肢面颈部烧伤1例,躯干右上肢及双下肢烧1例,面颈躯干臀部烧伤1例,全身多处烧伤1例;30%~35% Ⅱ~Ⅲ度烧伤6例,40%~80% Ⅱ~Ⅲ度烧伤14例,>80%~90% Ⅱ~Ⅲ度烧伤13例。对照组55例,男性35例,女性20例;年龄19~65岁,平均(39.80±3.42)岁;火焰烧伤48例,化学烧伤3例,液化气烧伤2例,沸水烫伤2例;头面颈躯干及四肢15例,头面颈躯干臀部及四肢烧伤10例,面颈躯干及四肢烧伤21例,四肢烧伤4例,全身多处烧伤5例;30%~35% Ⅱ~Ⅲ度烧伤15例,40%~80% Ⅱ~Ⅲ度烧伤30例,>80%~90% Ⅱ~Ⅲ度烧伤10例。2组性别、年龄、烧伤类型、烧伤部位、烧伤面积差异均无统计学意义(P>0.05),具有可比性。
1.2 入选标准和排除标准 入选标准:①年龄≥ 18岁;②烧伤面积 ≥ 30%的重度烧伤患者;③对益生菌制剂耐受;④可以经口服或鼻饲双岐杆菌活菌胶囊。排除标准:①对益生菌制剂不耐受;②妊娠期妇女;③应用糖皮质激素及免疫抑制剂;④合并恶性肿瘤、糖尿病、高血压等相关代谢疾病。
1.3 方法 2组烧伤常规治疗一致,分别于应用益生菌制剂前1 d和应用14 d后清晨空腹抽取静脉血3 mL,检测用药前后血常规和血浆蛋白。
1.4 统计学方法 应用SPSS 16.0统计软件分析数据。计量资料比较分别采用两独立样本的t检验和配对t检验;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 2组用药前后血常规比较 用药前,2组白细胞计数、中性粒细胞百分数、淋巴细胞百分数、单核细胞计数和血小板计数差异均无统计学意义(P>0.05),干预组淋巴细胞计数低于对照组,差异有统计学意义(P<0.05)。用药后,2组白细胞计数、中性粒细胞百分数、淋巴细胞计数均低于用药前,2组淋巴细胞百分数均高于用药前,对照组单核细胞计数和干预组血小板计数均低于用药前,干预组单核细胞计数高于用药前,差异有统计学意义(P<0.05)。用药后,干预组白细胞计数、中性粒细胞百分数、淋巴细胞百分数和血小板计数均低于对照组,单核细胞计数高于对照组,差异有统计学意义(P<0.05)。用药后,2组淋巴细胞计数差异无统计学意义(P>0.05)。见表1。
表1 2组用药前后血常规比较
Table 1 Comparison of blood routine before and after treatment between two groups![]()
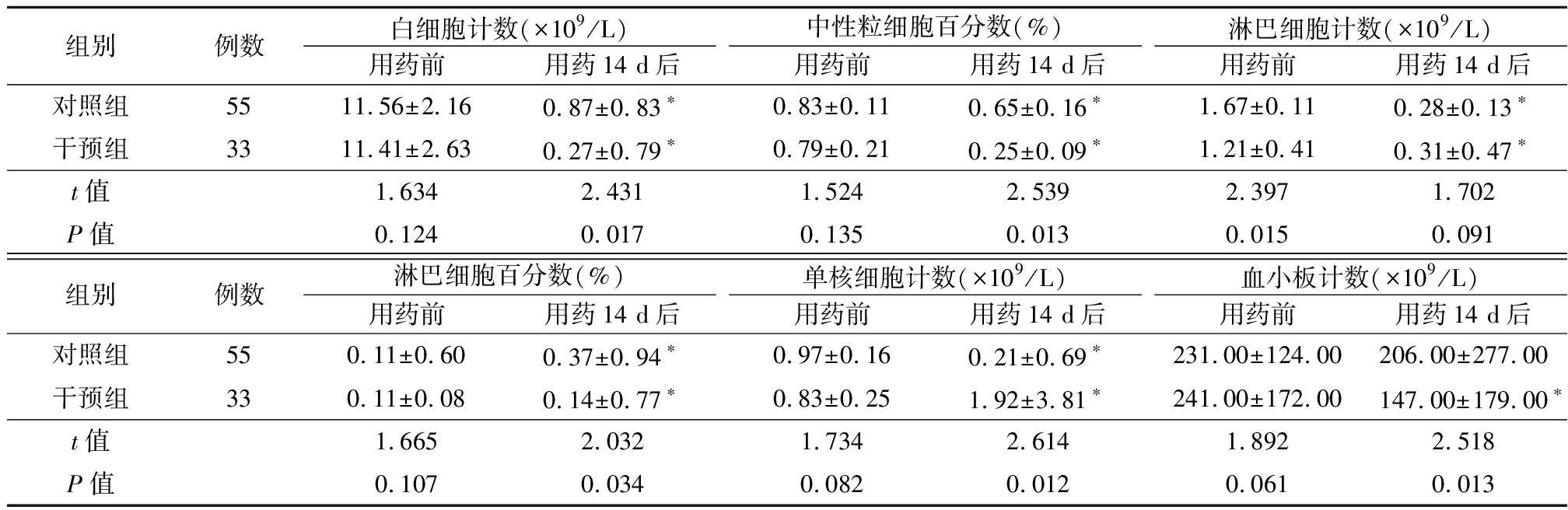
组别例数白细胞计数(×109/L)用药前用药14 d后中性粒细胞百分数(%)用药前用药14 d后淋巴细胞计数(×109/L)用药前用药14 d后对照组5511.56±2.160.87±0.83∗0.83±0.110.65±0.16∗1.67±0.110.28±0.13∗干预组3311.41±2.630.27±0.79∗0.79±0.210.25±0.09∗1.21±0.410.31±0.47∗t值1.6342.4311.5242.5392.3971.702P值0.1240.0170.1350.0130.0150.091组别例数淋巴细胞百分数(%)用药前用药14 d后单核细胞计数(×109/L)用药前用药14 d后血小板计数(×109/L)用药前用药14 d后对照组550.11±0.600.37±0.94∗0.97±0.160.21±0.69∗231.00±124.00206.00±277.00干预组330.11±0.080.14±0.77∗0.83±0.251.92±3.81∗241.00±172.00147.00±179.00∗t值1.6652.0321.7342.6141.8922.518P值0.1070.0340.0820.0120.0610.013
*P值<0.05与用药前比较(配对t检验)
2.2 2组用药前后血浆蛋白比较 用药前,2组总蛋白差异无统计学意义(P>0.05),干预组白蛋白高于对照组(P<0.05)。用药后,干预组白蛋白低于用药前,总蛋白高于用药前,差异均有统计学意义(P<0.05)。用药后,干预组白蛋白高于对照组(P<0.05),总蛋白差异无统计学意义(P>0.05)。见表2。
表2 2组用药前后血浆蛋白比较
Table 2 Comparison of plasma protein before and
after treatment between two groups![]()
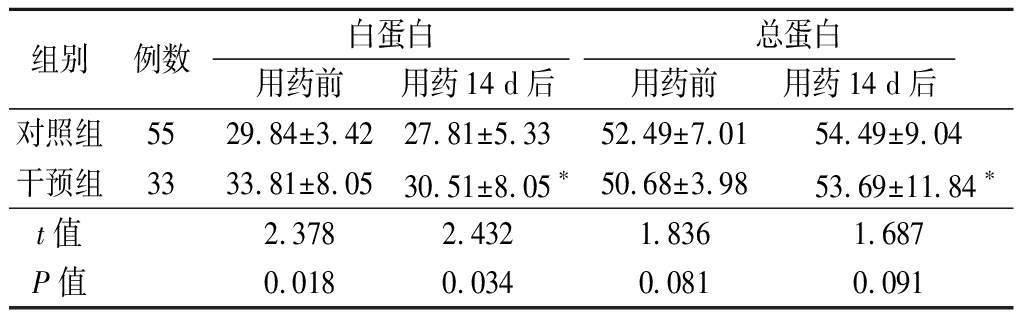
组别例数白蛋白用药前用药14 d后总蛋白用药前用药14 d后对照组5529.84±3.4227.81±5.3352.49±7.0154.49±9.04干预组3333.81±8.0530.51±8.05∗50.68±3.9853.69±11.84∗t值2.3782.4321.8361.687P值0.0180.0340.0810.091
*P值<0.05与用药前比较(配对t检验)
3 讨 论
烧伤是常见的外科疾病,常导致机体体表及全身损害,致伤致残率较高,关节部位的瘢痕组织严重影响日常活动[8]。严重烧伤不仅引起全身应激反应和炎症反应,还威胁生命安全。肠道是人体最大的免疫器官,是严重烧伤后进一步损害的靶器官之一[5,9]。肠道菌群与机体代谢存在明显相关性,能够防御病原微生物,参与肠道免疫功能。肠道菌群与人的生活方式、行为习惯、饮食、疾病情况等密切相关,在不同的个体之间表现出差异性,但其功能不存在差异。烧伤损伤肠道,导致肠道菌群失调,不仅影响肠道免疫功能,而且对全身免疫功能也有重要影响。机体免疫功能损伤会进一步导致自身炎症反应或自身免疫病的产生,诱发或加重烧伤者的并发症,使病程延长[10-11]。应用益生菌制剂能够明显降低机体烧伤后炎症因子水平,减轻后者对机体的损伤,降低严重烧伤者肠道损伤、感染及其他严重并发症的发生率。严重烧伤者使用益生菌制剂的疗效逐渐被发现并加以研究和应用[12]。研究表明,应用益生菌制剂能促进烧伤者的创面愈合,同时在预防和减轻脓毒症以及脓毒症对肠黏膜损伤有积极作用[13-14]。一项关于儿童烧伤的研究表明,益生菌制剂对烧伤后炎症反应和氧化应激所致的肠道免疫功能损伤具有保护作用,能够保护肠黏膜完整性,增强肠道免疫功能[15]。益生菌制剂调节肠道黏膜的作用主要表现在:①增强肠道黏膜的机械屏障,主要通过抑制肠上皮细胞的凋亡,减轻炎症因子等的进一步损伤,增强机械屏障作用;②增强肠道黏膜的生物屏障,促进有益菌群的生长繁殖,防止致病菌的定殖生长,保护肠道微环境的动态平衡;③增强肠道黏膜化学屏障,通过促进肠道上皮细胞的分泌功能,增加细菌素和防御素的分泌,抑制外源微生物和致病菌的入侵[9,16]。
本研究结果显示,应用益生菌制剂14 d后干预组和对照组相比,白细胞计数、中性粒细胞百分数、淋巴细胞百分数、淋巴细胞百分数和血小板计数均明显降低(P<0.05),淋巴细胞计数无明显变化(P>0.05),白蛋白差异有统计学意义(P<0.05),总蛋白差异无统计学意义(P>0.05)。表明益生菌制剂可明显降低机体的炎症反应以及炎症反应对机体的损伤,可有效降低烧伤者肠道感染及其他并发症。在一项动物实验研究中,研究者发现在对烧伤大鼠肠道炎症和氧化应激反应治疗中联合使用谷氨酰胺和益生菌,其治疗效果比单独应用二者更有效,二者存在协同作用[9]。这对临床联合使用谷氨酰胺和益生菌治疗烧伤造成的肠道炎症反应有积极的指导作用。
烧伤作为常见的外科疾病,可发生多种并发症,从而引起机体进一步损害。肠道作为第一大免疫器官,其免疫功能特性和其独特的微生态环境动态平衡保证了肠道的正常功能。烧伤后炎症反应引起的肠道损害对烧伤修复及康复是不利的,及时恢复烧伤者的肠道功能至关重要。本研究结果显示益生菌制剂对烧伤后肠道免疫功能和肠道微生态恢复有明显的促进作用,能降低机体的炎症水平,减轻肠道的炎症反应,值得临床推广应用。
[1] 张鑫,郭军.益生菌与肠道黏膜免疫研究进展[J].畜牧与饲料科学,2017,38(11):58-64.
[2] 曾勇,李小英,蒋秋萍,等.严重烧伤病人血流感染的流行病学特点及死亡危险因素分析[J].医学动物防制,2019,35(10):927-931.
[3] O′Dea KP,Porter JR,Tirlapur N,et al. Circulating microvesicles are elevated acutely following major burns injury and associated with clinical severity[J]. PLoS One,2016,11(12):e0167801.
[4] Wang Z,Chen R,Zhu Z,et al. Effects of insulin combined with ethyl pyruvate on inflammatory response and oxidative stress in multiple-organ dysfunction syndrome rats with severe burns[J]. Am J Emerg Med,2016,34(11): 2154-2158.
[5] Dickerson RN,van Cleve JR,Swanson JM,et al. Vitamin D deficiency in critically ill patients with traumatic injuries[J]. Burns Trauma,2016,4:28.
[6] Saraf MK,Herndon DN,Porter C,et al. Morphological changes in subcutaneous white adipose tissue after severe burn injury[J]. J Burn Care Res,2016,37(2): e96-103.
[7] 吴东凯.烧伤治疗中抗生素的应用探讨[J].中国实用医药,2019,14(1):127-128.
[8] 陈军艳,张立.烧伤后瘢痕预防方式分析[J].中国处方药,2017,15(11):123-124.
[9] Gong ZY,Yuan ZQ,Dong ZW,et al. Glutamine with probiotics attenuates intestinal inflammation and oxidative stress in a rat burn injury model through altered iNOS gene aberrant methylation[J]. Am J Transl Res,2017,9(5):2535-2547.
[10] 焦禹豪,陈蓓迪,张烜.肠道菌群在天然免疫系统中的作用[J].协和医学杂志,2019,10(3):257-262.
[11] Kundu P,Blacher E,Elinav E,et al. Our gut microbiome: the evolvinginner self[J]. Cell,2017,171(7):1481-1493.
[12] 庄小捷,刘毅,陈金平.益生菌制剂配合卡那霉素与甲硝唑预防结直肠癌患者术后感染的疗效及其对炎症因子水平的影响[J].抗感染药学,2018,15(3):540-542.
[13] Argenta A,Satish L,Gallo P,et al. Local application of probiotic bacteria prophylaxes against sepsis and death resulting from burn wound infection[J]. PLoS One,2016,11(10):e0165294.
[14] 马磊,王高飞,吴嘉荔,等.益生菌和丙氨酰谷氨酰胺联合应用对脓毒症患者肠道黏膜屏障的保护作用[J].宁夏医科大学学报,2018,40(9):1035-1038.
[15] El-Ghazely MH,Mahmoud WH,Atia MA,et al. Effect of probiotic administration in the therapy of pediatric thermal burn[J]. Ann Burns Fire Disasters,2016,29(4):268-272.
[16] 郄素会,潘颖,高丽洁.益生菌对肠道黏膜免疫的调节作用[J].临床合理用药杂志,2016,9(14):179-181.