在我国,皮肤癌已经位居于肿瘤发病率的第8位[1],严重威胁着大众的健康[2-3]。去甲斑蝥素(norcantharidin,NCTD)是一种新型开发的治癌药物,对多种癌症具有较好的疗效[4-6]。药物的抗肿瘤作用多是通过影响细胞增殖周期达到抑制肿瘤生长的目的[7-9],且药物通过激活活性氧(reactive oxygen species,ROS)诱导细胞凋亡而达到治疗癌症的目的[10-14]。本研究采用流式细胞术分析NCTD对人黑色素瘤A375细胞周期、ROS自由基生成及细胞凋亡的影响,旨在为进一步阐明NCTD的抗肿瘤作用机制提供实验依据。
1 材料与方法
1.1 细胞株来源 人A375黑色素瘤细胞株,来源于中国科学院上海细胞研究所。
1.2 试剂和实验仪器 胰酶、胎牛血清、RPMI1640培养基(美国Gibco公司),胰酶、5-FU、DMSO、DCFH-DA、碘化丙啶(美国Sigma公司),PBS片剂(上海生工生物工程有限公司),RIPA蛋白裂解液及5×xloading buffer、活性氧检测试剂盒、Annexin V-FITC细胞凋亡检测试剂盒(上海碧云天公司),ECL发光试剂(Thermo fisher,美国),一抗Cyclin D1、Cyclin A、P21、CDK2、β-actin、二抗,AKT(Santa Cruz,美国),其他试剂为分析纯试剂;NCTD(美国Sigma公司);CO2细胞培养箱(Thermo fisher,美国),超净工作台(Air Tech,日本),Countstar 自动细胞技术仪(Inno-Alliance Biotech,美国),FACS Canto Ⅱ流式细胞仪(BD,美国),多功能酶标仪(BioTek,美国)等。
1.3 人A375黑色素瘤细胞的培养 用含10%牛血清的RPMI 1640培养基,培养基使用前用37 ℃水浴预温。在5% CO2细胞孵箱中培养,当培养基颜色偏黄的时候,需要更换细胞的培养液,将超净工作台用紫外线照射杀菌后,弃去原培养基,用PBS洗涤1次后,重新加入37 ℃水浴预温的培养基中,并置于5% CO2细胞孵箱中培养。待细胞密度达到80%融合状态时,需要对其进行传代,加入0.25%胰蛋白酶,对其进行消化,约每瓶105个细胞传代到25 cm2,3 d传代1次。
1.4 人A375黑色素瘤细胞周期的测定 采用流式细胞术,取对数生长期细胞消化,调整为5×104个/mL,取100 μL接种于96孔板内,5% CO2孵箱中培养24 h后给予不同剂量NCTD。设空白对照组和10,20,40 μmol/L NCTD给药组。置于5% CO2孵箱中分别培养48 h,加入0.25%胰酶溶液消化,培养基重悬。用PBS洗涤2次后,用70%乙醇固定,过夜,12 000 g 离心10 min,用PBS洗涤3次,加入碘化丙啶与RNA酶,室温暗处静置30 min,上流式细胞仪完成检测。
1.5 NCTD对人A375黑色素瘤Cyclin D1、Cyclin A、P21、CDK2表达的影响 采用Western-blot法,取对数生长期细胞消化,调整为5×104 个/mL,取100 μL接种于96孔板内,设空白对照组和40 μmol/L NCTD给药组。5%CO2孵箱中培养24 h后给予40 μmol/L NCTD。置于5%CO2孵箱中分别培养48 h后,吸弃培养液消化细胞,用PBS洗涤2次后,冰上放置,加入预冷的RIPA细胞裂解液,充分混匀,冰上静置30 min,12 000 g 离心10 min,取上清液,Bio-Rad 法蛋白定量后调整为一致的蛋白浓度。加入2×SDS上样缓冲液,煮沸10 min使蛋白变性,配制12% SDS聚丙酰胺凝胶,每孔上样预先制备好的样品等量蛋白,电泳分离后转膜,转移至硝酸纤维素膜,用5%脱脂牛奶在摇床上封闭2 h,加入稀释过的一抗4 ℃ 孵育过夜。用TBS洗涤3次后,加入稀释过的辣根过氧化物酶标记的二抗,37 ℃避光孵育1 h,用TBS洗涤3次,用化学发光法检测相应蛋白条带的灰度值,各实验组与内参的比值为相应蛋白的表达量。
1.6 人A375黑色素瘤细胞ROS的测定 采用流式细胞术,取对数生长期细胞消化,调整为5×104个/mL,取100 μL接种于96孔板内,5%CO2孵箱中培养24 h后给予不同剂量NCTD。设空白对照组和10,20,40 μmol/L NCTD给药组。置于5% CO2孵箱中分别培养48 h,吸弃培养液消化细胞,用PBS洗涤2次后,收集细胞,加入2 μL终浓度为10 μmol/L的DCFH-DA溶液, 37 ℃孵育箱中继续孵育15 min,PBS洗涤2次,用流式细胞仪检测ROS的平均荧光强度,激发波长为488 nm,发射波长为530 nm。由于DCFH-DA进入细胞内,在细胞内酯酶的作用下转变为DCFH,被细胞内的ROS氧化,生成DCF,DCF是一种能发出绿色荧光的荧光物质。因此,根据细胞内的荧光强度就可以测出细胞内的ROS量。结果用荧光强度百分比表示。
1.7 人A375黑色素瘤细胞凋亡水平的测定 采用流式细胞术,取对数生长期细胞消化,调整为5×104个/mL,取100 μL接种于96孔板内,5% CO2孵箱中培养24 h后给予不同剂量NCTD。设空白对照组和10,20,40 μmol/L NCTD给药组。置于5% CO2孵箱中分别培养48 h后,吸弃培养液消化细胞,PBS洗涤2次,收集细胞,加入bingding solution, 重悬细胞,取100 μL 细胞液,加入Annexin V 10 μL ,再加入碘化丙啶5 μL。充分混匀后,室温避光静置15 min,加入bingding solution,充分混匀后,上流式细胞仪测定。
1.8 ROS清除剂N-乙酰半胱氨酸对NCTD诱导人A375黑色素瘤细胞凋亡的影响 取对数生长期细胞消化,调整为5×104个/mL,取100 μL接种于96孔板内,5% CO2孵箱中培养24 h后给予不同剂量NCTD。设空白对照组(0 μmol/L NCTD组)、2 mmol/L N-乙酰半胱氨酸组(NAC组)、40 μmol/L NCTD组(NCTD组)和2 mmol/L N-乙酰半胱氨酸+40 μmol/L NCTD组(NAC+NCTD组)。置于5% CO2孵箱中分别培养48 h后,采用流式细胞术测定细胞凋亡水平。
1.9 统计学方法 应用GraphPad Prism 5.0统计软件(San Diego California USA)分析数据。计量资料比较分别采用两独立样本的t检验、F检验和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 NCTD对人A375黑色素瘤细胞周期的影响 采用流式细胞术分析不同浓度NCTD作用在人A375黑色素瘤细胞48 h后细胞周期改变。10,20,40 μmol/L NCTD组G1期细胞比例高于对照组,S期细胞比例低于对照组,20,40 μmol/L NCTD组G2期细胞比例低于对照组,20,40 μmol/L NCTD组G1期细胞比例高于10 μmol/L NCTD组,S期和G2期细胞比例低于10 μmol/L NCTD组,40 μmol/L NCTD组G1期细胞比例高于20 μmol/L NCTD组,S期和G2期细胞比例低于20 μmol/L NCTD组,差异均有统计学意义(P<0.05),见表1。
表1 4组A375 细胞周期分布情况比较
Table 1 Comparison of A375 cell cycle
distribution in 4 groups![]()
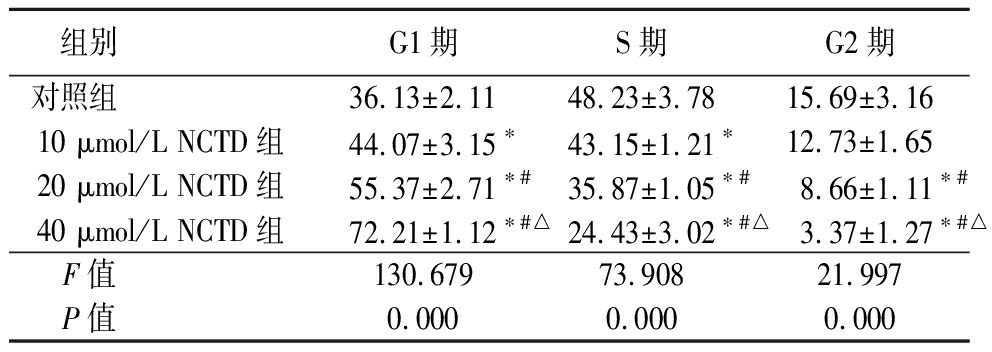
组别 G1期S期G2期对照组 36.13±2.1148.23±3.7815.69±3.1610 μmol/L NCTD组44.07±3.15∗43.15±1.21∗12.73±1.6520 μmol/L NCTD组55.37±2.71∗#35.87±1.05∗#8.66±1.11∗#40 μmol/L NCTD组72.21±1.12∗#△24.43±3.02∗#△3.37±1.27∗#△F值 130.67973.90821.997P值 0.0000.0000.000
*P值<0.05与对照组比较 #P值<0.05与10 μmol/L NCTD组比较 △P值<0.05与20 μmol/L NCTD组比较(SNK-q检验)
2.2 NCTD对人A375黑色素瘤Cyclin D1、P21、Cyclin A和CDK2表达的影响 经Western blot 检测,40 μmol/L NCTD组处理人A375黑色素瘤细胞48 h后,Cyclin D1、Cyclin A和CDK2低于对照组,P21蛋白高于对照组,差异均有统计学意义(P<0.05),见表2。
表2 40 μmol/L NCTD作用48 h后对A375细胞周期蛋白Cyclin D1、P21、Cyclin A和CDK2表达的影响
Table 2 Effect of 40μmo/L NCTD on the expression of Cyclin D1,P21,Cyclin A,CDK2 in A375 cells![]()
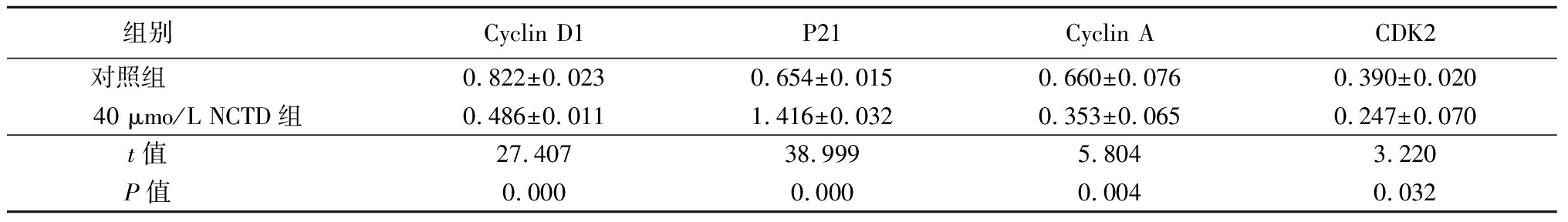
组别 Cyclin D1P21Cyclin ACDK2对照组 0.822±0.0230.654±0.0150.660±0.0760.390±0.02040 μmo/L NCTD组0.486±0.0111.416±0.0320.353±0.0650.247±0.070t值 27.40738.9995.8043.220P值 0.0000.0000.004 0.032
2.3 NCTD对人A375黑色素瘤细胞ROS的影响 不同NCTD处理人A375黑色素瘤细胞48 h后,采用流式细胞术检测不同浓度NCTD作用在人A375黑色素瘤细胞ROS的水平。10,20,40 μmol/L NCTD组细胞内ROS水平高于对照组,20,40 μmol/L NCTD组细胞内ROS水平高于10 μmol/L NCTD组,40 μmol/L NCTD组细胞内ROS水平高于20 μmol/L NCTD组,差异均有统计学意义(P<0.05),见表3。
2.4 NCTD对人A375黑色素瘤细胞凋亡水平的影响 不同NCTD处理人A375黑色素瘤细胞48 h后,采用流式细胞术检测人A375黑色素瘤细胞凋亡水平。10,20,40 μmol/L NCTD组细胞凋亡率高于对照组,20,40 μmol/L NCTD组细胞凋亡率高于10 μmol/L NCTD组,40 μmol/L NCTD组细胞凋亡率高于20 μmol/L NCTD组,差异均有统计学意义(P<0.05),见表4。
表3 不同浓度NCTD对A375细胞ROS水平的影响
Table 3 Effect of different concentration of NCTD
on ROS levels in A375 cells![]()
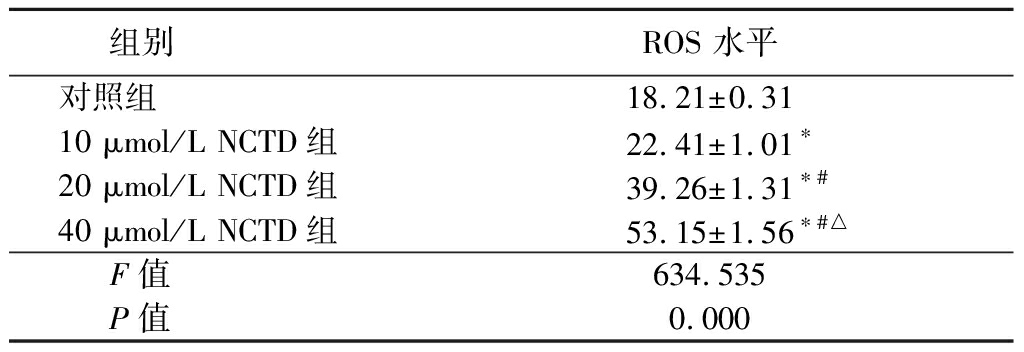
组别ROS 水平对照组18.21±0.3110 μmol/L NCTD组22.41±1.01∗20 μmol/L NCTD组39.26±1.31∗#40 μmol/L NCTD组53.15±1.56∗#△F值634.535P值0.000
*P值<0.05与对照组比较 #P值<0.05与10 μmol/L NCTD组比较 △P值<0.05与20 μmol/L NCTD组比较(SNK-q检验)
表4 不同浓度NCTD对A375细胞凋亡水平的影响
Table 4 Effect of different concentration of NCTD
on apoptosis in A375 cells![]()
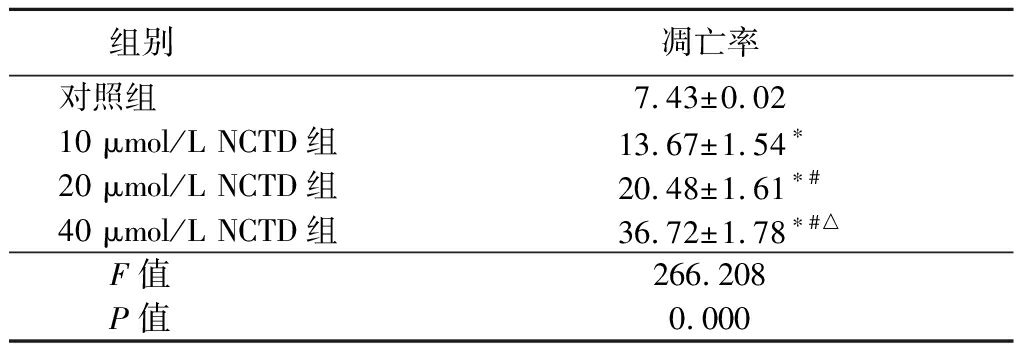
组别凋亡率对照组7.43±0.0210 μmol/L NCTD组13.67±1.54∗20 μmol/L NCTD组20.48±1.61∗#40 μmol/L NCTD组36.72±1.78∗#△F值266.208P值0.000
*P值<0.05与对照组比较 #P值<0.05与10 μmol/L NCTD组比较 △P值<0.05与20 μmol/L NCTD组比较(SNK-q检验)
2.5 ROS清除剂N-乙酰半胱氨酸对NCTD诱导人A375黑色素瘤细胞凋亡的影响 NAC组细胞凋亡率低于对照组,NCTD组和NAC+NCTD组细胞凋亡率高于对照组,NAC+NCTD组细胞凋亡率低于NCTD组,差异均有统计学意义(P<0.05),见表5。
表5 N-乙酰半胱氨酸对NCTD诱导人A375黑色素瘤
细胞凋亡的影响
Table 5 Effect of NCTD and NAC on apoptosis
in A375 cells![]()
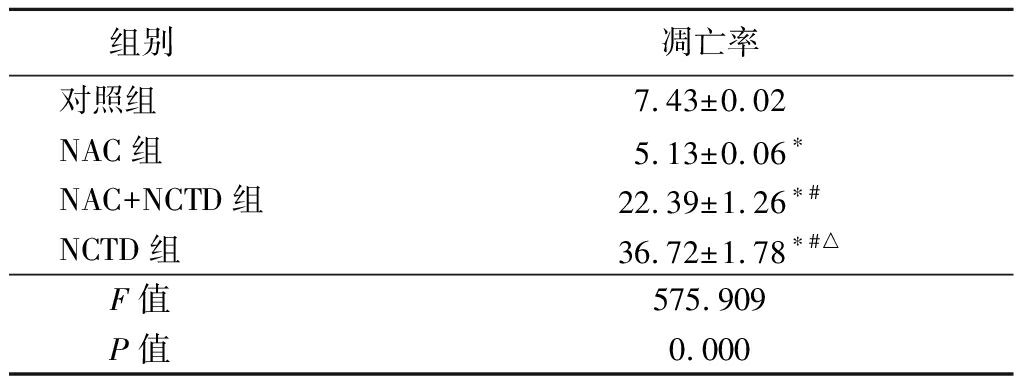
组别凋亡率对照组7.43±0.02NAC组5.13±0.06∗NAC+NCTD组22.39±1.26∗#NCTD组36.72±1.78∗#△F值575.909P值0.000
*P值<0.05与对照组比较 #P值<0.05与10 μmol/L NCTD组比较 △P值<0.05与20 μmol/L NCTD组比较(SNK-q检验)
3 讨 论
皮肤黑色素瘤作为一种高度恶性的皮肤肿瘤,进展快,恶性程度高,转移发生早,病死率高,已受到广泛的关注。因此,研究新的治疗药物及其作用机制是目前黑色素瘤研究的焦点。
NCTD是我国新型开发的治癌药物,具有升高白细胞、提高免疫力、不良反应小、抗癌活性高的优势[15-16]。既往研究显示,NCTD可抑制多种癌细胞,其机制包括可诱导细胞发生凋亡、调控癌基因表达、调控细胞周期等[17-21]。NCTD对人黑色素瘤A375有明显的抑制作用,并呈时间和浓度依赖性。低浓度(10 μmol/L)NCTD可抑制人A375黑素瘤细胞的增殖活性,而对人A375黑素瘤细胞黑色素合成及酪氨酸酶活性没有明显影响;高浓度(20~80 μmol/L)NCTD可抑制人A375黑素瘤细胞的黑色素合成及酪氨酸酶活性。本研究采用流式细胞术分析不同浓度NCTD作用在人A375黑色素瘤细胞48 h后细胞周期改变,结果显示NCTD可调节人A375黑色素瘤细胞周期进程,使黑色素瘤细胞阻滞于G1期,且呈剂量依赖性;同时S期细胞数明显减少,表明NCTD具有调节G1期的能力。G1期是DNA的合成前期,此期细胞内进行着一系列极为复杂的生物合成,如合成各种RNA和核蛋白体。所以,G1期是细胞进入合成期的关键,当G1期受到阻滞,直接阻碍DNA的合成,导致细胞增殖受到抑制。说明NCTD很可能是通过诱导G1期阻滞而发挥抑制黑色素瘤细胞增殖作用的。本研究Western blot 检测结果显示,药物干扰后 Cyclin D1表达受到抑制,而P21表达增加,同时细胞Cyclin A和CDK2表达降低。有研究表明,Cyclin D1是细胞周期的启动因子,在G1期早期表达,若Cyclin D1持续高表达,会导致细胞G1期缩短,提前进入S期,使细胞增殖[17];Cyclin D1促进肿瘤细胞的增殖,使肿瘤组织向四周浸润和转移,P21则抑制信号冲动的传导,起到阻断细胞增殖,抑制细胞生长的负调控作用[22] 。当Cyclin D1含量减少,使细胞在G1期受阻,因而抑制了细胞的增殖。此外,当细胞从G1期进入S期时,Cyclin A与CDK2结合,Cyclin A/CDK2复合物的数量增加,启动DNA复制。而Cyclin A/CDK2的表达受到抑制。这可能正是NCTD抑制人A375皮肤黑色素瘤增殖的机制。
本研究采用流式细胞术分析不同浓度NCTD作用在人A375黑色素瘤细胞48 h后ROS水平的改变,结果显示10~40 μmol/L NCTD作用在人A375黑色素瘤细胞48 h后,ROS水平明显高于对照组,且呈剂量依赖性,差异有统计学意义(P<0.05)。文献报道,ROS水平作为细胞的第二信使促进细胞增殖、调控细胞增长,但是过高的ROS水平会使细胞因氧化过度而受损,导致细胞凋亡[12] 。本研究采用流式细胞术分析不同浓度NCTD作用在人A375黑色素瘤细胞48 h后凋亡水平的改变,结果发现人A375黑色素瘤细胞的凋亡率随着药物浓度的增加而增加,差异有统计学意义(P<0.05)。本研究观察ROS清除剂N-乙酰半胱氨酸对NCTD诱导人A375黑色素瘤细胞凋亡的影响,发现使用ROS清除剂N-乙酰半胱氨酸后,NCTD诱导人A375黑色素瘤细胞凋亡明显有所降低(P<0.05)。表明N-乙酰半胱氨酸可以减弱NCTD诱导人A375黑色素瘤细胞凋亡的作用,说明NCTD可能通过诱导ROS水平升高诱导细胞凋亡。
总之,NCTD通过阻滞细胞G1周期抑制人A375黑色素瘤细胞的增殖,通过诱导ROS水平升高诱导细胞凋亡。NCTD在黑色素瘤的治疗领域具有一定的发展前景,有待进行更深入的研究。
[1] Hamilton K,Kirkpatrick A,Rebar A,et al. Protecting young children against skin cancer:parental beliefs,roles,and regret[J]. Psycho,2017,26(12):2135-2141.
[2] Li D,Lin B,Yusuf N,et al. Proteomic analysis and functional studies of baicalin on proteins associated with skin cancer[J]. Am J Chin Med,2017,45(3):599-614.
[3] Wang H,Zhang Y,Yun H,et al. ERK expression and its correlation with STAT1 in esophageal squamous cell carcinoma[J]. Oncotarget,2017,8(28):45249-45258.
[4] 王天阳,王文斌,边伟,等.去甲斑蝥素对胆管癌RBE细胞α-Tubulin骨架蛋白及细胞周期的影响[J/CD].中华临床医师杂志:电子版,2013,7(21):9581-9585.
[5] 王天阳,吕海涛,李猛,等.去甲斑蝥素诱导胆管癌细胞凋亡及对bax、bcl-2、半胱天冬酶3和细胞色素C凋亡相关因子影响[J].河北医科大学学报,2013,34(12):1509-1512.
[6] Liu Y,Zhang J,You Z,et al. Inhibitory effect of norcantharidin combined with evodiamine on the growth of human hepatic carcinoma cell line Hep G2 in vitro[J]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi,2014,30(8):824-828.
[7] Chen Z,Zhang B,Gao F,et al. Modulation of G2/M cell cycle arrest and apoptosis by luteolin in human colon cancer cells and xenografts[J]. Oncol Lett,2018,15(2):1559-1565.
[8] Diwanji N,Bergmann A. An unexpected friend-ROS in apoptosis-induced compensatory proliferation:implications for regeneration and cancer[J]. Semin Cell Dev Biol,2018,80:74-82.
[9] Chio IIC,Tuveson DA. ROS in cancer:the burning question[J]. Trends Mol Med,2017,23(5):411-429.
[10] 杜峥,王巍,路军,等.白藜芦醇对CoCl2诱导H9C2心肌细胞损伤的保护作用研究[J].河北医科大学学报,2018,39(8):877-811,886.
[11] Zheng X,Zhou J,Tan DX,et al. Melatonin improves waterlogging tolerance of malus baccata(linn.) borkh. seedlings by maintaining aerobic respiration,photosynthesis and ROS migration[J]. Front Plant Sci,2017,8:483.
[12] 黎莉莉,董芳蕊,臧诗蕾,等.活性氧对肿瘤双向调节作用的研究进展[J].中国临床药理学杂志,2017,19(33):1993-1996.
[13] 谢丽霞,叶小群.线粒体活性氧与肿瘤的研究进展[J].重庆医学,2017,46(11):1558-1562.
[14] Galadari S,Rahman A,Pallichankandy S,et al. Reactive oxygen species and cancer paradox:to promote or to suppress?[J]. Free Radic Biol Med,2017,104:144-164.
[15] 陈杰,陈百芳,刘新光,等.去甲斑蝥素对人皮肤鳞状细胞癌A431细胞侵袭转移能力的影响[J].中药新药与临床药理,2017,28(1):27-31.
[16] Zhao Q,Qian Y,Li R,et al. Norcantharidin facilitates LPS-mediated immune responses by up-regulation of AKT/NF-κB signaling in macrophages[J]. PLoS One,2012,7(9):e44956.
[17] Du HF,Meng YF,Lv HY,et al. Norcantharidin enhances bortezomib-antimyeloma activity in multiple myeloma cells in vitro and in nude mouse xenografts[J]. Leuk Lymphoma,2013,54(3):607-618.
[18] Ren J,Li G,Zhao W,et al. Norcantharidin combined with ABT-737 for hepatocellular carcinoma:therapeutic effects and molecular mechanisms[J]. World J Gastroenterol,2016,22(15):3962-3968.
[19] 曹素芬,谢琴,陈奕,等.5H-苯并[b]咔唑类化合物的合成与肿瘤细胞增殖抑制活性[J].中国药科大学学报,2017,48(2):157-166.
[20] 闫爽,高孟婷,郑园园,等.美洲大蠊、斑蝥提取物对3株人肿瘤细胞增殖抑制作用的研究[J].中国民族民间医药,2017,26(10):33-37.
[21] 张志凌,徐军,杨宝华,等.抗肿瘤药物雷帕霉素调控子宫内膜癌细胞增殖、分化、凋亡的研究机制[J].临床和实验医学杂志,2017,16(11):1066-1070.
[22] 张明明,檀碧波,卢亚敏,等.结直肠癌组织中Vav1、Rac1、CyclinD1、p21表达的意义[J].肿瘤学杂志,2016,22(9):708-712.