随着社会发展,精神失常的发病率逐年升高,精神失常患者手术的麻醉管理也备受重视。精神失常患者长期服用抗精神药品或抗抑郁药会对各个系统的功能产生影响,并且某些抗精神失常药物与麻醉药物有协同或拮抗作用,故精神失常患者的手术麻醉管理要求较高。其中精神分裂症属于精神失常的一种常见疾病。右美托咪定是一种高选择性α2肾上腺素能受体激动剂,具有抗焦虑、镇痛、镇静作用,还可减少围术期各种有害刺激引起的应激反应,维持患者血流动力学稳定,可抑制炎症反应,具有器官保护功能[1-2]。目前右美托咪定用于精神分裂症患者全身麻醉手术的效果有待明确。本研究拟观察右美托咪定用于精神分裂症患者全身麻醉围手术期的临床效果,以期提高精神分裂症患者麻醉管理质量。
1 资料与方法
1.1 一般资料 收集2016年2月—2018年12月我院收治的精神分裂症行择期手术患者60例,美国麻醉协会(American Society of Anesthesiologists,ASA)分级Ⅰ~Ⅱ级,均有长期服用抗精神病药物史。排除标准:①对右美托咪定过敏者;②严重心、肺、肝、肾和代谢性疾病患者;③严重休克、严重脱水和电解质紊乱患者;④神经-肌肉系统疾病患者;⑤使用单胺氧化酶抑制剂者。采用随机数字表法将患者分为右美托咪定组(Dex组)和对照组(NS组)各30例。Dex组男性12例,女性18例,年龄40~63岁,平均(54.03±6.75)岁,体重指数20.6±0.6;NS组男性13例,女性17例,年龄40~63岁,平均(53.17±7.60)岁,体重指数20.4±0.7。2组性别、年龄、体重指数、差异均无统计学意义(P>0.05),具有可比性。
本研究经医院医学伦理委员会批准通过;所有患者或家属签署知情同意书。
1.2 方法 麻醉前均不使用镇静、镇痛药及抗胆碱药物,开放外周上肢静脉通路,常规监测血压、心电图、脉搏血氧饱和度、体温、脑电双频谱指数(bispectral index,BIS)。麻醉诱导前Dex组10 min内输注完成1 μg/kg右美托咪定(浓度为4 μg/mL),随后改为0.4 μg·kg-1·h-1输注至术毕。NS组输注等容量生理盐水。麻醉诱导:2组均采用咪达唑仑0.02 mg/kg、舒芬太尼0.3 μg/kg,苯磺酸顺阿曲库铵0.15 mg/kg,依托咪酯0.2~0.3 mg/kg进行麻醉诱导。气管插管后连接麻醉机进行机械通气,设定吸呼比1∶2,潮气量6~8 mL/kg,通气频率12次/min,氧流量2 L/min,吸入气中的氧浓度分数100%,维持呼末二氧化碳分压35~45 mmHg(1 mmHg=0.133 kPa),术中应用Aspect-2000型脑电活动监测仪测定患者BIS值,调节丙泊酚浓度维持BIS值在40~60之间。术中持续泵入瑞芬太尼0.1~0.15 μg·kg-1·min-1和丙泊酚5~6 mg·kg-1·h-1苯磺酸顺阿曲库铵0.3~0.6 mg·kg-1·h-1维持麻醉。手术结束前5 min停用丙泊酚,手术终止时停用瑞芬太尼。麻醉过程中,若发生低血压,适当加快输液,必要时静脉注射麻黄碱6~10 mg,若心率<50次/min,静脉注射阿托品0.3 mg。
1.3 观察指标 ①观察2组麻醉诱导前(T1)、气管插管即刻(T2)、切皮时(T3)、手术结束时(T4)的平均动脉压(mean artery pressure,MAP)。②采集2组麻醉诱导前(T1)、切皮时(T3)、手术结束时(T4)外周静脉血,离心后取血清,采用酶联免疫吸附测定法检测超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)、白细胞介素10(interleukin-10,IL-10)水平,采用放射免疫法检测皮质醇(cortisol,Cor)含量。③记录2组拔管后10 min(T5)、拔管后20 min(T6)时Ramsay镇静评分(Ramsay Sedative Score,RSS)和躁动评分(Restlesshess Score,RS)。RSS标准:1分,焦虑和躁动或坐卧不安,或两者兼有;2分,安静合作,定向准确;3分,嗜睡,唤醒后对指令反应敏捷;4分,睡眠状态,但可唤醒;5分,呼之反应迟钝;6分,深睡状态,呼唤不醒。RS标准:0分,安静且合作;1分,吸痰刺激时有肢体活动;2分,无刺激时有挣扎,但无需按压;3分,挣扎剧烈,需按压。
1.4 统计学方法 应用SPSS 22.0统计软件分析数据。计量资料比较分别采用两独立样本的t检验和重复测量的方差分析;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 2组不同时点MAP比较 Dex组MAP水平呈先降低后升高趋势,NS组MAP水平逐渐升高,Dex组MAP水平低于NS组,其组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05),见表1。
表1 2组不同时点MAP比较
Table 1 Comparison of MAP between two groups
at different time points![]()

组别MAPT1T2T3T4Dex组94.47±4.3088.20±4.5987.50±4.1393.30±4.13NS组94.53±4.2699.67±5.4598.77±4.47100.83±4.35组间F值=251.263 P值=0.000时点间F值=101.855 P值=0.000 组间·时点间F值=23.6055 P值=0.000
2.2 2组不同时点应激反应水平比较 2组Cor、hs-CRP、TNF-α、IL-6、IL-10水平均明显升高, Dex组Cor、CRP、TNF-α、IL-6水平低于NS组,IL-10水平高于NS组,其组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05),见表2。
表2 2组不同时点Cor、hs-CRP、TNF-α、IL-6 、IL-10水平比较
Table 2 Comparison of Cor,hs-CRP,TNF-α,IL-6 and IL-10 levels between two groups at different time points![]()
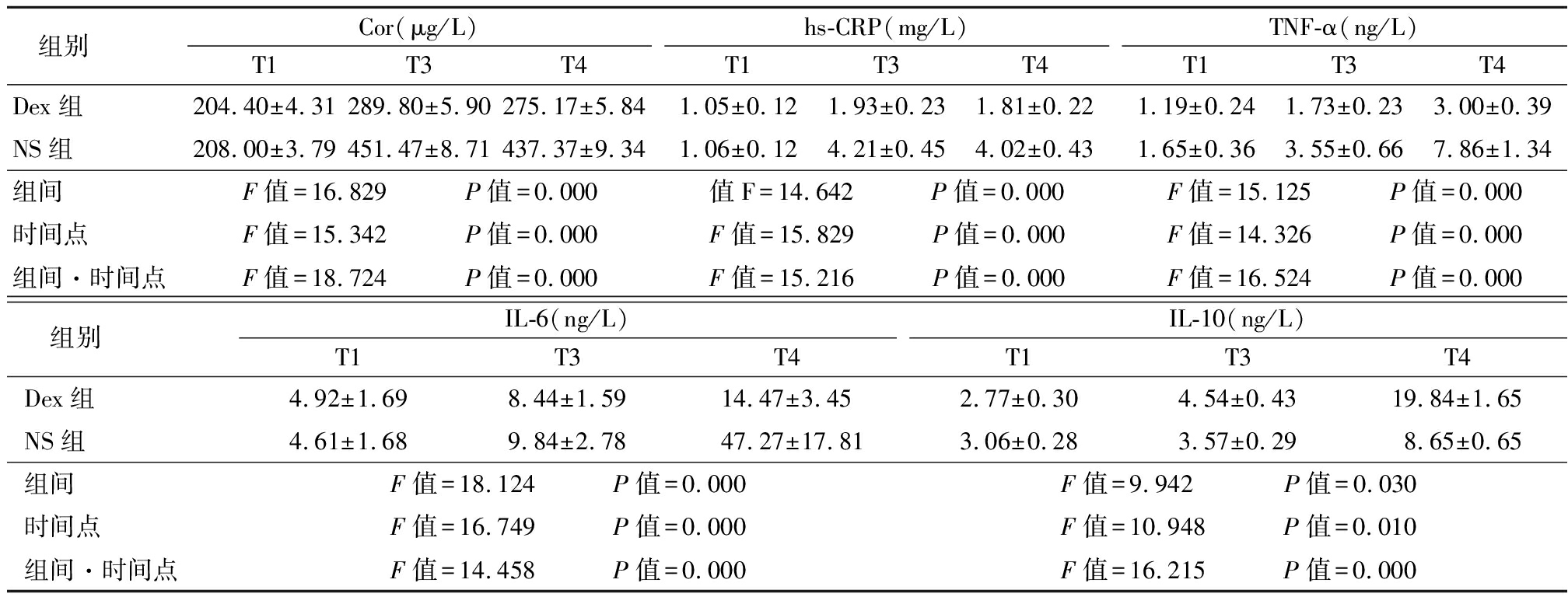
组别Cor(μg/L)T1T3T4hs-CRP(mg/L)T1T3T4TNF-α(ng/L)T1T3T4Dex组204.40±4.31289.80±5.90275.17±5.841.05±0.121.93±0.231.81±0.221.19±0.241.73±0.233.00±0.39NS组208.00±3.79451.47±8.71437.37±9.341.06±0.124.21±0.454.02±0.431.65±0.363.55±0.667.86±1.34组间F值=16.829 P值=0.000值F=14.642 P值=0.000F值=15.125 P值=0.000时间点F值=15.342 P值=0.000F值=15.829 P值=0.000F值=14.326 P值=0.000组间·时间点F值=18.724 P值=0.000F值=15.216 P值=0.000F值=16.524 P值=0.000 组别IL-6(ng/L)T1T3T4IL-10(ng/L)T1T3T4Dex组4.92±1.698.44±1.5914.47±3.452.77±0.304.54±0.4319.84±1.65NS组4.61±1.689.84±2.7847.27±17.813.06±0.283.57±0.298.65±0.65组间F值=18.124 P值=0.000F值=9.942 P值=0.030时间点F值=16.749 P值=0.000F值=10.948 P值=0.010组间·时间点F值=14.458 P值=0.000F值=16.215 P值=0.000
2.3 2组RSS和RS比较 Dex组T5、T6时点RSS高于NS组,RS低于NS组,差异有统计学意义(P<0.05),见表3。
表3 2组RSS和RS比较
Table 3 Comparison of RSS and RS between two groups ![]() 分)
分)
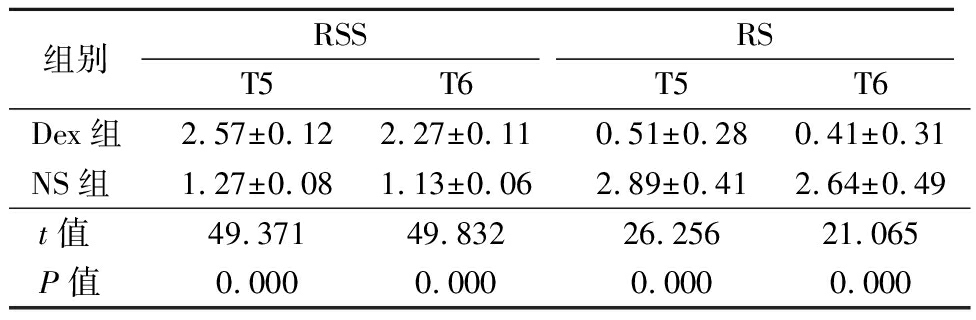
组别RSS T5 T6RS T5 T6Dex组2.57±0.122.27±0.110.51±0.280.41±0.31NS组1.27±0.081.13±0.062.89±0.412.64±0.49t值49.37149.83226.25621.065P值0.0000.0000.0000.000
3 讨 论
精神分裂症是以思维、情感、意志行为活动等多方面的障碍及精神活动与环境不协调为主要特征的一种常见精神病。精神分裂症患者需长期服用抗精神病药物治疗,抗精神病药物与麻醉药物具有协同或拮抗作用,麻醉期间应谨慎用药。阿托品、东莨菪碱为副交感神经阻滞抗胆碱药,能增强抗精神病药的抗胆碱作用,可引起中枢性抗胆碱综合征,故术前不宜应用。
麻醉期间持续监测心电图、血压、脉搏氧饱和度、呼气末二氧化碳分压,精神病患者如长期服用氯丙嗪等药物,术中易出现严重低血压,故术中应密切监测血压变化。因抗精神病药中酚噻嗪类药物作用于体温中枢可致高热及体温调节紊乱,应监测体温,术中监测尿量预防水中毒。术中严格控制麻醉药用量,维持适当的麻醉深度,保持循环稳定,注意患者肝、肾等重要脏器的保护。右美托咪定半衰期短,药物使用量小,对α2肾上腺受体高选择性,在麻醉手术中可以起到镇静、维持血流动力学稳定的作用[3]。本研究结果显示,Dex组在整个围术期各时点MAP均低于NS组,且拔管后MAP较快恢复至基线水平,右美托咪定具有良好的稳定血流动力学作用。外科手术操作创伤性刺激较大,促使患者交感神经系统激活,导致机体神经内分泌及免疫系统发生变化,引起Cor等激素和许多细胞因子水平改变,引起炎症反应[4]。有研究表明,精神分裂症的发病机制与免疫炎症异常有着密切联系,精神分裂症患者治疗前后血清及脑脊液中IL-2、IL-6、IL-10、TNF-α、干扰素、hs-CRP等细胞因子及其受体多存在异常,说明精神分裂症患者的免疫功能发生异常[5-8]。右美托咪定是一种高选择性α2受体激动剂,通过抑制交感神经张力间接提高副交感神经张力,激活胆碱能抗炎通路发挥抗炎作用。有研究表明,右美托咪定通过抑制中性粒细胞的浸润,降低炎性细胞IL-6、TNF-ɑ的表达,增加抗炎细胞因子的表达,通过预处理抑制氯化钴诱导的线粒体凋亡通路,减轻氧化应激机制,实现各重要器官保护作用[9-12]。本研究结果显示,Dex组不同时点血清Cor、hs-CRP、TNF-α、IL-6 水平明显低于NS组。IL-10水平明显高于NS组。证实了右美托咪定的抗炎作用,不仅起到重要器官保护作用,对于精神分裂症患者,还能够稳定其精神症状,避免精神症状的加重。
精神病患者治疗依从性差,不能主动配合麻醉手术,给麻醉管理带来了困难。全身麻醉苏醒期,患者容易出现躁动或谵妄[13],特别因患者本身疾病原因,更易出现烦躁、幻觉、被迫害感及治疗不配合等发生。寻找一种对精神病患者全身麻醉苏醒期躁动安全有效的预防方法,对提高全身麻醉苏醒期质量具有重要意义。右美托咪定具有抗应激、镇静、催眠、麻醉、抗焦虑和顺应性遗忘作用,其镇静催眠作用与蓝斑核密切相关,蓝斑核通过发出去甲肾上腺素背束纤维控制大脑皮质的觉醒反应,可调节机体睡眠与觉醒状态。右美托咪定镇静作用类似自然睡眠,患者易被唤醒配合,且对呼吸无明显抑制作用[14-15]。本研究结果显示,Dex组苏醒期RSS明显高于NS组,RS明显低于NS组。表明右美托咪定具有良好的镇静、抗焦虑作用,可有效降低苏醒期患者躁动行为或谵妄的发生,使得精神分裂患者全身麻醉苏醒期更加平稳、安全,避免精神症状的加重[16]。
综上所述,术中持续应用右美托咪定能有效维持精神病患者全身麻醉围术期血流动力学稳定,减少术中应激反应水平,发挥保护重要器官功能及良好镇静作用,同时可预防和减少全身麻醉苏醒期躁动发生,提高精神病患者术后苏醒质量,右美托咪定的抗炎作用可抑制围术期的免疫炎症反应,减少患者精神症状的加剧,从而确保精神分裂症患者安全、平稳度过围术期,值得临床推广。
[1] Chen ZY,Dai N,Lin S,et al. Impact of dexmedetomidine on intraoperative wake-up tests in patients undergoing spinal surgery[J]. J Perianesth Nurs,2018,33(4):448-452.
[2] Ghasemi M,Behnaz F,Hajian H.The effect of dexmedetomidine prescription on shivering during operation in the spinal an esthesia proceures of selective or thopedic surgery of the lower limb in addicted patients[J]. Anesth Pain Med,2018,8(2):e63230.
[3] 钱晓岚,任莹莹,王琦英,等.盐酸右美托咪定的药理作用及临床应用[J].临床研究,2016,24(8):201-202.
[4] Ma M,Jiang H,Gong L,et al. Comparative study between thoracoscopic and open esophagectomy on perioperative complications and stress response[J]. Zhonghua Wei Chang Wai Ke Za Zhi,2016,19(4):401-405.
[5] 张馨月,姚晶晶,吕一丁,等.精神分裂症的发病机制及治疗靶点的研究进展[J].国际精神病学杂志,2018,45(2):201-203.
[6] Barzilay R,Lobel T,Krivoy A,et al.Elevated C-reactive protein levels in schizophrenia inpatients is associated with aggressive behavior[J]. Eur Psychiatry,2016,31:8-12.
[7] 张琦航,周福春,王传跃.精神分裂症各临床症状维度与炎症免疫机制[J].国际精神病学杂志,2019,46(2):193-195,205.
[8] Liba Z,Kayserova J,Elisak M,et al. Anti-N-methyl-D-aspartate receptor encephalitis :the clinical course in light of the chemokine and cytokine levels in cerebrospinal fluid[J]. J Neuroinflammation,2016,13(1):55.
[9] 张青,王竹梅.右美托咪啶的药理作用及临床应用进展[J].贵州医药,2016,40(5):544-546.
[10] 王琴,王辉.右美托咪定的器官保护作用及其机制[J].医学综述,2019,25(9):1822-1826.
[11] Chen XH,Chen DT,Huang XM,et al. Dexmedetomidine protects against chemical hypoxia-induced neurotoxicity in differentiated PC12 cells via inhibition of NADPH oxidase 2-mediated oxidative stress[J]. Neurotox Res,2019,35(1):139-149.
[12] Liu YJ,Wang DY,Yang YJ,et al. Effects and mechanism of dexmedetomidine on neuronal cell injury induced by hypoxia-ischemia[J]. BMC Anesthesiol,2017,17(1):117.
[13] 孙媛,王莉,陈欢,等.右美托咪定对精神分裂症患者术后谵妄的预防效果[J].中华麻醉学杂志,2019,39(3):268-271.
[14] 赵振海,王华.右美托咪定在临床围术期的器官保护作用研究进展[J].医学综述,2018,24(1):90-94.
[15] 王桂平.盐酸右美托咪定在日间手术的应用现状及研究进展[J].河北医科大学学报,2016,37(2):246-248.
[16] 董心童,蔡兴涛,程翔.右美托咪定对老年卵巢囊肿腹腔镜手术患者苏醒期躁动与术后认知功能的影响[J].海南医学,2019,30(9):1134-1136.