糖尿病肾病(diabetic nephropathy,DN)是糖尿病(diabetic mellitus,DM)晚期主要并发症,是导致终末期肾病的主要病因。目前全球有30%~40% DM患者并发DN。然而DN的分子机制仍然未完全阐明[1-2]。微小RNA(microRNA,miRNA)是由20~22个核苷酸组成的内源性小分子非编码RNA。miRNA通过抑制靶mRNA翻译和(或) 诱导mRNA降解调节基因的表达,并在肾脏的稳态、血压、激素及水电解质平衡维持等过程中发挥重要作用[2]。研究证实,miRNA-21与DN患者肾小管间质的损伤相关[3],miRNA-192富集于肾皮质中,其表达水平下调与DN进展有关[4]。本研究采用RT-PCR技术检测DN患者血清miRNA-21和miRNA-192的表达,并探讨DN的发病机制,旨在为其早期发现及治疗提供基因依据。
1 资料与方法
1.1 一般资料 选取2016年6月—2018年2月于西安交通大学第一附属医院确诊的T2DM患者65例。患者均符合1999年WHO糖尿病诊断标准,其中T2DM患者(DM组)38例,DN患者(DN组)27例。DM组男性24例,女性14例,年龄45~70岁,平均(59.32±10.26) 岁,DM病程(8.27±5.76)年;DN组男性17例,女性10例,年龄47~73岁,平均(58.72±10.61) 岁,DM病程(10.52±6.13)年。另选取同期体检健康者30例作为对照组,男性20例,女性10例,年龄45~71岁,平均(58.70±11.73) 岁。排除标准:①严重心脑血管并发症患者;②合并感染者;③妊娠期妇女;④自身免疫性疾病患者;⑤原发性肾脏疾病所致的肾脏病变者。DN诊断依据美国糖尿病协会糖尿病完全指南,尿白蛋白排泄率(urinary albumin excretion rates,UAER)<30 mg/24 h为正常,UAER 30~300 mg/24 h为微量白蛋白尿,UAER>300 mg/24 h为大量蛋白尿。各组性别、年龄差异无统计学意义(P>0.05),DN组和DM组病程差异有统计学意义(P<0.01)。
本研究经医院伦理委员会批准通过,所有研究对象均知情许可。
1.2 研究方法
1.2.1 体重、血压及血指标测定 所有研究对象均空腹测量体重和血压,采集静脉血。应用罗氏MODULARP800全自动生化分析仪检测血清三酰甘油(triglyceride,TG)。
1.2.2 肾脏血流参数检测 应用PHILIPS-IU22 彩色多普勒超声诊断仪检测肾主动脉(main renalartery,MRA)和段动脉以及叶间动脉的血流相关参数,分别记录动脉收缩期的峰值速度(peak systolic velocity,PSV)和舒张末期流速以及阻力指数(resistance index,RI)。
1.2.3 miRNAs表达的检测 应用mirVANA PARIS试剂盒提取血清总RNA,再用紫外分光光度计在260 nm 和280 nm 波长下测定光密度值,若两光密度的比值在1.7~2.0间则考虑总RNA 溶液无杂质。将合格的RNA于-80 ℃保存备用。根据TaqMall microRNA Reverse Transcripts Kits操作说明书进行RT-PCR。采用β-actin 作为内参照,用pfimer5软件设计引物,miRNA-21引物序列正义链为5′-GCCCATCCTCAAATACAAAGC-3′,反义链为5′-GGTCCTGAACACAAAATGAGC-3′,扩增产物长度为250 bp。miRNA-192的引物序列正义链为5′-TTAATGCTAATCGTGACTAAG-3′,反义链为5′-ACCTGAGAGTAGACCAGAGA-G-3′, 产物长度为290 bp。β-actin的引物序列正义链为5′-ATGTCACGCACGATTTCCGTGC-3′,反义链为5′-CTGTCCCTGTATGCCTCCAAATG-3′,产物长度为560 bp。扩增条件:95 ℃循环10 min,95 ℃循环15 s,60 ℃循环1 min,40个循环后 60 ℃ 5 min。将扩增产物进行电泳并通过扫描,经图像处理系统分析计算得出miRNA-21、miRNA-192和β-actin 的CT值,以β-actin 的CT值为参考,求出miRNA-21、miRNA-192的CT变化值(△CT),以2-△ct得到miRNA-21和miRNA-192 相对表达量。
1.3 统计学方法 应用SPSS 21.0统计软件分析数据。计量资料比较分别采用F检验和SNK-q检验;计数资料比较采用χ2检验,相关性采用Pearson相关性分析。P<0.05为差异有统计学意义。
2 结 果
2.1 3组基线资料比较 DN组和DM组体重指数、收缩压、TG均明显高于对照组(P<0.05)。见表 1。
表1 3组基线资料比较
Table 1 Comparison on baseline data for research
objects among groups![]()
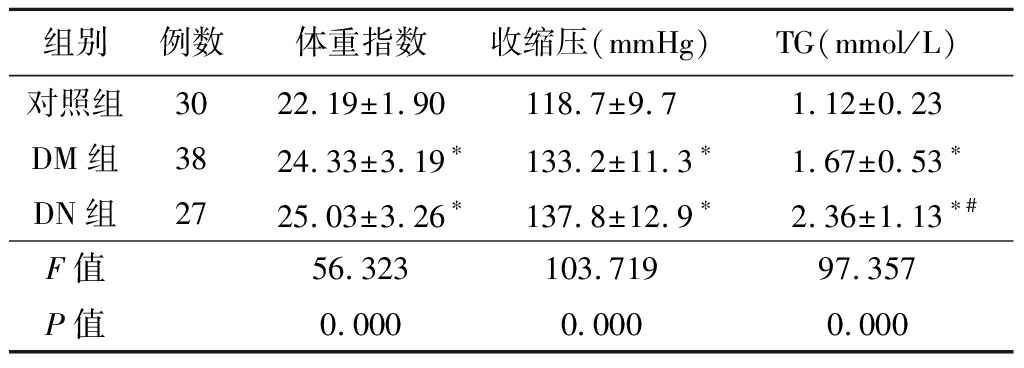
组别例数体重指数收缩压(mmHg)TG(mmol/L)对照组30 22.19±1.90118.7±9.7 1.12±0.23DM组38 24.33±3.19∗133.2±11.3∗1.67±0.53∗DN组27 25.03±3.26∗137.8±12.9∗2.36±1.13∗#F值56.323103.71997.357P值0.0000.0000.000
*P值<0.05与对照组比较 #P值<0.05与DM组比较(SNK-q检验);1 mmHg=0.133 kPa
2.2 3组MRA血流参数比较 DN组和DM组RI明显高于对照组,且DN组RI明显高于DM组(P<0.05);DN组PSV明显低于DM组和对照组(P<0.05)。见表2。
表2 3组MRA血流参数比较
Table 2 Comparison on blood flow parameters of MRA for
research objects among groups![]()
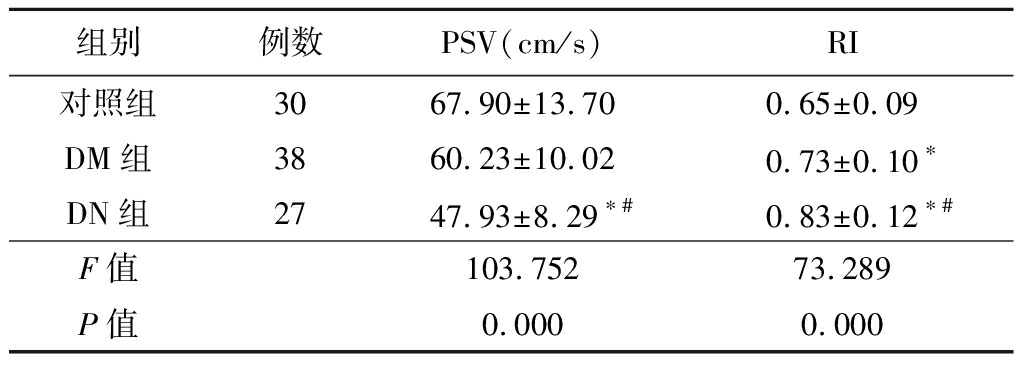
组别例数PSV(cm/s) RI对照组3067.90±13.700.65±0.09DM组3860.23±10.02 0.73±0.10∗DN组2747.93±8.29∗# 0.83±0.12∗#F值103.75273.289P值0.0000.000
*P值<0.05与对照组比较 #P值<0.05与DM组比较(SNK-q检验)
2.3 3组血清miRNA-21和miRNA-192表达比较 DN组和DM组miRNA-21表达均高于对照组,miRNA-192均低于对照组(P<0.05);DN组miRNA-21表达高于DM组,miRNA-192低于DM组(P<0.01)。见表3。
表3 3组血清miRNA-21和miRNA-192表达比较
Table 3 Comparison on serumal expression of miRNA-21
and miRNA-192 for research objects among groups![]()
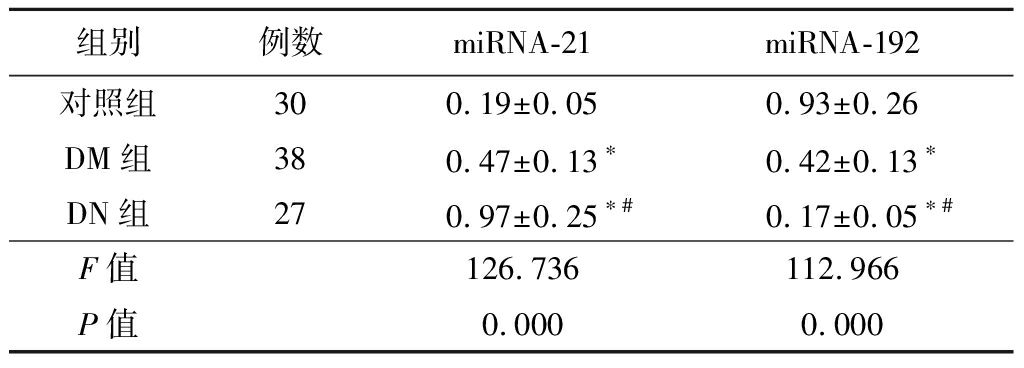
组别例数miRNA-21miRNA-192对照组300.19±0.05 0.93±0.26DM组380.47±0.13∗0.42±0.13∗DN组270.97±0.25∗#0.17±0.05∗#F值 126.736112.966P值 0.000 0.000
*P值<0.05与对照组比较 #P值<0.05与DM组比较(SNK-q检验)
2.4 相关性分析 DN组血清miRNA-21与miRNA-192表达呈负相关(r=-0.837,P<0.05);miRNA-21表达与RI水平呈正相关(r=0.812,P<0.05),与PSV水平呈负相关(r=-0.793,P<0.05);miRNA-192与RI水平呈负相关(r=-0.807,P<0.05),与PSV水平呈正相关(r=0.782,P<0.05)。DM组血清miRNA-21与miRNA-192表达呈负相关(r=-0.816,P<0.05);miRNA-21与RI水平呈正相关(r=0.714,P<0.05);miRNA-192表达与RI水平呈负相关(r=-0.745,P<0.05)。
3 讨 论
DN是糖尿病的严重并发症之一,其病理学特点主要是弥漫型肾小球硬化和毛细血管的基底膜增厚,肾小球滤过率降低,细胞外基质沉积,肾小管间质纤维化以及管腔狭窄和肾动脉阻力升高等,以上变化引起肾血流灌注产生变化,导致进行性肾功能丧失。研究证实,足细胞足突融合和白蛋白尿是DN的主要病理改变。DN的肾功能损害是不可逆的,故尽早诊断DN并给予合理治疗能明显改善患者的预后[5-6]。miRNA-21的差异性表达与肾脏的纤维化有关。动物实验显示,DN初期大鼠血浆miRNA-21显著升高,给予药物治疗后miRNA-21表达显著降低[7]。磷酸酶张力蛋白同源物(phosphatase and tensin homolog,PTEN)是miRNA-21的靶基因,高糖环境可以抑制其活性,PTEN的下调可能激活机体磷脂酰肌醇3激酶(phosphati dylinositol 3 kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)信号通路[8-9]。异常PI3K/AKT信号系统作用于下游多种酶和转录因子,造成肾小管上皮细胞肥大、组织外基质异常沉积及足细胞凋亡等病变过程[10]。卢新星等[11]研究发现,大鼠肾小球系膜细胞在高糖环境中显著肥大、增殖,细胞内PTEN蛋白及mRNA表达明显下调,miRNA-21表达明显上调。研究证实PTEN受到miRNA-21的调节而影响足细胞的运动能力,该过程中miRNA-21通过拮抗链脲霉素活性进一步缓解糖尿病小鼠的肾小球系膜扩张、间质纤维化、巨噬细胞浸润、足细胞丢失和蛋白尿形成等病理过程[3]。本研究DN组血清miRNA-21呈现高表达,提示miRNA-21可能参与了DN患者肾小管上皮细胞肥大、组织外基质异常沉积及肾纤维化等病理过程;DM组血清miRNA-21表达明显高于对照组,提示DM患者可能存在肾脏损伤风险,miRNA-21差异性表达可作为预测 DN的分子标志物。
miRNA-192可能与DN的发生发展有关,下调miRNA-192表达可能增加DN病程,已在慢性DN患者的肾活检组织中得到了证实[12]。高糖环境可激活转化生长因子β(transforming growth factor-β,TGF-β)/Smad通路,促进肾小管上皮细胞分泌TGF-β,TGF-β参与多个生理、病理过程的调节。TGF-β过表达可能诱导肾间质纤维化的发生[13]。周云枫等[5]认为近端肾小管上皮细胞过表达TGF-β可抑制miRNA-192表达,下调miRNA-192表达可促进TGF-β分泌,进而增加肾纤维化的进展导致肾小球滤过功能降低。提示miRNA-192上调可能缓解DN患者肾脏纤维化,改善蛋白尿的发生。李洁等[14]对DN患者的研究认为,上调miRNA-192表达能改善谷胱甘肽过氧化物酶和超氧化物歧化酶在高糖环境中的抑制作用,拮抗高糖对人肾系膜细胞的氧化应激损伤。提示miRNA-192可能与DN发生和发展密切相关。本研究结果显示,DN组和DM组血清miRNA-192表达明显低于对照组,DN组miRNA-192表达明显低于DM组(P<0.05)。推测调控miRNA-192表达可能改变TGF-β/Smad通路活性,影响肾纤维化的病变进展,改善肾小球滤过功能。
有报道认为,肾脏超声检查可以较为准确地判定早期DN患者的肾脏损害状况,由肾脏超声检测得到的DN患者肾脏血流动力学参数变化可以反映DN患者肾功能的损害程度[15-16]。DN患者早期肾损害常伴有MRA和段动脉血流速度降低和RI增加[17]。本研究结果显示,DN组MRA的PSV明显低于DM组和对照组,RI水平明显高于DM组和对照组(P<0.05);DM组RI高于对照组(P<0.05)。表明超声检查的RI变化相对于血尿素氮和SCr能尽早预测DM患者的肾脏损害状况。本研究DN组血清miRNA-192和miRNA-21表达与PSV、RI具有相关性(P<0.05),DM组血清miRNA-192和miRNA-21表达与RI具有相关性(P<0.05)。提示miRNA-192和miRNA-21可能与DN的病理进展密切相关,其差异性表达可能反映了DN患者的早期肾损伤状况。因此,检测DN患者血清miRNA-21和miRNA-192表达可为DN患者的早期发现及治疗提供基因依据。
[1] 何立芳,李青科,张秀香,等.骨化三醇对糖尿病肾病患者尿白蛋白排泄率影响的研究[J].河北医科大学学报,2017,38(2):142-145.
[2] 卢新星,范秋灵,徐莉,等.抑制微小RNA-21可减轻高糖诱导的肾小球系膜细胞自噬抑制[J].中华肾脏病杂志,2017,33(1): 48-54.
[3] Kölling M,Kaucsar T,Schauerte C,et al. Therapeutic miR-21 silencing ameliorates diabetic kidney disease in mice[J]. Mol Ther,2017,25(1):165-180.
[4] Chen YQ,Wang XX,Yao XM,et al. Abated microRNA-195 expression protected mesangial cells from apoptosis in early diabetic renal injury in mice[J]. J Nephrol,2012,25(4):566-576.
[5] 周云枫,付佳霖,管又飞.微小RNAs与糖尿病肾病[J].生理科学进展,2012,43(5):351-355.
[6] 查冬青,吴小燕.N-乙酰基-丝氨酰-天门冬酰-赖氨酰-脯氨酸对糖尿病肾病小鼠肾组织的保护作用及机制[J].临床肾脏病杂志,2017,17(12):757-760.
[7] 徐雪梅,田春雨,喇孝瑾,等.十子代平方对糖尿病大鼠肾脏TGF-β、PTEN及血浆miRNA-21表达的影响[J].中药材,2017,40(6):1443-1447.
[8] Bimbaum Y,Nanhwan MK,Ling S,et al. PTEN upregulation may explain the development of insulin resistance and type 2 diabetes with high dose statins[J]. Cardiovasc Drugs Ther,2014,28(5):447-457.
[9] Shen W,Chen G,Dong R,et al. MicroRNA-21/PTEN/Akt axis in the fibrogenesis of biliary atresia[J]. J Pediatr Surg,2014,49(12):1738-1741.
[10] 杨召聪,陆茵,顾亚琴,等.马兜铃酸Ⅰ对大鼠体内P13K/Akt/NF-rB通路的影响[J].南京中医药大学学报,2015,31(3):250-253.
[11] 卢新星,范秋灵,徐莉,等.乌索酸改善高糖诱导系膜细胞损伤的机制[J].中华肾脏病杂志,2015,31(1):48-55.
[12] Krupa A, Jenkins R, Luo DD,et al. Loss of MicroRNA-192 promotes fibrogenesis in diabetic nephropathy[J]. J Am Soc Nephrol,2010,21(3):438-447.
[13] 熊加川,胡章学.MiR-192在肾脏疾病中的研究进展[J].中国中西医结合肾病杂志,2012,13(12):1123-1125.
[14] 李洁,周平,胡秀梅,等.MiRNA-192慢病毒表达载体构建及其抗高糖刺激氧化损伤作用[J].医学临床研究,2012,29(5):807-809.
[15] Barrios C,Pascual J,Otero S,et al. Diabetic nephropathy is an independent factor associated to severe subclinical atheromatous disease[J]. Atherosclerosis,2015,242(1):37-44.
[16] 王小亭,王广健,张宏民.重症肾脏超声:肾脏血流动力学评估[J].临床荟萃,2019,34(7):581-583.
[17] 魏秋菊,李红,杜菲,等.肾脏超声检查在不同时期糖尿病肾病患者诊治中的价值[J].中国老年学杂志,2017,37(2):350-352.