目前,虽然重症颅脑损伤的致死率不断降低,但部分存活患者因脑微循环障碍、脑细胞缺血缺氧所致认知功能障碍或终身残疾,严重影响患者的预后[1]。右美托咪定是α受体激动剂,能激活中枢蓝斑核受体,抑制释放去甲肾上腺素,调节机体免疫应答,达到镇静镇痛的效果[2];同时其具有保护神经作用,可调控患者术后脑氧代谢,稳定血流动力学,减少应激反应,预防并发症发生,改善患者认知功能和恢复其生活质量[3]。而目前关于右美托咪定不同给药剂量对重症颅脑损伤围术期的影响研究尚少。本研究旨在探讨右美托咪定不同给药剂量对重症颅脑损伤患者镇静镇痛、血流动力学及脑氧代谢的影响。报告如下。
1 资料与方法
1.1 一般资料 选择2017年12月—2018年12月在我院神经外科重症监护病房治疗的颅脑损伤患者180例。纳入标准:①颅脑创伤24 h内入院者;②影像学确诊者;③GCS评分[4]<8分;④患者或其家属签署知情同意书;⑤APACHE Ⅱ评分[5]11~22分。排除标准:①免疫缺陷或内分泌系统疾病者;②合并严重主要脏器疾病者;③近期合并感染者;④有中枢神经、精神系统疾病史者;⑤严重精神疾患、高血压、糖尿病者;⑥合并免疫系统、凝血系统疾病者;⑦存在其他影响意识因素者。根据随机数学表法分为A组、B组、C组各60例。3组性别、年龄、GCS评分、APACHE Ⅱ评分及损伤类型差异均无统计学意义(P>0.05),具有可比性,见表1。
本研究经医院伦理委员会批准通过。
表1 3组一般资料比较
Table 1 Comparison of general data of three groups (n=60,例数,%)
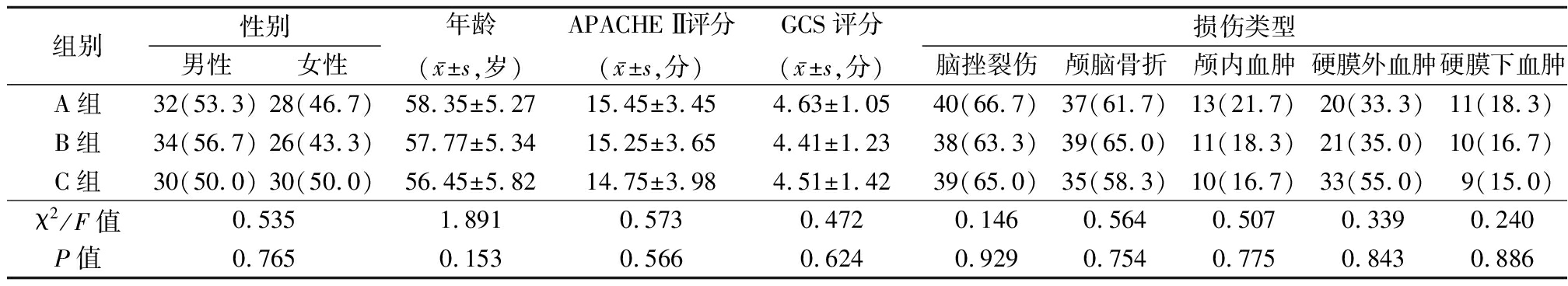
组别性别男性女性年龄(x-±s,岁)APACHE Ⅱ评分(x-±s,分)GCS评分(x-±s,分)损伤类型脑挫裂伤颅脑骨折颅内血肿硬膜外血肿硬膜下血肿A组32(53.3)28(46.7)58.35±5.2715.45±3.454.63±1.05 40(66.7)37(61.7)13(21.7)20(33.3)11(18.3)B组34(56.7)26(43.3)57.77±5.3415.25±3.654.41±1.2338(63.3)39(65.0)11(18.3)21(35.0)10(16.7)C组30(50.0)30(50.0)56.45±5.8214.75±3.984.51±1.4239(65.0)35(58.3)10(16.7)33(55.0)9(15.0)χ2/F值0.5351.8910.5730.4720.1460.5640.5070.3390.240P值0.7650.1530.5660.6240.9290.7540.7750.8430.886
1.2 方法 患者均接受颅脑损伤综合治疗,在全身麻醉下行骨瓣减压术或颅内血肿清除术。麻醉诱导:静脉注射0.05 mg/kg咪唑安定(广州南新制药有限公司,国药准字 H10980025),1.5 mg/kg丙泊酚(江苏恩华药业股份有限公司,国药准字H20123138),3 μg/kg舒芬太尼(宜昌人福药业有限责任公司,国药准字 H20054172),0.2 mg/kg阿曲库铵(连云港贵科药业有限公司,国药准字 H20163166)。患者肌肉松弛后行气管插管,机械通气。麻醉维持:术中患者吸入1%~2%七氟醚(上海恒瑞医药有限公司,国药准字H20070172),维持脑电双频指数(bispectral index,BIS)为40~60;间断静脉注射浓度2.0~3.5 μg/mL丙泊酚和2.5 ng/mL舒芬太尼,按照右美托咪定0.5 μg/kg剂量,4 μg/mL静脉注射10 min。A组给予0.3 μg·kg-1·h-1右美托咪定(四川国瑞药业有限责任公司,规格 2 mL:0.2 mg,国药准字H20143195)与生理氯化钠溶液(重庆三大伟业制药有限公司,3 000 mL:27 g,国药准字H20063065)共20 mL;B组给予0.5 μg·kg-1·h-1右美托咪定;C组给予0.7 μg·kg-1·h-1右美托咪定。所有操作均由熟练的麻醉操作医生进行。手术结束后送患者至重症监护病房,监测生命体征,给予综合支持治疗。
1.3 观察指标 ①血流动力学变化:术后即刻(0 h),12 h,24 h,72 h记录心率(heart rate,HR)、呼吸频率(respiration rate,RR)、平均动脉压(mean arterial pressure,MAP)、脉搏血氧饱和度(pulse oxygen saturation,SpO2)。②Ramsay镇静评分[6]:1分,烦躁、不安静;2分,合作、安静;3分,嗜睡,能听从指令;4分,睡眠状态,可唤醒;5分,呼唤反应迟钝;6分,深睡,呼唤不醒;镇静满意(2~4分)、镇静过度(5~6分)。③VAS评分[7]:0~10分,评分越高越疼痛。④3个月时随访GCS评分标准[4]:睁眼反应(1~4 分)、语言反应(1~5 分)和肢体运动(1~6 分)3个方面分数和为昏迷指数;轻度为13~15分,中度为9~12分,重度为3~8分,脑死亡或预后极差为<3分,分值越高表示意识状态越好。⑤脑氧代谢指标:在颈内静脉逆行穿刺术置入深静脉导管,在术后即刻(0 h),12 h,24 h,72 h采集颈静脉球部血和桡动脉血各2 mL,检测颈静脉球部血氧饱和度(blood oxygen saturation of jugular vein bulb,SjvO2)、颈内静脉血氧分压(jugular venous oxygen pressure, PjvO2)、动脉-颈内静脉血氧含量差(arteriovenous oxygen content diference,AVDO2)、脑氧摄取率(cerebral O2 extraction rate,CERO2)。
1.4 统计学方法 应用SPSS 19.0统计软件分析数据。计量资料比较分别采用F检验、SNK-q检验和重复测量的方差分析;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 3组术中指标比较 B组、C组术中舒芬太尼用量明显低于A组,C组术中芬太尼用量明显低于B组(P<0.05);3组手术时间、麻醉时间差异均无统计学意义(P<0.05),见表2。
表2 3组术中指标比较
Table 2 Comparison of intraoperative
indicators in three groups![]()
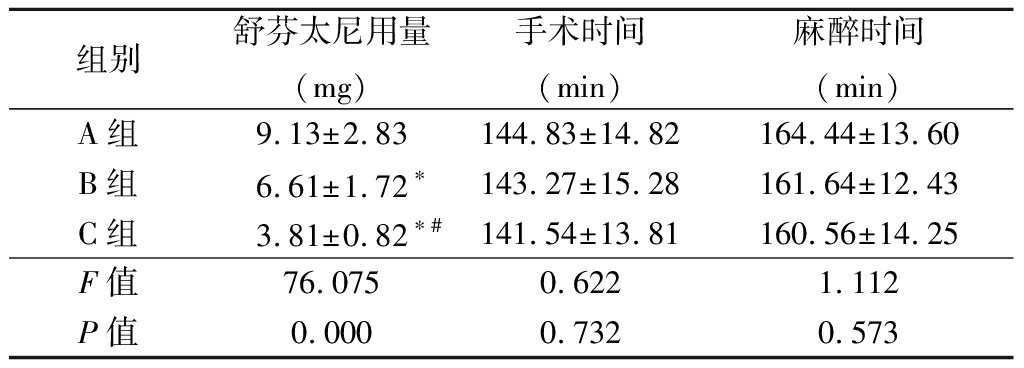
组别舒芬太尼用量(mg)手术时间(min)麻醉时间(min)A组9.13±2.83144.83±14.82164.44±13.60B组6.61±1.72∗143.27±15.28161.64±12.43C组3.81±0.82∗#141.54±13.81160.56±14.25F值76.0750.6221.112P值0.0000.7320.573
*P值<0.05与A组比较 #P值<0.05与B组比较(SNK-q检验)
2.2 3组不同时点血流动力学指标比较 3组HR、RR、MAP均呈先降低再升高的趋势, B组、C组HR、RR、MAP水平低于A组,其组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05),3组SpO2水平组间、时点间、组间·时点间交互作用差异均无统计学意义(P>0.05),见表3。
表3 3组不同时点血流动力学指标比较
Table 3 Comparison of three groups of hemodynamic indicators at different time points![]()
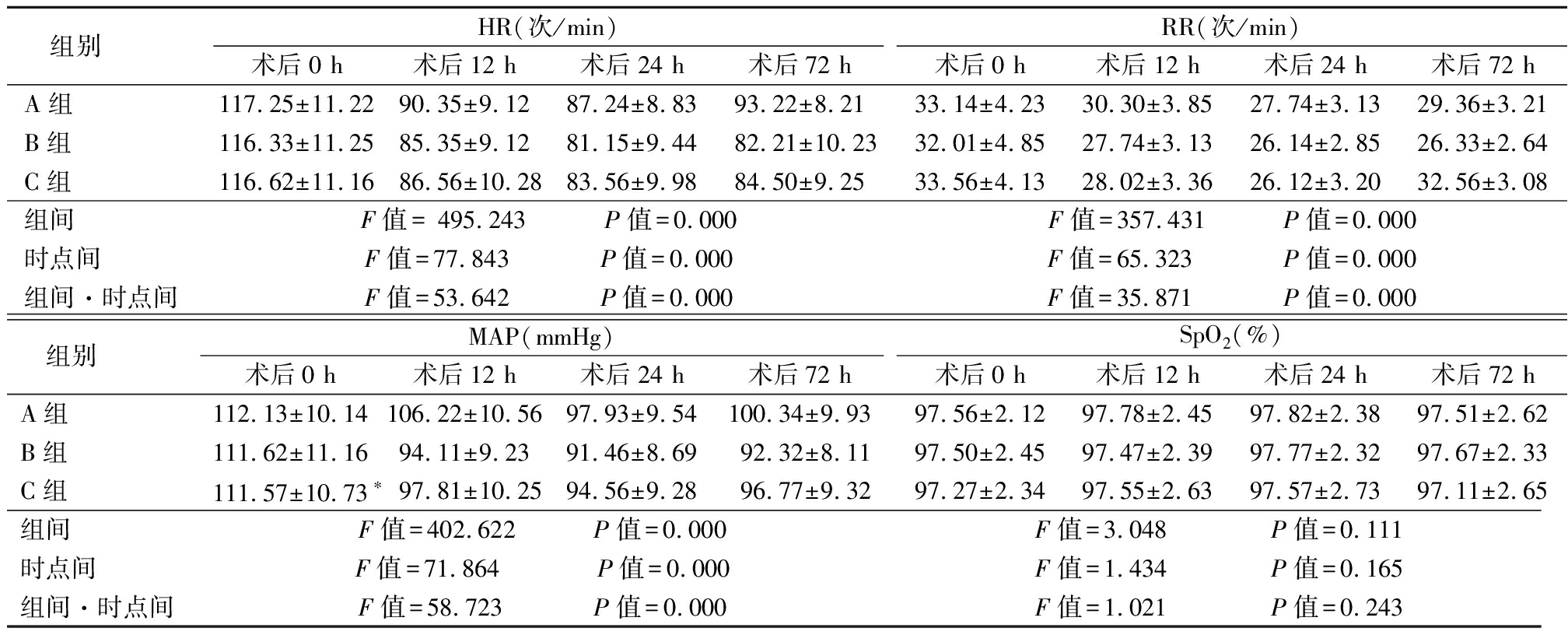
组别HR(次/min)术后0 h术后12 h术后24 h术后72 hRR(次/min)术后0 h术后12 h术后24 h术后72 hA组117.25±11.2290.35±9.1287.24±8.8393.22±8.2133.14±4.2330.30±3.8527.74±3.1329.36±3.21B组116.33±11.2585.35±9.1281.15±9.4482.21±10.2332.01±4.8527.74±3.1326.14±2.8526.33±2.64C组116.62±11.1686.56±10.2883.56±9.9884.50±9.2533.56±4.1328.02±3.3626.12±3.2032.56±3.08组间F值= 495.243 P值=0.000F值=357.431 P值=0.000时点间F值=77.843 P值=0.000F值=65.323 P值=0.000组间·时点间F值=53.642 P值=0.000F值=35.871 P值=0.000 组别MAP(mmHg)术后0 h术后12 h术后24 h术后72 hSpO2(%)术后0 h术后12 h术后24 h术后72 hA组112.13±10.14106.22±10.5697.93±9.54100.34±9.9397.56±2.1297.78±2.4597.82±2.3897.51±2.62B组111.62±11.1694.11±9.2391.46±8.6992.32±8.1197.50±2.4597.47±2.3997.77±2.3297.67±2.33C组111.57±10.73∗97.81±10.2594.56±9.2896.77±9.3297.27±2.3497.55±2.6397.57±2.7397.11±2.65组间 F值=402.622 P值=0.000 F值=3.048 P值=0.111时点间 F值=71.864 P值=0.000 F值=1.434 P值=0.165组间·时点间 F值=58.723 P值=0.000 F值=1.021 P值=0.243
注:1 mmHg=0.133 kPa
2.3 3组不同时点Ramsay评分、VAS评分及GCS评分比较 3组Ramsay评分呈降低趋势,VAS评分、GCS评分呈升高趋势,B组和C组Ramsay评分、VAS评分低于A组,GCS评分高于A组,其组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05),见表4。
表4 3组不同时点Ramsay、VAS及GCS评分比较
Table 4 Comparison of Ramsay, VAS and GCS scores at three different time points ![]() 分)
分)
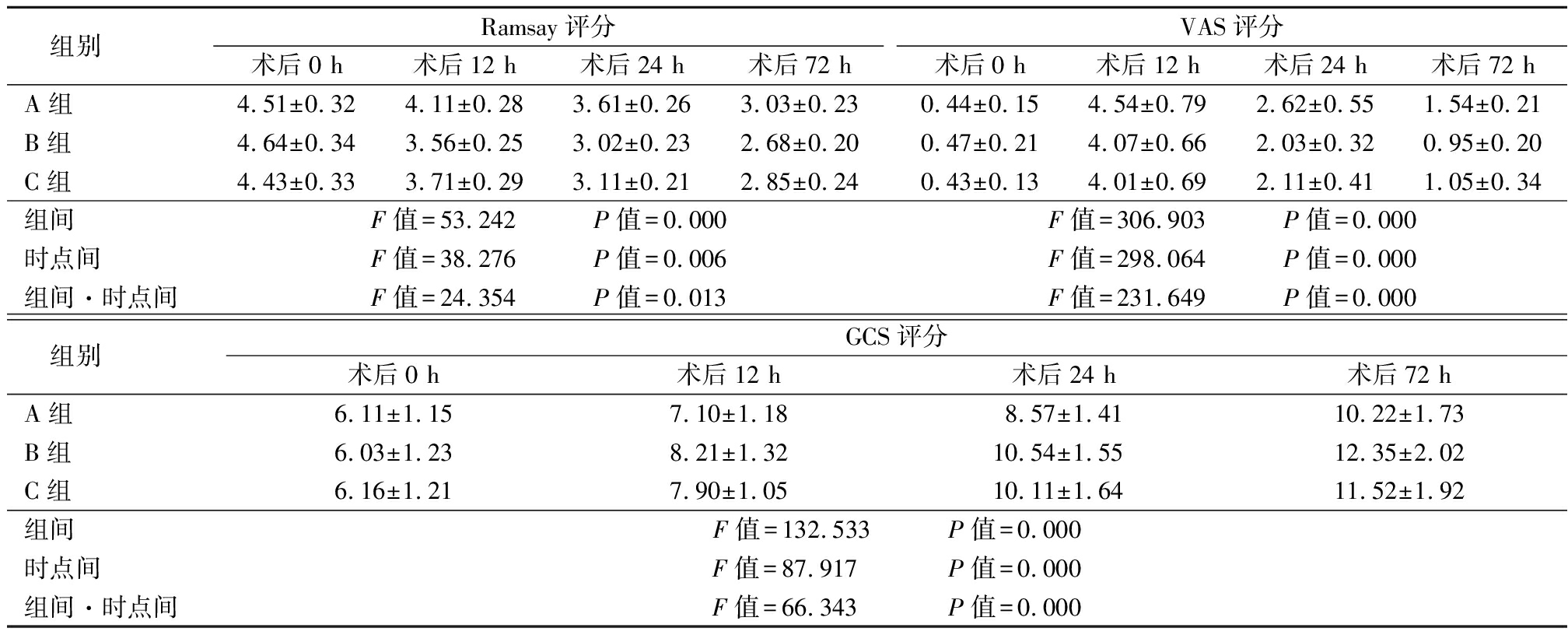
组别Ramsay评分术后0 h术后12 h术后24 h术后72 hVAS评分术后0 h术后12 h术后24 h术后72 hA组4.51±0.324.11±0.283.61±0.263.03±0.230.44±0.154.54±0.792.62±0.551.54±0.21B组4.64±0.343.56±0.253.02±0.232.68±0.200.47±0.214.07±0.662.03±0.320.95±0.20C组4.43±0.333.71±0.293.11±0.212.85±0.240.43±0.134.01±0.692.11±0.411.05±0.34组间F值=53.242 P值=0.000F值=306.903 P值=0.000时点间F值=38.276 P值=0.006F值=298.064 P值=0.000组间·时点间F值=24.354 P值=0.013F值=231.649 P值=0.000 组别GCS评分术后0 h术后12 h术后24 h术后72 hA组6.11±1.157.10±1.188.57±1.4110.22±1.73B组6.03±1.238.21±1.3210.54±1.5512.35±2.02C组6.16±1.217.90±1.0510.11±1.6411.52±1.92组间F值=132.533 P值=0.000时点间F值=87.917 P值=0.000组间·时点间F值=66.343 P值=0.000
2.4 3组不同时点脑氧代谢指标变化比较 3组SjvO2呈明显升高趋势,AVDO2、CERO2呈明显降低趋势, B组和C组SjvO2明显高于A组,AVDO2、CERO2明显低于A组,其组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05),见表5。
表5 3组不同时点脑氧代谢指标变化比较
Table 5 Comparison of changes in cerebral oxygen metabolism indicators at three different time points![]()
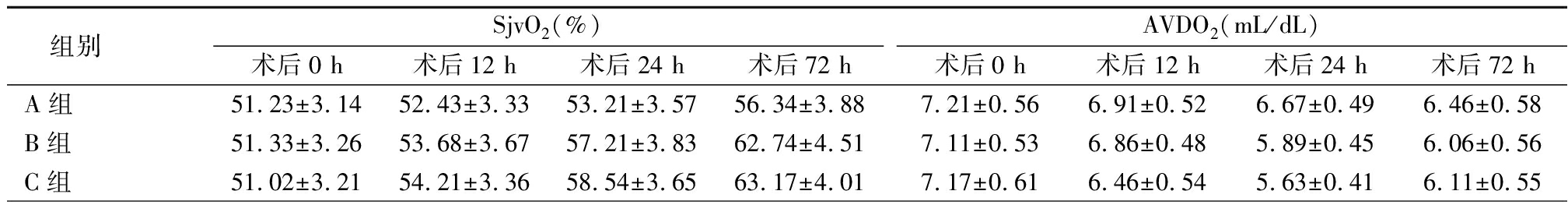
组别SjvO2(%)术后0 h术后12 h术后24 h术后72 hAVDO2(mL/dL)术后0 h术后12 h术后24 h术后72 hA组51.23±3.1452.43±3.3353.21±3.5756.34±3.887.21±0.566.91±0.526.67±0.496.46±0.58B组51.33±3.2653.68±3.6757.21±3.8362.74±4.517.11±0.536.86±0.485.89±0.456.06±0.56C组51.02±3.2154.21±3.3658.54±3.6563.17±4.017.17±0.616.46±0.545.63±0.416.11±0.55
表5 (续)
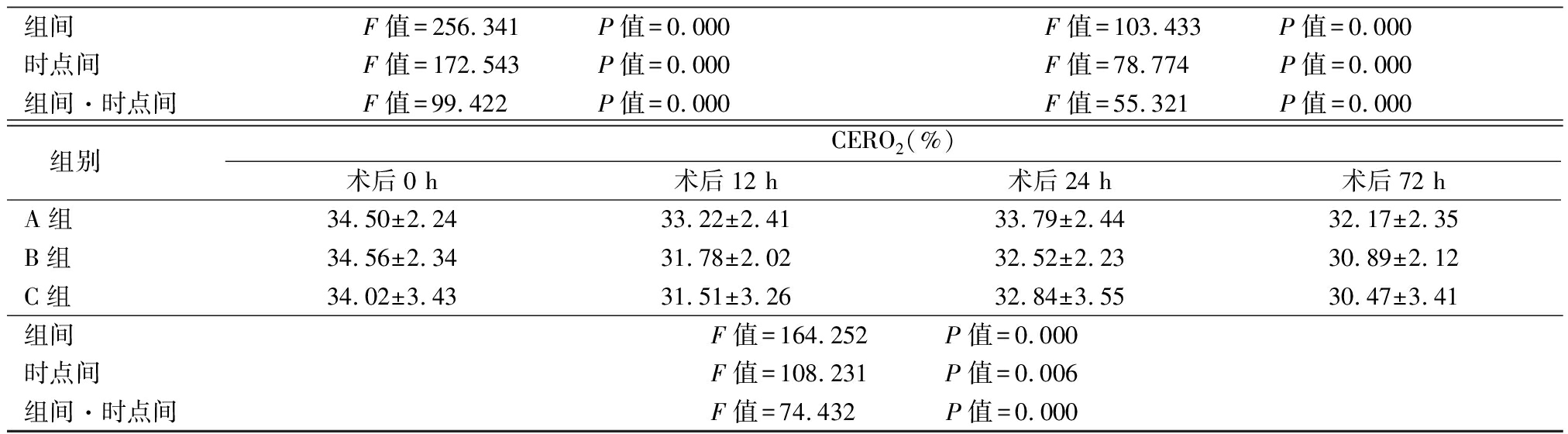
组间F值=256.341 P值=0.000F值=103.433 P值=0.000时点间F值=172.543 P值=0.000F值=78.774 P值=0.000组间·时点间F值=99.422 P值=0.000F值=55.321 P值=0.000 组别CERO2(%)术后0 h术后12 h术后24 h术后72 hA组34.50±2.2433.22±2.4133.79±2.4432.17±2.35B组34.56±2.3431.78±2.0232.52±2.2330.89±2.12C组34.02±3.4331.51±3.2632.84±3.5530.47±3.41组间F值=164.252 P值=0.000时点间F值=108.231 P值=0.006组间·时点间F值=74.432 P值=0.000
2.5 3组不良反应发生率比较 A组出现心动过缓1例、低氧血症1例、低血压1例,不良反应发生率为5.00%(3/60);B组出现心动过缓2例、低氧血症1例、低血压1例、谵妄2例,不良反应发生率为10.00%(6/60);C组出现心动过缓3例、低氧血症2例、低血压2例、谵妄3例,不良反应发生率为16.67% (10/60)。3组不良反应发生率差异无统计学意义(χ2=1.354,P=0.113)。
3 讨 论
传统镇静药和麻醉药物大多数是通过γ-氨基丁酸系统作用于大脑皮层,而右美托咪定作用于大脑皮层下蓝斑核,激活α2肾上腺素受体腺苷环化酶通路,调控脑缺血区血流灌注及脑神经元细胞凋亡,增强生长因子的表达,减少NO含量保护脑神经,主要经血浆非特异性酯酶水解代谢,起效快,镇静镇痛效果强,作用时间短,消除快,重复用药无蓄积作用[8-9]。研究表明,泵注右美托咪定能快速激活外周血管平滑肌中的α2肾上腺素受体,提高血压,减缓心率[10]。还有研究表明,快速输注右美托咪定能快速激活外周血管平滑肌中的α2肾上腺素受体,提高血压,减缓心率[11-12]。本研究结果显示,B组和C组患者在术后12 h,24 h,72 h的血流动力学指标HR、RR、MAP、SpO2改变相当,有利于减轻芬太尼用量,不良反应发生率没有升高,可以节约药费成本。故认为0.5 μg·kg-1·h-1右美托咪定剂量最好。这归因于0.5 μg·kg-1·h-1右美托咪定可增加迷走神经张力,维持术中血流动力学稳定,减轻术后应激反应,可能通过增加脑干蓝斑核副交感神经输出、收缩外周血管而实现[13]。
右美托咪定作用外周神经的具体机制尚未统一。有研究认为右美托咪定在外周神经周围直接被缓慢吸收入血,抑制外周或中枢α2肾上腺素受体活化[14]。动物实验表明,高浓度右美托咪定可直接阻断控钠、钾通道电压门,激活的环核苷酸门控通道,抑制产生神经细胞膜动作电位而发挥局部麻醉药物效果[15]。本研究中给予0.5 μg·kg-1·h-1右美托咪定患者Ramsay评分较低,GCS评分较高,这可能归因于0.5 μg·kg-1·h-1右美托咪定可以较合理地通过与外周神经作用靶点结合,没有过度抑制背根神经元伤害性通路中P物质的释放而发挥镇静作用,这一点还需进一步研究证实;同时右美托咪定在撤除给药后,患者的镇静效果可快速恢复[16];最后是患者术中舒芬太尼用量较少,唤醒时间较短,进一步说明0.5 μg·kg-1·h-1右美托咪定可减少其他辅助镇痛药物剂量,减轻患者的经济负担,提高安全性。
临床颅脑手术中监测患者脑氧供需平衡可有效保护脑组织,快速反馈病情变化并给予对症治疗。而脑静脉血检测指标多采用颈内静脉球部血液测定计算的SjvO2、PjvO2、AVDO2、CERO2。AVDO2、SjvO2指标反映全脑血流代谢情况,CERO2反映脑组织摄取和耗氧能力,这3个指标共同反映患者的脑氧供需平衡情况[17-18]。本研究结果显示,3组SjvO2明显升高,AVDO2、CERO2均明显降低。AVDO2、CERO2降低表明脑氧供充足、脑灌注改善,说明0.5 μg·kg-1·h-1右美托咪定能降低颅脑损伤患者的脑氧代谢,维持脑氧供需平衡,保护脑组织。本研究结果还显示,3组Ramsay评分和VAS评分呈降低趋势,GCS评分呈升高趋势,B组上述指标变化更明显。表明0.5 μg·kg-1·h-1右美托咪定可以有效降低应激反应,保护脑组织及脑外周神经,镇静镇痛效果显著。研究表明,右美托咪定剂量过大会导致低血压、心动过缓及过度镇静[19]。本研究结果显示,3组术后不良反应(心动过缓、低血压、低氧血症及谵妄)发生率较低,B组和C组GCS评分明显升高。可能与右美托咪定短的消除半衰期(仅2 h)有关,在一定浓度范围内可以很好地发挥药物镇痛、抗焦虑作用,但消褪也快,同时稳定血流动力学、降低应激反应,发挥镇静镇痛等作用[20]。提示在临床应用中应优先选择0.5 μg·kg-1·h-1右美托咪定给药剂量。
综上所述,重症颅脑损伤患者在术中给予0.5 μg·kg-1·h-1右美托咪定静脉维持可明显发挥术后镇静镇痛效果,同时有效稳定血流动力学,增强脑氧代谢,且并发症发生率低。本研究的不足是没有探讨右美托咪定的使用剂量对其他外周神经的影响及患者远期谵妄情况,有待后期深入探究。另外,虽然0.5 μg·kg-1·h-1右美托咪定静脉维持可用于重症监护病房的镇痛镇静,起到脑保护作用,但对昏迷较深患者促清醒作用尚不明确。
[1] 张利超,张强.颅脑损伤后神经炎症研究进展[J].广东医学,2017,38(z1):323-324.
[2] 唐泽,陶武,王念,等.右美托咪定与咪达唑仑在重症颅脑损伤患者术后镇静效果中的比较[J].重庆医学,2016,45(13):1820-1821.
[3] Oddo M,Crippa IA,Mehta S,et al. Optimizing sedation in patients with acute brain injury[J]. Crit Care,2016,20(1):128.
[4] 李鸿志.右美托咪定对老年胸科手术患者围术期脑氧代谢及术后认知功能障碍的影响[J].实用医院临床杂志,2016,13(5):161-163.
[5] 郄晓娟,郑文婧,郭洪艳,等.右美托咪定辅助老年患者镇静时脑电双频指数与Ramsay镇静评分的相关性[J].中国新药与临床杂志,2017,36(5):283-287.
[6] 李会兵,陈谦学.颅内压监测对重度颅脑外伤行开颅血肿清除术患者GCS评分、并发症及预后的影响[J].实用临床医药杂志,2017,21(11):73-76.
[7] Badenes R,Bilotta F. Inhaled sedation in acute brain injury patients[J]. Br J Anaesth,2016,116(6):883-884.
[8] 周晓辉,郭琼梅,王莉,等.盐酸右美托咪定在小儿体外循环心内直视手术快通道麻醉中的应用[J].河北医科大学学报,2018,39(12):1447-1450,1454.
[9] Ketharanathan N,Yamamoto Y,Rohlwink U,et al. Analgosedation in paediatric severe traumatic brain injury(TBI): practice,pitfalls and possibilities[J]. Childs Nerv Syst,2017,33(10):1703-1710.
[10] 凌文娟,沈志强,曹冰,等.右美托咪定对重型颅脑损伤患者术后持续镇静的效果及脑组织的保护作用[J].现代生物医学进展,2016,16(18):3533-3536.
[11] Plummer MP,Notkina N,Timofeev I,et al. Cerebral metabolic effects of strict versus conventional glycaemic targets following severe traumatic brain injury[J]. Crit Care,2018,22(1):16.
[12] Okonkwo DO,Shutter LA,Moore C,et al. Brain oxygen optimization in severe traumatic brain injury phase-Ⅱ:a phase Ⅱ randomized trial[J]. Crit Care Med,2017,45(11):1907-1914.
[13] Owen AM. Functional neuroimaging after severe anoxic brain injury in children may reveal preserved,yet covert,cognitive function[J]. Hum Brain Mapp,2017,38(10):4832-4833.
[14] 张梅,殷凯,余健,等.右美托咪定对颅脑损伤手术患者的脑保护作用[J].江苏医药,2017,43(3):193-195.
[15] Kochanek PM,Bayir H. Titrating the dose of oxygen after severe traumatic brain injury in the era of precision medicine[J]. J Neurotrauma,2017,34(22):3067-3069.
[16] 张炤杰,常荣华,敖丹.右美托咪定联合舒芬太尼镇静对颅脑损伤患者免疫功能的影响[J].现代仪器与医疗,2016,22(6):133-135.
[17] 马丁雷,刘苏,张锦荣,等.右美托咪定在重型颅脑外伤患者手术麻醉中脑保护作用研究[J].陕西医学杂志,2017,46(1):30-32.
[18] 李媛,王世禄,衣晓卓,等.右美托咪定复合依托咪酯全麻对老年心脏手术患者脑氧代谢的影响[J].中国现代应用药学,2016,33(2):212-216.
[19] 马红梅,郭莹莹,吴智宏,等.静脉泵注右美托咪定对颅脑手术患者炎性因子、脑氧代谢及认知功能的影响研究[J].实用心脑肺血管病杂志,2016,24(11):35-39.
[20] 王贵成,管艳,盛大卫.不同靶控浓度右美托咪定对颅内动脉瘤患者脑氧代谢影响研究[J].现代中西医结合杂志,2017,26(11):1238-1240.