在全球范围内,肺癌是常见和致死率最高的恶性肿瘤,占所有癌症相关死亡的近20%[1]。2018年全球肺癌新发病例达到209万余例,肺癌相关死亡病例高达176万余例,同年我国统计数据显示约有77.4万的新增肺癌病例,其中69万人死于肺癌[2]。非小细胞肺癌(non-small cell lung cancer,NSCLC)是最常见的肺癌类型,约占所有原发性肺癌的85%,并且由于NSCLC的生理病理学特点,使很多患者在诊断时已是晚期,失去了最佳手术时机[1,3]。许多年以来,细胞毒性化疗是唯一可以延长晚期NSCLC患者存活率的治疗,传统的含铂双药化疗是治疗晚期NSCLC的标准方案,但5年生存率不足5%[3-4]。近年来,随着测序技术的进步和对肿瘤细胞生物学的进一步了解,NSCLC靶向治疗有所发展[5-6],但其仅针对特定驱动基因突变,驱动基因阴性患者仍亟待新的治疗方法。癌症免疫疗法是一种激活免疫系统识别并杀伤癌细胞的治疗方法[7-8]。针对肿瘤免疫逃逸的免疫检查点抑制剂已被研发问世[9],这些药物通过调节T细胞功能发挥作用,增强宿主对肿瘤细胞的免疫反应[3,5,8]。
从2012年程序性细胞死亡受体1(programmed cell death protein 1,PD-1)抑制剂的第1篇报道到2015年美国食品和药物管理局(Food and Drug Administration,FDA)的首次批准,免疫治疗的进展非常迅速[10],目前,FDA针对NSCLC批准了4种免疫检查点抑制剂:包括PD-1抑制剂帕博利珠单抗(Pembrolizumab)和纳武利尤单抗(Nivolumab),程序性细胞死亡配体1(PD-L1)抑制剂阿特珠单抗(Atezolizumab)和德瓦鲁单抗(Durvalumab),已有2个免疫检查点抑制剂在我国获批用于治疗晚期肺癌患者,包括帕博利珠单抗(Pembrolizumab)和纳武利尤单抗(Nivolumab),均为PD-1抑制剂。随着我国免疫检查点抑制剂药物的不断发展以及药物可及性的不断提高,我国临床实践中对晚期NSCLC患者的治疗也步入了免疫治疗时代,相关医学专业人员必须与新兴的循证医学数据、当前的实践指南和新药开发保持同步,以最大程度地提高临床效果,故此,有必要总结符合临床实际的共识内容,以指导临床科室合理使用免疫检查点抑制剂治疗NSCLC患者,规范化开展临床诊疗活动。为此,本文对相关临床数据、指南进行解读,对晚期NSCLC免疫治疗的应用进行总结讨论,以指导临床免疫检查点抑制剂的应用。
1 方法学
基于已发表的国内外临床研究证据,结合了我国特色临床实践经验,对目前免疫检查点抑制剂在晚期NSCLC治疗中的应用进行讨论和解读。因此,本文内容是基于现有的中国和国际临床高质量循证医学证据以及专家组广泛认可的临床经验。
通过PubMed、EMBASE、万方医学网和中国知网进行文献检索学习,在PubMed和EMBASE使用的检索式为: Pembrolizumab(Title/Abstract) OR Keytruda(Title/Abstract) AND non small cell lung cancer(Title) ;Nivolumab(Title/Abstract) OR Opdivo(Title/Abstract) AND non small cell lung cancer(Title);Atezolizumab(Title/Abstract) OR Tecentriq(Title/Abstract) AND non small cell lung cancer(Title);Durvalumab(Title/Abstract) OR Imfinzi(Title/Abstract) AND non small cell lung cancer(Title)。在万方医学网和中国知网使用的检索式为:“(摘要:帕博利珠单抗或摘要:帕博利珠或摘要:可瑞达)和(标题:肺癌)”;“(摘要:纳武利尤单抗或摘要:纳武利尤或摘要:欧狄沃)和(标题:肺癌)”;“(摘要:阿特珠单抗)和(标题:肺癌)”;“(摘要:德瓦鲁单抗)和(标题:肺癌)”。检索的文献限于综述、荟萃分析(Meta分析)和随机对照临床研究,剔除重复文献、新闻报道、述评、来信、编辑点评、叙述性综述以及后续未发表于同行评审期刊的会议摘要。最后得到帕博利珠单抗、纳武利尤单抗、阿特珠单抗及德瓦鲁单抗的英文文献分别为335篇、507篇、153篇及75篇;未检索到符合上述要求的中文文献。
本共识推荐内容参照“CSCO诊疗指南证据类别”[11]见表1。
表1 CSCO诊疗指南证据类别

类别水平来源CSCO专家共识度1A高 严谨的Meta分析、大型随机对照临床研究一致共识(支持意见≥80%)1B高 严谨的Meta分析、大型随机对照临床研究基本一致共识,但争议小(支持意见 60%~80%)2A稍低一般质量的Meta分析、小型随机对照研究、设计良好的大型回顾性研究、病例-对照研究一致共识(支持意见≥80%)2B稍低一般质量的Meta分析、小型随机对照研究、设计良好的大型回顾性研究、病例-对照研究基本一致共识,但争议小(支持意见 60%~80%)3低 非对照单臂研究、病例报告、专家意见无共识,且争议大(支持意见<60%)
2 NSCLC免疫检查点抑制剂药物临床应用推荐
本文旨在为临床工作者在临床实践中使用免疫检查点抑制剂治疗NSCLC患者提供规范指引,因此只针对已获得FDA批准用于晚期肺癌治疗的4个药物,即帕博利珠单抗、纳武利尤单抗、阿特珠单抗及德瓦鲁单抗展开,推荐意见基于我国的临床数据以及国际重要研究结果。
2.1 纳武利尤单抗用于晚期NSCLC一线治疗的临床证据和推荐意见 CheckMate 026 Ⅲ期临床试验,541例未接受过治疗的PD-L1阳性晚期NSCLC患者,应用纳武利尤单抗对比一线标准含铂双药化疗方案进行了随机Ⅲ期研究[12],但未达到其主要终点:与铂类化疗相比,即使在PD-L1≥50%亚组中,纳武利尤单抗治疗组其无进展生存期(progression-free survival,PFS)和总生存期(overall survival,OS)均无改善。
CheckMate 227 Ⅲ期临床试验的结果表明,一线联合应用纳武利尤单抗+Ipilimumab治疗的晚期鳞状和非鳞状NSCLC高肿瘤突变负荷(tumor mutation burden,TMB)的患者,与化疗相比其PFS升高,无论肿瘤PD-L1表达如何(HR=0.58,97.5%CI:0.41~0.81,P<0.001)。 该研究最近发布的数据表明,与单独接受化疗的患者相比,接受纳武利尤单抗+化疗的晚期NSCLC患者的中位PFS也有所增加(分别为5.6个月和4.7个月,HR=0.74,95%CI:0.58~0.94)[13]。由于CheckMate 227试验尚正在进行中,目前尚未批准纳武利尤单抗+Ipilimumab和纳武利尤单抗+化疗方案用于晚期NSCLC患者的治疗。
2.2 纳武利尤单抗用于晚期NSCLC二线治疗的临床证据和推荐意见 在2项大型国际Ⅲ期临床试验中,对于晚期鳞状和非鳞状细胞肺癌的患者,在一线标准含铂化疗病情进展后,应用纳武利尤单抗(3 mg/kg,1次/2周)对比二线多西他赛化疗,其具有更高的生存获益。在鳞状细胞NSCLC的试验中,纳武利尤单抗改善了272例先前接受一线标准化疗的晚期鳞状NSCLC的中位总生存(median overall survival,mOS)(mOS:9.2个月vs 6.0个月,HR=0.59,95%CI:0.44~0.79,P<0.001)。在非鳞状NSCLC中,纳武利尤单抗在582例患者中的中位OS亦明显优于多西他赛(mOS:12.2个月vs 9.4个月, HR=0.73,95%CI:0.60~0.89,P=0.002)[14]。据报道,在这2项试验中,接受纳武利尤单抗治疗组的患者中≤10%的患者发生3级以上与治疗相关不良反应,而多西他赛治疗组中约有55%的患者发生3级以上与治疗相关不良反应[14-15]。 根据这些结果,FDA已批准纳武利尤单抗静脉给予240 mg固定剂量,1次/2周,用于已接受一线含铂标准化疗方案治疗失败的转移性鳞状NSCLC(2015年3月)和非鳞状NSCLC(2015年10月)。此外,FDA批准纳武利尤单抗静脉给药480 mg固定剂量,1次/4周,该方案可用于以前批准的用于纳武利尤单抗治疗NSCLC患者的所有适应证[15]。
CheckMate 017和CheckMate 057数据汇总显示,纳武利尤单抗与多西他赛的2年总生存率分别为:鳞状细胞癌23%(95%CI:16%~30%)对比8%(95%CI:4%~13%)和非鳞状细胞癌中分别为29%(95%CI:24%~34%)对比16%(95%CI:12%~20%);且在纳武利尤单抗治疗组中,27例鳞状NSCLC患者中有10例(37%)和56例非鳞状NSCLC患者中有19例(34%)在至少2年的随访后仍有持续反应,但2个多西他赛治疗组均无持续反应。在汇总分析中,纳武利尤单抗与多西他赛相比,死亡风险相对降低28%(HR=0.72,95%CI:0.62~0.84),且纳武利尤单抗组治疗相关不良事件的发生率低于多西他赛(任何级别,68% vs 88%;3~4级,10% vs 55%)[16]。
在我国进行的CheckMate 078研究也显示,在鳞状及非鳞状NSCLC中纳武利尤单抗相较于二线化疗有明显优势,纳武利尤单抗治疗组(n=338)与多西他赛组(n=166)比较,OS明显改善:中位OS分别为12.0个月(95%CI:10.4~14.0)与9.6个月(95%CI:7.6~11.2)(HR=0.68,95%CI:0.52~0.90,P=0.000 6)[17]。
2.3 帕博利珠单抗用于晚期NSCLC一线治疗的临床证据和推荐意见 在一项开放标签研究中,将305例未经治疗的晚期NSCLC(无EGFR或ALK突变且PD-L1 TPS评分≥50%)的患者随机分配入Pembrolizumab(每3周200 mg固定剂量)治疗组或研究者选择的含铂化疗组中,帕博利珠单抗组的PFS明显更长(中位10.3个月vs 6.0个月,HR=0.5,95%CI:0.37~0.68,P<0.001),6个月时的OS率也明显高于化疗组(80.2% vs 72.4%,HR=0.6,95%CI:0.41~0.89,P=0.005)[18]。 根据这些结果,FDA在2017年10月24日批准了帕博利珠单抗用于PD-L1高表达(TPS≥50%)且驱动基因(EGFR和ALK)阴性的晚期NSCLC患者的一线治疗。该试验的后续报道显示,中位随访时间为25.2个月时,帕博利珠治疗组的中位OS为30.0个月(95%CI:18.3个月至未达到),化疗组为14.2个月(95%CI:9.8~19.0个月)(HR=0.63,95%CI:0.47~0.86)[19]。
KEYNOTE-042研究基于上述结果进一步扩大受试人群,共有1 274例患者进行了随机分组,每个治疗组637例,其中有599例(47.0%)患者PD-L1 TPS≥50%,818例(64.2%)患者PD-L1 TPS≥20%。帕博利珠单抗显著延长了患者的OS,TPS≥50%(HR=0.69,95%CI:0.56~0.85,P=0.000 3),TPS≥20%(HR=0.77,95%CI:0.64~0.92,P=0.002 0),TPS≥1% (HR=0.81,95%CI:0.71~0.93,P=0.001 8),患者的平均生存期(帕博利珠单抗对比化疗)分别为:TPS≥50%:20.0个月(95%CI:15.4~24.9)对比 12.2个月(95%CI:10.4~14.2);TPS≥20%:17.7个月(95%CI:15.3~22.1)对比13.0个月(95%CI:11.6~15.3);TPS≥1%:16.7个月(95%CI:13.9~19.7)对比12.1个月(95%CI:11.3~13.3)[20]。该研究结果表明,帕博利珠单抗作为一线治疗其获益人群可扩展到EGFR和ALK阴性且PD-L1 TPS≥1%的局部晚期或转移性NSCLC患者,FDA已批准帕博利珠单抗单药用于PD-L1 TPS 1%~49% 且EGFR和ALK阴性的转移性NSCLC患者的一线治疗(2B类证据)。
在另一项随机Ⅱ期研究中,对123例转移性非鳞状NSCLC的初治患者(无论PD-L1表达)进行了随机对照试验,将帕博利珠单抗联合化疗(卡铂和培美曲塞)作为一线治疗与单独化疗对比,结果显示,帕博利珠单抗联合化疗的总缓解率几乎是单纯化疗组的2倍[55%(95%CI:42~68)对比29%(95%CI:18~41);P=0.003 2],帕博利珠单抗联合化疗可明显延长PFS(HR=0.53,95%CI:0.31~0.91; P=0.02),中位PFS分别为13.0个月(95%CI:8.3~不可估计)对比8.9个月(95%CI:4.4~10.3)[21]。基于这些结果,FDA在2017年5月10日加速批准帕博利珠单抗联合卡铂和培美曲塞独立于PD-L1表达状态用于非鳞状NSCLC患者的一线治疗。该试验的后续数据为中位数随访23.9个月,显示出持续且统计学上显著的PFS获益[19.0个月vs 8.9个月,HR=0.53 (95%CI:0.33~0.86),P=0.004 9],其总缓解率也明显优于化疗组(56.7% vs 30.2%,95%CI:8.9%~42.4%,P=0.001 6],联合用药的OS也表现出持续改善(HR=0.56,95%CI:0.32~0.95; P= 0.015 1),联合治疗组中位OS尚未达到(单独接受化疗的时间为20.9个月)[22]。在最近报道的一项Ⅲ期临床试验也得到了相似的结果,晚期或转移性非鳞状NSCLC患者(无论PD-L1表达)接受帕博利珠单抗联合化疗(培美曲塞加顺铂或卡铂)治疗,与单纯化疗的患者相比,中位随访(10.5个月)时死亡风险降低了51%(HR=0.49,95%CI:0.38~0.64,P<0.001)[23]。
帕博利珠单抗与卡铂+白蛋白结合型紫杉醇/紫杉醇联合作为晚期鳞状细胞NSCLC患者的一线治疗药物同样进行了随机对照试验,来自KEYNOTE-407 Ⅲ期临床试验的最新数据表明,与单独接受化疗的患者相比,接受帕博利珠单抗+化疗联合治疗的患者在中位随访(7.8个月)时OS率升高,HR=0.64%(95%CI:0.49~0.85,P=0.000 8)。此外,无论患者PD-L1的表达状态如何,均可观察到联合治疗带来的OS获益[TPS<1%,HR=0.61(95%CI:0.35~0.98);TPS 1%~49%,HR=0.57(95%CI:0.36~0.90);TPS≥50%,HR=0.64(95%CI:0.37~1.10)][24]。基于这些数据,2018年10月31日,美国FDA批准帕博利珠单抗联合化疗(卡铂+白蛋白结合型紫杉醇/紫杉醇)用于一线治疗晚期鳞状NSCLC,且不需要考虑肿瘤的PD-L1表达水平。
2.4 帕博利珠单抗用于晚期NSCLC二线治疗的临床证据和推荐意见 首先对帕博利珠单抗进行了Ⅰ期剂量扩展试验,纳入495例晚期NSCLC患者,研究剂量为每3周2 mg/kg或10 mg/kg,或每2周10 mg/kg,研究结果显示,总缓解率为19.4%(95%CI:16%~23.2%),394例先前接受过治疗的患者中缓解率为18%(95%CI:14.4%~22.2%),101例未经治疗的患者中缓解率为24.8%(95%CI:16.7~34.3)。在这项研究中,具有中或高PD-L1表达(TPS≥1% 或≥50%)的患者与没有PD-L1表达的患者相比,预后更好[25]。随后对1 034例先前治疗的PD-L1 TPS≥1%患者进行的Ⅱ/Ⅲ期研究,帕博利珠单抗治疗组对比二线多西他赛化疗组,帕博利珠单抗剂量分为2 mg/kg或10 mg/kg组,结果显示,对比多西他赛化疗组,帕博利珠单抗2 mg/kg组HR为0.71(95%CI:0.58~0.88,P=0.001);10 mg/kg组HR为0.61(95%CI:0.49~0.75, P<0.001)[26]。 体重和清除率的关系支持帕博利珠单抗按体重给药(2 mg/kg ,1次/3周)和固定剂量给药(200 mg)导致适当且相似的暴露量。根据这些数据,2015年10月2日,FDA批准帕博利珠单抗(200 mg固定剂量,静脉给药,1次/3周)用于PD-L1阳性(TPS≥1%)且EGFR和ALK阴性的一线治疗后进展的晚期转移性NSCLC。
2.5 阿特珠单抗用于晚期NSCLC一线治疗的临床证据和推荐意见 IMpower 150 Ⅲ期临床研究中,对既往未接受化疗的转移性非鳞状NSCLC患者一线联合治疗方案进行了探索,对比了阿特珠单抗加卡铂加紫杉醇(Atezolizumab and Carboplatin and Paclitaxel,ACP)、贝伐珠单抗加卡铂加紫杉醇(Bevacizumab and Carboplatin and Paclitaxel,BCP)或阿特珠单抗加贝伐珠单抗卡铂加紫杉醇(Atezolizumab and Bevacizumab and Carboplatin and Paclitaxel,ABCP)3种治疗方案,结果显示,与接受贝伐珠单抗联合化疗治疗的患者相比,接受四联疗法的患者中位PFS显著改善,分别为8.3个月和6.8个月,HR为0.62(95%CI:0.52~0.74,P<0.0001),进一步亚组分析显示,PD-L1低表达或阴性患者中,ABCP方案治疗的患者PFS比BCP方案治疗的患者显著获益[27]。基于该研究结果,FDA批准阿特珠单抗联合贝伐珠单抗联合卡铂加紫杉醇用于无EGFR及ALK突变及EGFR及ALK突变的靶向治疗耐药后的晚期NSCLC患者的一线治疗。此外,IMpower 131 Ⅲ期临床试验的最新数据表明,在晚期鳞状NSCLC一线治疗中,与单纯化疗相比,联合阿特珠单抗可延长患者总生存,联合阿特珠单抗组及单纯化疗组的OS分别为6.3个月和5.6个月,HR为0.71 (95%CI:0.60~0.85,P<0.000 1),亚组分析显示,在高PD-L1患者中,与化疗相比,观察到阿特珠单抗联合化疗可显著改善OS(23.6个月vs 14.1个月,HR=0.56,95%CI:0.32~0.99)。但是,在PD-L1低表达(TPS 1%~49%)或阴性(TPS<1%)亚组中,在接受阿特珠单抗联合化疗或单独化疗的患者之间未观察到OS差异(12.4个月vs 16.6个月,HR=1.34,95%CI:0.95~1.9)[28],目前该研究仍在进行中,尚未有相关适应证获批。
2.6 阿特珠单抗用于晚期NSCLC二线治疗的临床证据和推荐意见 在一项Ⅱ期临床研究中,研究者应用阿特珠单抗单药治疗659例PD-L1阳性(IC2/3或TC2/3)的NSCLC患者,将其按照未接受过化疗、接受过一线化疗及接受过二线以上化疗分为3个队列,随访12个月,3个队列的总缓解率为18%~22%,中位OS分别为23.5个月、15.5个月和13.2个月,其中队列1中TC3或IC3患者中位OS为26.9个月。该实验初步证实了阿特珠单抗在晚期NSCLC中的疗效[29]。
POPLAR研究对比了一线治疗进展后,阿特珠单抗对比标准二线化疗方案用于晚期或转移性NSCLC中的疗效,结果显示,阿特珠单抗治疗组的中位OS为12.6个月(95%CI:9.7~16.4个月),而对照多西他赛组中位OS仅为9.7个月(95%CI:8.6~12.0个月),危险比为0.73(95%CI:0.53~0.99,P=0.04),进一步亚组分析显示,总生存率的提高与PD-L1表达增加有关(TC3或IC3组 HR=0.49,95%CI:0.22~1.07,P=0.068;TC2/3或IC2/3组HR=0.54,95%CI:0.33~0.89,P=0.014;TC1/2/3或IC1/2/3组 HR=0.59,95%CI:0.40~0.85,P=0.005;TC0和IC0组HR=1.04,95%CI:0.62~1.75,P=0.871)[30]。FDA基于该研究结果于2016年10月18日批准了阿特珠单抗(1 200 mg 静脉给药,1次/3周)用于含铂化疗失败后的转移性NSCLC(无论PD-L1表达如何)。随后的一项Ⅲ期临床试验进一步扩大了样本量,在850例既往接受含铂化疗后进展的患者中对比了阿特珠单抗与多西他赛的疗效,结果显示,阿特珠单抗治疗组的中位OS为15.7个月(95%CI:12.6~18.0个月),对照组多西他赛治疗组的中位OS仅为10.3个月(95%CI:8.8~12.0);HR=0.74(95%CI:0.58~0.93),P=0.010 2;即使是PD-L1低表达或不表达的亚组(TC0和IC0)中,使用阿特珠单抗治疗的患者其生存率也较化疗组显著提高(中位总生存期12.6个月vs 8.9个月,HR=0.75,95%CI:0.59~0.96)[31],该实验结果进一步证实了,无论PD-L1表达如何,阿特珠单抗用于含铂化疗失败后的转移性NSCLC疗效均显著优于化疗。
2.7 德瓦鲁单抗(Durvalumab)用于局部晚期不可切除的Ⅲ期NSCLC同步放化疗后维持治疗的临床证据和推荐意见 德瓦鲁单抗针对局部晚期不可切除的Ⅲ期NSCLC患者临床试验, 一项Ⅲ期随机对照实验中,有713例局部晚期不可切除的Ⅲ期NSCLC患者接受了德瓦鲁单抗(n=476)或安慰剂(n=237)作为同步含铂化疗及放疗后的巩固疗法,与安慰剂相比,接受德瓦鲁单抗治疗的患者其PFS显著延长(16.8个月vs 5.6个月,HR=0.52,95%CI:0.42~0.65,P<0.001),不论基线PD-L1肿瘤表达如何。此外,德瓦鲁单抗治疗的患者其3/4级不良事件发生率与(29.9%)和安慰剂(26.1%)相似。基于以上数据,2018年2月16日,FDA批准了德瓦鲁单抗用于局部晚期不可切除的Ⅲ期NSCLC患者接受含铂化疗及放疗后的巩固疗法[32]。
本共识推荐免疫检查点临床应用见表2。
表2 免疫检查点临床应用推荐
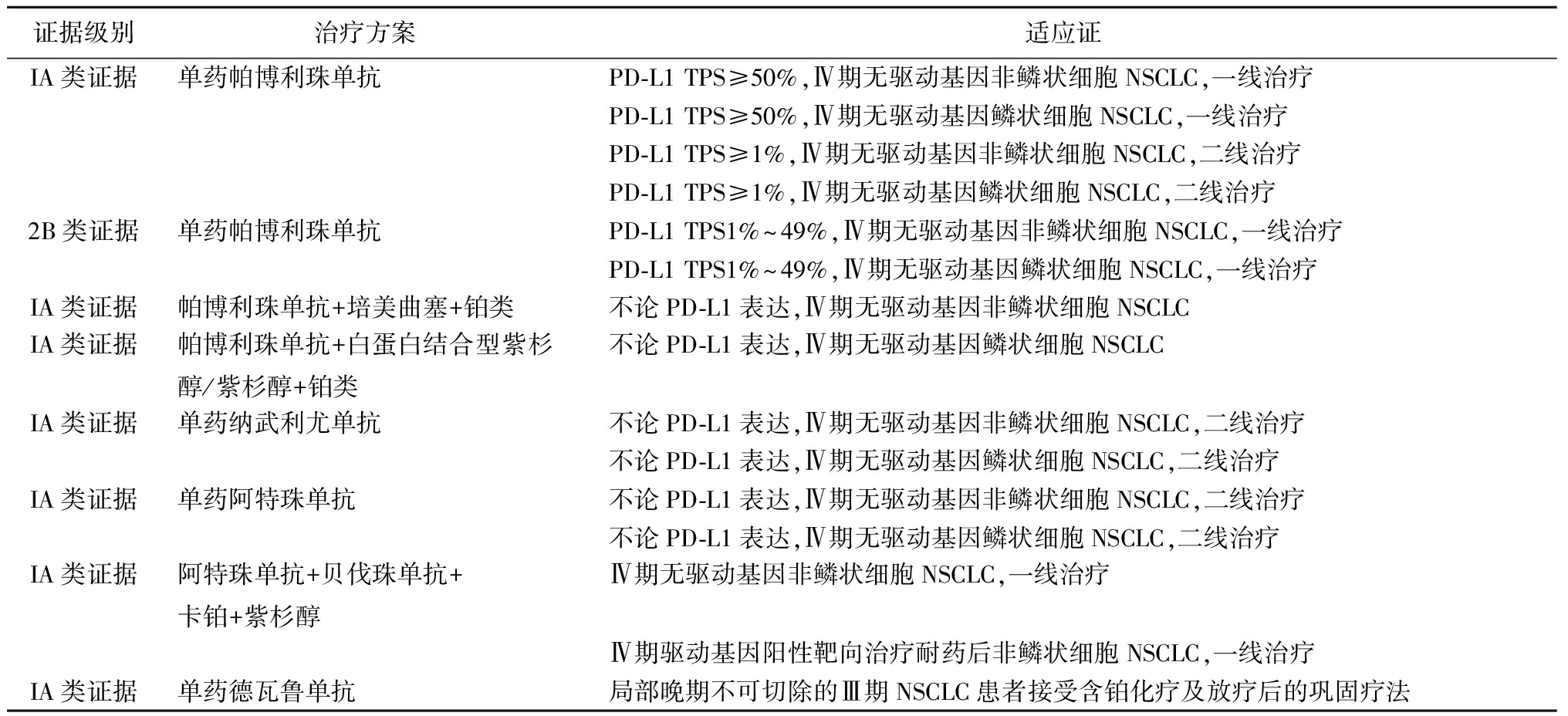
证据级别治疗方案适应证IA类证据单药帕博利珠单抗PD-L1 TPS≥50%,Ⅳ期无驱动基因非鳞状细胞NSCLC,一线治疗PD-L1 TPS≥50%,Ⅳ期无驱动基因鳞状细胞NSCLC,一线治疗PD-L1 TPS≥1%,Ⅳ期无驱动基因非鳞状细胞NSCLC,二线治疗PD-L1 TPS≥1%,Ⅳ期无驱动基因鳞状细胞NSCLC,二线治疗2B类证据单药帕博利珠单抗PD-L1 TPS1%~49%,Ⅳ期无驱动基因非鳞状细胞NSCLC,一线治疗PD-L1 TPS1%~49%,Ⅳ期无驱动基因鳞状细胞NSCLC,一线治疗IA类证据帕博利珠单抗+培美曲塞+铂类不论PD-L1表达,Ⅳ期无驱动基因非鳞状细胞NSCLCIA类证据帕博利珠单抗+白蛋白结合型紫杉醇/紫杉醇+铂类不论PD-L1表达,Ⅳ期无驱动基因鳞状细胞NSCLCIA类证据单药纳武利尤单抗不论PD-L1表达,Ⅳ期无驱动基因非鳞状细胞NSCLC,二线治疗不论PD-L1表达,Ⅳ期无驱动基因鳞状细胞NSCLC,二线治疗IA类证据单药阿特珠单抗不论PD-L1表达,Ⅳ期无驱动基因非鳞状细胞NSCLC,二线治疗不论PD-L1表达,Ⅳ期无驱动基因鳞状细胞NSCLC,二线治疗IA类证据阿特珠单抗+贝伐珠单抗+卡铂+紫杉醇Ⅳ期无驱动基因非鳞状细胞NSCLC,一线治疗Ⅳ期驱动基因阳性靶向治疗耐药后非鳞状细胞NSCLC,一线治疗IA类证据单药德瓦鲁单抗局部晚期不可切除的Ⅲ期NSCLC患者接受含铂化疗及放疗后的巩固疗法
3 免疫检查点抑制剂治疗相关不良反应
尽管免疫检查点抑制剂具有显著的临床获益,但其也会产生一系列与作用机制相关的不良反应,而这种不良反应与其他全身疗法(例如细胞毒性化学疗法或靶向治疗)完全不同,免疫检查点相关不良反应会影响身体的多个器官,常见于皮肤、胃肠道、肺及肌肉骨骼系统,可见于内分泌、肾脏、神经、血液及心血管系统,免疫检查点抑制剂相关不良反应可发生于治疗中,也可发生于停药后,其发生机制目前尚不明确。总体而言,严重的免疫相关毒性发生率极低。据报道,与治疗有关的肺炎是NSCLC患者的主要死亡原因,但这仅在<2%的患者中发生。相较于单药治疗,联合治疗相关不良反应更常见,且更严重,发展更早,持续时间更长[33-34]。
对这些毒性的早期识别和密切监测可以改善临床结果,同时最大程度减少对患者的伤害。依据NCCN指南建议,应于免疫检查点抑制剂治疗前及治疗中,常规监测肺功能、心电图、甲状腺功能、肝功能等[35],以早期识别和监测治疗相关不良反应。美国国家癌症研究所依据严重程度将不良反应分为4级,见表3[36]。
表3 药物不良反应分级

分级描述1级无症状或症状轻微;无需特殊干预可自行缓解2级与年龄相当的工具性日常生活活动受限;需要局部或非侵入性治疗3级症状严重但不会立即危及生命,个人自理能力受限;需住院给予全身性治疗4级危及生命的严重症状;需要高级生命支持等紧急治疗
免疫检查点相关不良反应会发生于身体的多个系统,其具体管理方法不尽相同。总体而言,1级毒性应继续进行治疗,并密切监测,大多数2级毒性,可以暂停治疗,症状恢复至1级或以下时恢复治疗,可以使用类固醇,3级毒性需要停止治疗并开始大剂量类固醇(泼尼松或甲泼尼龙1~2 mg·kg-1·d-1),类固醇应在至少4~6周的时间内递减,一些难治性病例可能需要英夫利昔单抗或其他免疫抑制剂治疗。通常,4级毒性建议永久终止治疗,但除外激素替代已控制的内分泌病变[33]。各系统具体管理办法详细参见SITC的毒性管理建议[34]。
4 总结及展望
凭借其显著的临床获益,可控的不良反应以及持久反应的潜力,免疫检查点抑制剂已迅速成为NSCLC患者的新的治疗标准。目前,仍有很多肿瘤免疫检查点抑制剂相关的单药治疗或联合治疗的临床试验正在进行,热切期望免疫检查点抑制剂能够用于更广泛的病种和人群中。
[1] Midha A,Dearden S,McCormack R. EGFR mutation incidence in non-small-cell lung cancer of adenocarcinoma histology:a systematic review and global map by ethnicity(mutMapⅡ)[J]. Am J Cancer Res,2015,5(9):2892-2911.
[2] 中国临床肿瘤学会血管靶向治疗专家委员会,非小细胞肺癌专家委员会,非小细胞肺癌抗血管生成药物治疗专家组. 晚期非小细胞肺癌抗血管生成药物治疗中国专家共识(2019版)[J]. 中国肺癌杂志,2019,22(7):401-412.
[3] Zago G,Muller M,van den Heuvel M,et al. New targeted treatments for non-small-cell lung cancer-role of nivolumab[J]. Biologics,2016,10:103-117.
[4] Gettinger S,Horn L,Jackman D,et al. Five-year follow-up of nivolumab in previously treated advanced non-small-cell lung cancer:results from the CA209-003 study[J]. J Clin Oncol,2018,36(17):1675-1684.
[5] Hirsch FR,Suda K,Wiens J,et al. New and emerging targeted treatments in advanced non-small-cell lung cancer[J]. Lancet,2016,388(10048):1012-1024.
[6] Ettinger DS,Wood DE,Aggarwal C,et al. NCCN guidelines insights:non-small cell lung cancer,version 1.2020[J]. J Natl Compr Canc Netw,2019,17(12):1464-1472.
[7] Hoos A. Development of immuno-oncology drugs-from CTLA4 to PD1 to the next generations[J]. Nat Rev Drug Discov,2016,15(4):235-247.
[8] Peterson JJ,Steele-Moses SK. Update on new therapies with immune checkpoint inhibitors[J]. Clin J Oncol Nurs,2016,20(4):405-410.
[9] Pennock GK,Chow LQ. The evolving role of immune checkpoint inhibitors in cancer treatment[J]. Oncologist,2015,20(7):812-822.
[10] Topalian SL,Hodi FS,Brahmer JR,et al. Safety,activity,and immune correlates of anti-PD-1 antibody in cancer[J]. N Engl J Med,2012,366(26):2443-2454.
[11] 程颖,吴一龙,陆舜,等.原发性肺癌诊疗指南[M].2018版. 北京:人民卫生出版社,2018:1-217.
[12] Carbone DP,Reck M,Paz-Ares L,et al. First-line nivolumab in stage IV or recurrent non-small-cell lung cancer[J]. N Engl J Med,2017,376(25):2415-2426.
[13] Reck M,Schenker M,Lee KH,et al. Nivolumab plus ipilimumab versus chemotherapy as first-line treatment in advanced non-small-cell lung cancer with high tumour mutational burden:patient-reported outcomes results from the randomised,open-label,phase Ⅲ CheckMate 227 trial[J]. Eur J Cancer,2019,116:137-147.
[14] Brahmer J,Reckamp KL,Baas P,et al. Nivolumab versus docetaxel in advanced squamous-cell non-small-cell lung cancer[J]. N Engl J Med,2015,373(2):123-135.
[15] Borghaei H,Paz-Ares L,Horn L,et al. Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer[J]. N Engl J Med,2015,373(17):1627-1639.
[16] Horn L,Spigel DR,Vokes EE,et al. Nivolumab versus docetaxel in previously treated patients with advanced non-small-cell lung cancer:two-year outcomes from two randomized,open-label,phase Ⅲ trials(checkmate 017 and checkMate 057)[J]. J Clin Oncol,2017,35(35):3924-3933.
[17] Wu YL,Lu S,Cheng Y,et al. Nivolumab versus docetaxel in a predominantly chinese patient population with previously treated advanced NSCLC:checkmate 078 randomized phase Ⅲ clinical trial[J]. J Thorac Oncol,2019,14:867-875.
[18] Reck M,Rodríguez-Abreu D,Robinson AG,et al. Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer[J]. N Engl J Med,2016,375(19):1823-1833.
[19] Reck M,Rodríguez-Abreu D,Robinson AG,et al. Updated analysis of KEYNOTE-024:pembrolizumab versus platinum-based chemotherapy for advanced non-small-cell lung cancer with PD-L1 tumor proportion score of 50% or greater[J]. J Clin Oncol,2019,37(7):537-546.
[20] Mok TSK,Wu YL,Kudaba I,et al. Pembrolizumab versus chemotherapy for previously untreated,PD-L1-expressing,locally advanced or metastatic non-small-cell lung cancer(KEYNOTE-042):a randomised,open-label,controlled,phase 3 trial[J]. Lancet,2019,393(10183):1819-1830.
[21] Langer CJ,Gadgeel SM,Borghaei H,et al. Carboplatin and pemetrexed with or without pembrolizumab for advanced,non-squamous non-small-cell lung cancer:a randomised,phase 2 cohort of the open-label KEYNOTE-021 study[J]. Lancet Oncol,2016,17(11):1497-1508.
[22] Borghaei H,Langer CJ,Gadgeel S,et al. 24-month overall survival from KEYNOTE-021 cohort G:pemetrexed and carboplatin with or without pembrolizumab as first-line therapy for advanced nonsquamous non-small cell lung cancer[J]. J Thorac Oncol,2019,14(1):124-129.
[23] Gandhi L,Rodríguez-Abreu D,Gadgeel S,et al. Pembrolizumab plus chemotherapy in metastatic non-small-cell lung cancer[J]. N Engl J Med,2018,378(22):2078-2092.
[24] Paz-Ares L,Luft A,Vicente D,et al. Pembrolizumab plus chemotherapy for squamous non-small-cell lung cancer[J]. N Engl J Med,2018,379(21):2040-2051.
[25] Garon EB,Rizvi NA,Hui R,et al. Pembrolizumab for the treatment of non-small-cell lung cancer[J]. N Engl J Med,2015,372(21):2018-2028.
[26] Herbst RS,Baas P,Kim DW,et al. Pembrolizumab versus docetaxel for previously treated,PD-L1-positive,advanced non-small-cell lung cancer(KEYNOTE-010):a randomised controlled trial[J]. Lancet,2016,387(10027):1540-1550.
[27] Reck M,Mok TSK,Nishio M,et al. Atezolizumab plus bevacizumab and chemotherapy in non-small-cell lung cancer(IMpower150):key subgroup analyses of patients with EGFR mutations or baseline liver metastases in a randomised,open-label phase 3 trial[J]. Lancet Respir Med,2019,7(5):387-401.
[28] Jotte RM,Cappuzzo F,Vynnychenko I,et al. IMpower131:Primary PFS and safety analysis of a randomized phase III study of atezolizumab + carboplatin + paclitaxel or nab-paclitaxel vs carboplatin + nab-paclitaxel as 1L therapy in advanced squamous NSCLC[J]. J Clin Oncol,2018,36(18_suppl):LBA9000.
[29] Peters S,Gettinger S,Johnson ML,et al. Phase Ⅱ trial of atezolizumab as first-line or subsequent therapy for patients with programmed death-ligand 1-selected advanced non-small-cell lung cancer(BIRCH)[J]. J Clin Oncol,2017,35(24):2781-2789.
[30] Fehrenbacher L,Spira A,Ballinger M,et al. Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer(POPLAR):a multicentre,open-label,phase 2 randomised controlled trial[J]. Lancet,2016,387(10030):1837-1846.
[31] Rittmeyer A,Barlesi F,Waterkamp D,et al. Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer(OAK):a phase 3,open-label,multicentre randomised controlled trial[J]. Lancet,2017,389(10066):255-265.
[32] Antonia SJ,Villegas A,Daniel D,et al. Durvalumab after Chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer[J]. N Engl J Med,2017,377(20):1919-1929.
[33] Brahmer JR,Lacchetti C,Schneider BJ,et al. Management of immune-related adverse events in patients treated with immune checkpoint inhibitor therapy:american society of clinical oncology clinical practice guideline[J]. J Clin Oncol,2018,36(17):1714-1768.
[34] Puzanov I,Diab A,Abdallah K,et al. Managing toxicities associated with immune checkpoint inhibitors:consensus recommendations from the Society for Immunotherapy of Cancer(SITC) Toxicity Management Working Group[J]. J Immunother Cancer,2017,5(1):95.
[35] Thompson JA,Schneider BJ,Brahmer J,et al. Management of immunotherapy-related toxicities,version 1.2019[J]. J Natl Compr Canc Netw,2019,17(3):255-289.
[36] Miller TP,Fisher BT,Getz KD,et al. Unintended consequences of evolution of the common terminology criteria for adverse events[J]. Pediatr Blood Cancer,2019,66(7):e27747.