微小RNA(microRNA,miRNA)是一类长18~25个核苷酸的非编码小RNA,通过靶向作用于靶基因的3′非编码区,在转录后水平抑制靶基因的表达,包括阻止靶基因的翻译及加速靶基因的降解。miRNA参与了肿瘤发展的各个过程,包括细胞生长、细胞凋亡、代谢和发育。miR-140-5p参与多种肿瘤的发生发展,在胶质母细胞瘤、膀胱癌、喉鳞状细胞癌中表达降低,在多种癌症中发挥着抗肿瘤作用,但其在前列腺癌中的表达及作用尚无相关研究。本研究检测miR-140-5p在前列腺细胞株中的表达,探讨其生物学功能,旨在为临床治疗前列腺癌提供新的思路。
1 材料与方法
1.1 细胞培养 PC3细胞、DU145细胞、RWPE-1细胞培养在含有双抗(青霉素和链霉素)及10%胎牛血清的RPMI 1640培养液中,293A细胞培养在含有双抗(青霉素和链霉素)及10%胎牛血清的DMEM培养液中,放入37 ℃、5% CO2培养箱内。每1~2 d更换细胞培养液,待细胞达80%融合,用0.25%胰蛋白酶消化传代。根据细胞密度分装到新的细胞培养瓶中,放回培养箱继续培养。
1.2 试剂和仪器 RPMI 1640培养基(Gibco公司);Lipofectamine 2000细胞转染试剂(Invitrogen公司);胎牛血清(CLARK Bioscience公司);CCK-8细胞增殖/毒性检测试剂盒(上海贝博生物);AnnexinV-FITC/PI凋亡检测试剂盒(BD公司);miRNA提取试剂盒(Omega 公司);miRNA反转录及扩增试剂盒(广州富能基因);核酸定量仪(德国Eppendorf公司);PCR扩增仪(德国Eppendorf公司);实时荧光定量PCR仪ABI 7500 Fast(美国ABI公司)。
1.3 引物设计及模拟物/抑制物的合成 miR-140-5p及U6上游引物及购自广州富能基因;miR-140-5p模拟物及抑制物购自上海吉玛公司。
1.4 方法
1.4.1 细胞转染 使用Lipofectamine 2000对细胞转染,PC3细胞接种到6孔板或96孔板中培养24 h,待细胞生长密度为60%~80%时进行转染。转染时首先应用无菌DEPC水将miR-140-p模拟物或抑制物进行溶解,并定容为50 pmol/mL。用无血清RPMI 1640分别稀释模拟物/抑制物以及Lipofectamine 2000转染试剂常温放置5 min。随后将含有模拟物/抑制物以及Lipofectamine 2000的RPMI 1640充分混合,常温静置15 min。其间将PC3细胞用无血清RPMI 1640培养基洗2次去除血清对转染的干扰,后用无血清RPMI 1640培养基进行换液,并将上述混合模拟物/抑制物以及Lipofectamine 2000的RPMI 1640培养基加入孔板中进行培养。转染6 h后,弃去孔板中的培养基,更换为新的无血清RPMI 1640培养基,继续放入37 ℃、5%CO2培养箱中培养24 h,收集细胞,进行下一步聚合酶链反应。
1.4.2 CCK-8法测定细胞增殖抑制率 将PC3细胞浓度调整至1×105 cells/mL,取100 μL接种于96孔培养板,并按“1.4.1”项下方法转染PC3细胞,在转染后0,12,24,48 h进行CCK8检测,每组设5个复孔。检测前每孔加入CCK-8试剂10 μL,继续培养2 h。酶标仪测定各个孔在450 nm处的光密度(optical density,OD)值,并计算细胞的增殖抑制率。
1.4.3 流式细胞术AnnexinV-FITC/PI检测细胞凋亡 PC3细胞按“1.4.1”项下转染方法转染miR-140-5p模拟物及抑制物48 h,收集细胞;PBS洗涤细胞;加入100 μL 1×Binding Buffer 悬浮细胞;加入5 μL Annexin V-FITC及5 μL PI染色混匀后,避光,室温孵育15 min;上机前,补加200 μL 1×Binding Buffer。每组设3个复孔。随后流式细胞仪检测细胞凋亡情况,并计算细胞凋亡率。
1.4.4 miRNA提取及实时定量PCR PC3细胞、DU145细胞及转染后的PC3细胞提取RNA。用于反转录的总RNA提取方法按照OMEGA miRNA Kit试剂盒提取说明进行。Nanodrop核酸定量仪检测RNA纯度和浓度,符合浓度及纯度的RNA进行反转录。miRNA反转录应用GeneCopoeia公司All-in-OneTM miRNA First-Strand cDNA Synthesis Kit试剂盒,取1~2 μg总RNA按说明书建立25 μg反转录体系合成cDNA。按照GeneCopoeia公司miRNA qPCR Kit试剂盒说明进行实时定量聚合酶链反应。以管家基因U6为内参,采用△Ct(Ct目的-Ct内参)法进行相对定量分析,以2-△△Ct作为目的RNA的相对表达量。
1.4.5 TCGA数据库分析 利用可视化TCGA数据库分析网站oncolnc(www.oncolnc.org)分析miR-140-5p在TCGA数据库中的表达与前列腺癌患者预后之间的关系,cutoff值选取为-25%~+25%。
1.5 统计学方法 应用SPSS 13.0统计软件处理数据。计量资料比较分别采用两独立样本的t检验、F检验和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 miR-140-5p在不同细胞株中的表达情况比较 miR-140-5p在DU145及PC3细胞中的表达明显低于RWPE-1细胞,miR-140-5p在PC3细胞中的表达明显低于DU145细胞,差异有统计学意义(P<0.05)。故选取PC3细胞作为后续实验细胞株。见表1。
表1 不同细胞株中miR-140-5p相对表达量
Table 1 Relative miR-140-5p expression
level in different cell lines ![]()
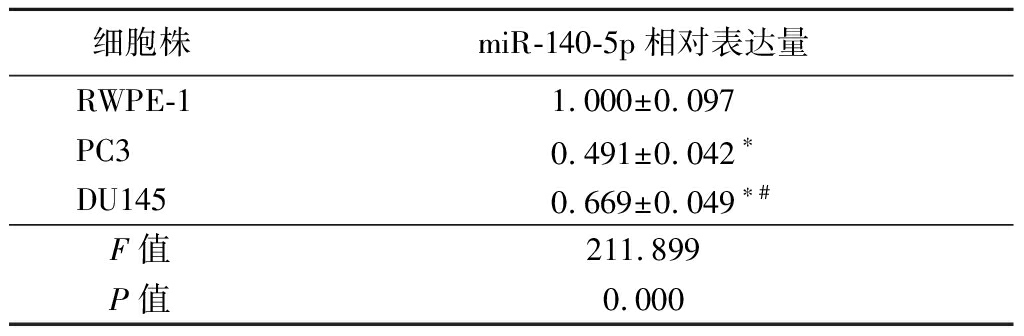
细胞株miR-140-5p相对表达量RWPE-11.000±0.097PC30.491±0.042∗DU1450.669±0.049∗#F值211.899P值0.000
*P值<0.05与RWPE-1比较 #P值<0.05与PC3比较(SNK-q检验)
2.2 转染miR-140-5p模拟物能增加PC3细胞中miR-140-5p表达 转染miR-140-5p模拟物的PC3细胞中miR-140-5p相对表达量明显高于阴性对照组,差异有统计学意义(P<0.05)。证实miR-140-5p模拟物转染效率高。见表2。
2.3 过表达miR-140-5p抑制PC3细胞增殖促进凋亡 miR-140-5p的模拟物转染PC3细胞48 h,过表达组细胞增殖率低于阴性对照组,凋亡率高于阴性对照组,差异有统计学意义(P<0.05)。说明过表达miR-140-5p可抑制PC3细胞增殖,促进其凋亡。见表3。
表2 转染miR-140-5p模拟物对PC3细胞中
miR-140-5p相对表达量影响
Table 2 Relative miR-140-5p expression level in PC3 cells
after transfection with miR-140-5p mimic ![]()
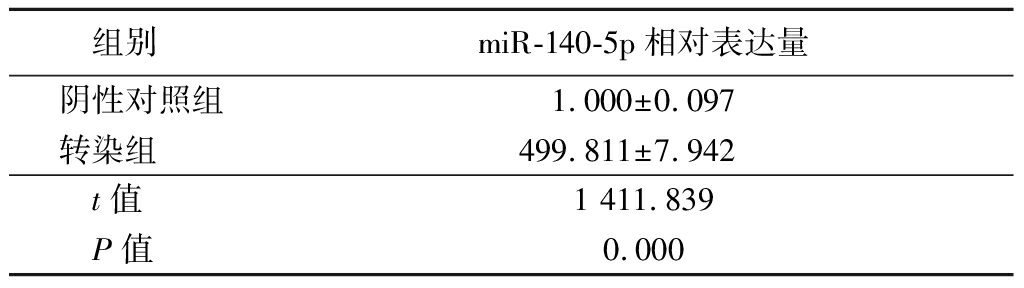
组别miR-140-5p相对表达量阴性对照组1.000±0.097转染组499.811±7.942t值1 411.839P值0.000
表3 转染miR-140-5p模拟物对PC3细胞增殖及凋亡影响
Table 3 Effect on cell viability and apoptosis after
transfection with miR-140-5p mimic ![]()
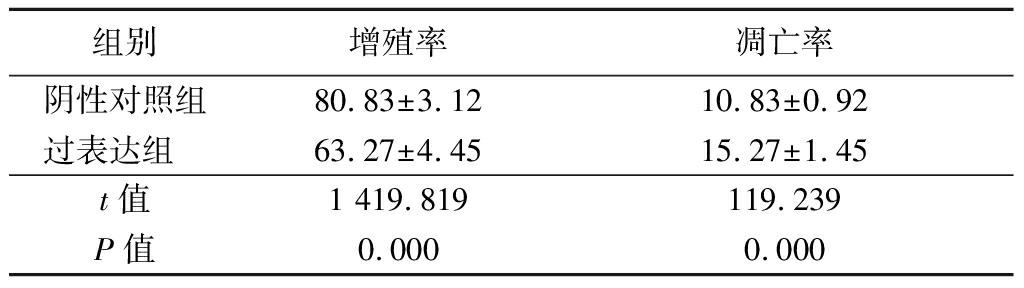
组别增殖率凋亡率阴性对照组80.83±3.1210.83±0.92过表达组 63.27±4.4515.27±1.45t值1 419.819119.239P值0.0000.000
2.4 转染miR-140-5p抑制物能敲低PC3细胞中miR-140-5p表达 转染miR-140-5p抑制物的PC3细胞中miR-140-5p相对表达量明显低于阴性对照组,差异有统计学意义(P<0.05)。证实miR-140-5p抑制物敲低效率高。见表4。
表4 转染miR-140-5p抑制物对PC3细胞中
miR-140-5p相对表达量影响
Table 4 Relative miR-140-5p expression level
after tranfection with miR-140-5p inhibitor ![]()
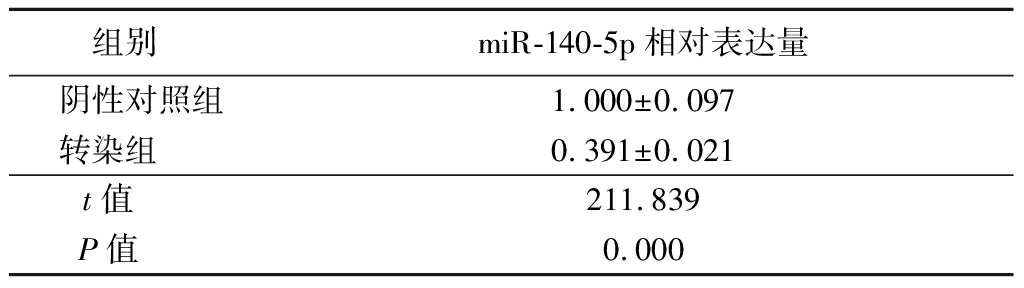
组别miR-140-5p相对表达量阴性对照组1.000±0.097转染组0.391±0.021t值 211.839P值 0.000
2.5 敲低miR-140-5p表达促进PC3细胞增殖抑制凋亡 敲低miR-140-5p表达组细胞增殖率明显高于阴性对照组,凋亡率明显低于阴性对照组,差异有统计学意义(P<0.05)。说明敲低miR-140-5p表达可促进PC3细胞增殖,抑制其凋亡。见表5。
表5 转染miR-140-5p抑制物对PC3细胞增殖及凋亡影响
Table 5 Effect on cell viability and apoptosis after transfection with miR-140-5p inhibitor![]()
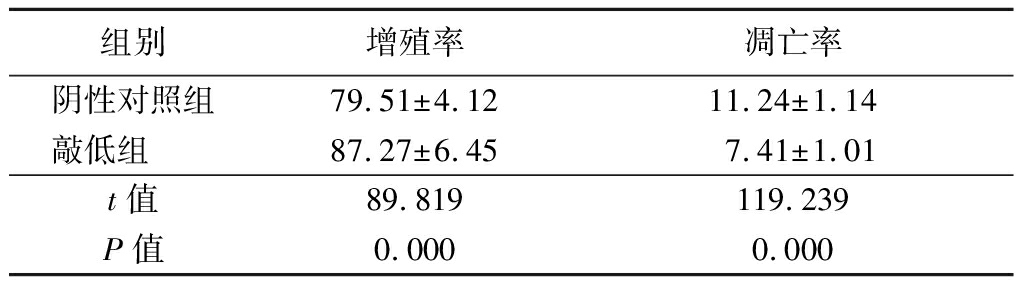
组别增殖率凋亡率阴性对照组79.51±4.1211.24±1.14敲低组 87.27±6.457.41±1.01t值89.819119.239P值0.0000.000
2.6 低表达miR-140-5p和前列腺癌患者预后不良的相关性 通过TCGA数据库分析86例前列腺癌患者miR-140-5p的表达情况,结果显示低表达miR-140-5p组患者(n=43)总生存率低于高表达miR-140-5p组患者(n=43),差异有统计学意义(P=0.015)。
3 讨 论
前列腺癌是男性最常见的恶性肿瘤之一。据统计,2017年全美国前列腺癌新增发病人数位居癌症发病率首位,死亡人数排名第二[1-2]。我国前列腺癌的发病率和检出率也呈逐年升高趋势,已位居男性泌尿生殖系统恶性肿瘤的第3位[3]。随着前列腺特异性抗原筛查和手术进步以及放化疗技术、去雄激素治疗的进展,前列腺癌患者的5年存活率明显提高。但超过50%患者出现去势治疗抵抗、化疗耐药,进而出现疾病进展复发、转移及浸润,威胁患者生命[4]。因此,进一步研究前列腺癌发病机制,有助于寻找更多的治疗方法。
miRNA,作为重要的非编码RNA,通过靶向结合在靶基因3′非编码区,诱导靶基因mRNA降解剂抑制靶基因翻译,发挥着重要的转录后调控作用[5]。miRNA参与了多种疾病(包括心血管疾病、糖尿病、神经退行性疾病及肿瘤)的发生发展[6]。已有研究证实,miRNA参与了前列腺癌发生发展的多个过程,包括增殖、迁移、侵袭、凋亡等[7],如在前列腺癌组织中miR-100表达量明显降低,在前列腺癌细胞中过表达miR-100后,可通过靶向抑制AGO2基因表达,抑制前列腺癌细胞上皮间质转化[8]。Gao等[9]证实,miR-323在前列腺癌中高表达,过表达miR-323能促进前列腺癌细胞等增殖及进展。Hao等[10]发现,异常表达miR-211/SPARC 通路可能在前列腺癌进展中发挥重要作用。此外,miRNA可能作为生物学分子标记物与前列腺癌的耐药及预后密切相关。罗振国等[11]比较了前列腺癌患者与前列腺增生患者血清中的miR-107水平,发现高表达miR-107可作为前列腺癌的特异指标。Tinay等[12]分析了miR-345-5p在前列腺癌患者血清中的表达,发现高表达miR-345-5p与前列腺癌患者预后不良相关,其原因可能与miR-345-5p靶向抑制CDKN1A表达、促进前列腺癌细胞增殖与侵袭有关。本研究结果显示,在前列腺癌细胞中,miR-140-5p表达明显降低,通过分析TCGA数据可也可得知,前列腺癌患者低表达miR-140-5p预后不良,故miR-140-5p可能作为潜在的分子生物学预后指标在前列腺癌评价中应用。
miR-140-5p在多种恶性肿瘤中表达下调,发挥抑癌基因作用,并可能与患者预后相关。如miR-140-5p在子宫颈癌中表达降低[13];miR-140-5p在食管癌中低表达,并参与了食管癌的侵袭、迁移及上皮间质转化[14];miR-140-5p在胃癌中表达降低,并且与胃癌患者生存可能存在关系[15]。本研究结果显示,miR-140-5p在前列腺癌中低表达,并与前列腺癌患者预后不良有关。
一个miRNA可能调控多个靶基因,同时一个基因受到多种miRNA调控。miR-140-5p在不同癌症细胞中的作用也不尽相同。miR-140-5p通过靶向作用于YES1基因,参与了胃癌的迁移及侵袭等恶性过程[16];另外,在卵巢癌中,过表达miR-140-5p可明显靶向作用于PGDFA 3′非编码区,抑制其蛋白等表达,进而抑制卵巢癌细胞等增殖[17];miR-140-5p还能通过靶向抑制VEGF-A等表达,调控非小细胞肺癌等癌症进展[18-19]。本研究结果显示,在PC3细胞中过表达miR-140-5p,能够明显促进PC3细胞凋亡,抑制其增殖;而敲低miR-140-5p,能促进PC3细胞增殖,抑制其凋亡。但miR-140-5p下游基因及进一步调控机制,还需要更多实验证实。
综上所述,miR-140-5p在前列腺癌细胞中表达明显降低,过表达miR-140-5p能促进前列腺癌细胞凋亡,低表达miR-140-5p与前列腺癌患者预后不良相关,这为临床治疗前列腺癌提供了新的思路。
[1] Siegel RL,Miller KD,Dvm AJ. Cancer statistics,2018[J]. CA Cancer J Clin,2018,68(1):7-30.
[2] 叶定伟,朱耀.中国前列腺癌的流行病学概述和启示[J].中华外科杂志,2015,53(4):249-252.
[3] 彭鹏,龚杨明,鲍萍萍,等.中国2008年前列腺癌发病、死亡和患病情况的估计及预测[J].中华流行病学杂志,2012,33(10):1056-1059.
[4] 郑路,安恒庆,张立东.去势抵抗型前列腺癌的研究进展[J].癌症进展,2015,13(4):364-368.
[5] Armand-Labit V,Pradines A. Circulating cell-free microRNAs as clinical cancer biomarkers[J]. Biomol Concepts,2017,8(2):61-81.
[6] Rupaimoole R,Slack FJ. MicroRNA therapeutics:towards a new era for the management of cancer and other diseases[J].Nat Rev Drug Discov,2017,16(3):203-222.
[7] van GP,Mets E,Claeys S,et al. A high-throughput 3′ UTR reporter screening identifies microRNA interactomes of cancer genes[J]. PLoS One,2018,13(3):e0194017.
[8] Nabavi N,Saidy NRN,Venalainen E,et al. miR-100-5p inhibition induces apoptosis in dormant prostate cancer cells and prevents the emergence of castration-resistant prostate cancer[J]. Sci Rep,2017,7(1):4079.
[9] Gao Q,Zheng J. microRNA-323 upregulation promotes prostate cancer growth and docetaxel resistance by repressing p73[J]. Biomed Pharmacother,2018,97:528-534.
[10] Hao P,Kang B,Yao G,et al. MicroRNA-211 suppresses prostate cancer proliferation by targeting SPARC[J]. Oncol Lett,2018,15(4):4323-4329.
[11] 罗振国,邓勇泉,陈向锋,等.血清miRNA-107检测在前列腺癌诊断与预后判断中的价值[J].中国男科学杂志,2018,32(2):52-54.
[12] Tinay I,Tan M,Gui B,et al. Functional roles and potential clinical application of miRNA-345-5p in prostate cancer[J]. Prostate,2018,78(12):927-937.
[13] Su Y,Xiong J,Hu J,et al. MicroRNA-140-5p targets insulin like growth factor 2 mRNA binding protein 1(IGF2BP1) to suppress cervical cancer growth and metastasis[J]. Oncotarget,2016,7(42):68397-68411.
[14] Zhang K,Chen J,Song H,et al. SNHG16/miR-140-5p axis promotes esophagus cancer cell proliferation,migration and EMT formation through regulating ZEB1[J]. Oncotarget,2017,9(1):1028-1040.
[15] Cha Y,He Y,Ouyang K,et al. MicroRNA-140-5p suppresses cell proliferation and invasion in gastric cancer by targeting WNT1 in the WNT/β-catenin signaling pathway[J]. Oncol Lett,2018,16(5):6369-6376.
[16] Fang Z,Yin S,Sun R,et al. miR-140-5p suppresses the proliferation,migration and invasion of gastric cancer by regulating YES1[J]. Mol Cancer,2017,16(1):139.
[17] Lan H,Chen WS,He GL,et al. miR-140-5p inhibits ovarian cancer growth partially by repression of PDGFRA[J]. Biomed Pharmacother,2015,75:117-122.
[18] Yang P,Xiong J,Zuo L,et al. miR-140-5p regulates cell migration and invasion of non-small cell lung cancer cells through targeting VEGFA[J]. Mol Med Rep,2018,18(3):2866-2872.
[19] Flamini V,Jiang WG,Cui Y. Therapeutic role of miR-140-5p for the treatment of non-small cell lung cancer[J]. Anticancer Res,2017,37(8):4319-4327.