心肌梗死(myocardial infarction,MI)是一类严重危害人类身体健康的疾病,其主要发病机制是心肌缺血。血管再生可以改善心肌梗死患者的心肌缺血,故如何促进缺血心肌血管再生已经成为目前研究的热点。血管再生是一个复杂的过程,血管内皮生长因子(vascular endothelial growth factor,VEGF) 和碱性成纤维细胞生长因子(basic fibroblast growth factor,β-FGF)等促血管生长因子参与其中,发挥着重要的作用。丁苯酞(dl-3-n-butylphthalide,NBP)主要活性成分为正丁基苯酞,对急性脑梗死具有显著治疗作用[1-2]。心肌梗死和脑梗死的发病机制类似,本课题组前期研究发现,NBP通过促进VEGF改善脑心缺血[3],但NBP对心肌梗死血管再生的作用及机制仍需深入研究。最新研究表明Notch通路与心肌梗死等疾病关系密切[4],激活Notch l通路能减轻创伤后心肌缺血再灌注损伤[5-6]。因此,本研究旨在探讨NBP促进心肌梗死大鼠血管再生的作用,报告如下。
1 材料与方法
1.1 药品、实验动物与仪器 NBP由石药集团恩必普药业公司提供,批准文号:国药准字H20100041。体重为200~280 g的 SD大鼠由河北省实验动物中心提供(合格证书:SCXK-冀-2008-1-003),对动物的处置符合动物伦理学标准。
1.2 大鼠心肌梗死模型的制备及分组 将大鼠以10%水合氯醛腹腔注射麻醉,按线栓法制备大鼠心肌梗死模型:接多导电生理记录仪观察大鼠心电图,气管插管,接小动物呼吸机辅助呼吸。于胸骨左缘第3、4肋间开胸,暴露心脏,用5-0丝线结扎于冠状动脉前降支(left anterior descending,LAD),造成心肌梗死。结扎后心电图Ⅰ和aVL导联ST 段抬高且心肌组织变为苍白色为造模成功。假手术过程与上述基本相同,但线栓并未置入 LAD。将大鼠分为假手术(Sham)组、心肌梗死(MI)组、NBP 低剂量(NBP-L,20 mg/kg组)和NBP高剂量(NBP-H,40 mg/kg)组,每组6只大鼠。模型成功后分别经尾静脉注射给予药物治疗,每天给药1次,连续给药2周。Sham组和MI组给予相同剂量的生理盐水治疗。
1.3 心肌梗死面积的检测 实验结束时处死大鼠,迅速取出大鼠心脏组织,沿房室环方向将左心室由心尖至心底切成2 mm厚的组织块,置于20 g/L的氯化三苯基四氮唑溶液中,37 ℃孵育10 min,加入4%多聚甲醛固定24 h,用数码相机拍照,用Image J软件进行图像分析计算梗死面积。心肌梗死面积=每片切片坏死心肌之和/整个左心室面积×100%。
1.4 心脏功能的检测 10%水合氯醛麻醉大鼠后,将其置于自制木板上,超声诊断仪检测大鼠心脏超声功能,并读取左心室收缩末期压(left ventricular end-systolic pressure,LVESP)、左心室舒张末期压(left ventricular end diastolic pressure,LVEDP)、心室收缩时室内压最大上升速率(+dP/dt max)及左心室舒张时室内压最大下降速率(-dP/dt max)。
1.5 心肌梗死边缘区新生血管的检测 取正常心肌与梗死心肌交界区的心肌即缺血心肌,制作石蜡组织块,切片(5 μm厚),行特异性免疫组织化学染色,SP法染色,二氨基联苯胺显色,一抗为兔抗鼠Ⅷ因子相关抗原抗体(购自北京中山金桥生物技术有限公司),显微镜下计数缺血区微血管密度,每个标本随机观察5处,取其平均值作为毛细血管密度。
1.6 VEGF和β-FGF及Notch 1的基因表达检测 Trizol法提取大鼠缺血心肌组织总RNA,逆转录合成cDNA,取逆转录产物2 μg进行PCR扩增反应。采用SYBR Green染料法于实时荧光定量PCR仪进行RT-PCR 反应,建立反应体系的终体积为25 μL。反应条件为95 ℃预变性5 min、95 ℃变性5 s、60 ℃退火30 s、72 ℃延伸40 s,进行35个循环,最后72 ℃延伸5 min。由 PCR 反应曲线得到每个样品的Ct值,以GAPDH作为内参,用2-△△ct法进行计算目的基因的表达量。引物合成由上海生工生物工程技术服务有限公司完成,引物序列为:VEGF,F:5′-GCACTGGACCCTGGCTTTAC-3′,R:5′-CCCGCACACCGCATTAGG-3′;FGF,F:5′-TTCACAGCCTGTGCTCTAGGG-3′,R:5′-GAT-CGGGTCAGGTTTTGGAAA-3′;Notch 1,F:5′-GAGGCTTGAGATGCTCCCAG-3′,R:5′-ACGG-CAGGCACAGCGATAG-3′;GAPDH,F:5′-ACC-ACAGTCCATGCCATCAC-3′,R:5′-TCCACCAC-CCTGTTGCTGTA-3′。
1.7 统计学方法 应用SPSS 17.0统计软件分析数据。计量资料比较分别采用F检验和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 NBP对各组大鼠心肌梗死面积的作用 Sham组大鼠均未见心肌梗死灶,MI组、NBP-L组和NBP-H组大鼠心肌梗死面积百分率大于Sham组,NBP-L组和NBP-H组大鼠心肌梗死面积百分率小于MI组,NBP-H组大鼠心肌梗死面积百分率小于NBP-L组(P<0.05),见表1。
表1 各组大鼠梗死面积百分率比较
Table 1 Comparison of infarct area in rats of different groups![]()
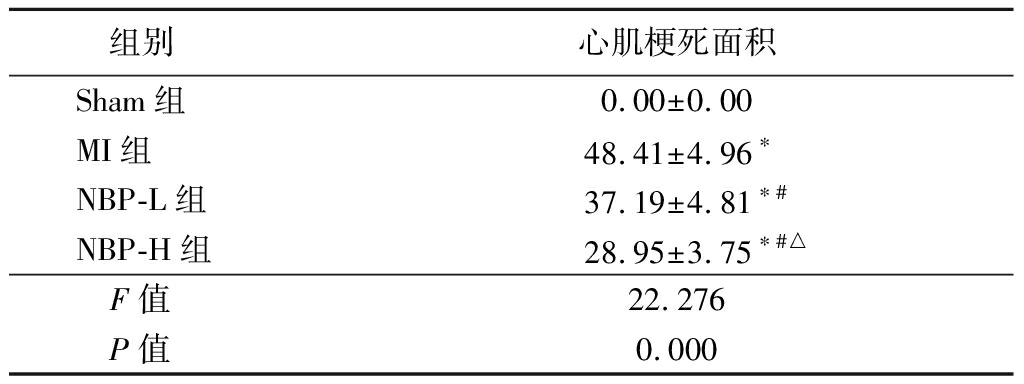
组别心肌梗死面积Sham组0.00±0.00MI组48.41±4.96∗NBP-L组37.19±4.81∗#NBP-H组28.95±3.75∗#△F值22.276P值0.000
*P值<0.05与Sham组比较 #P值<0.05 与MI组比较 △P值<0.05 与NBP-L组比较(SNK-q检验)
2.2 NBP对各组大鼠心脏功能的影响 MI组、NBP-L组和NBP-H组大鼠LVESP、+dp/dt max、-dp/dt max低于Sham组,LVED高于Sham组,NBP-L组和NBP-H组大鼠LVESP、+dp/dt max、-dp/dt max高于MI组,LVED低于MI组,NBP-H组大鼠LVESP、+dp/dt max、-dp/dt max高于NBP-L组,LVED低于NBP-L组(P<0.05),见表2。
2.3 NBP对各组大鼠梗死边缘区新生毛细血管的作用 NBP-L组和NBP-H组心肌梗死边缘区毛细血管密度高于MI组,NBP-H组心肌梗死边缘区毛细血管密度高于NBP-L组(P<0.05),见表3。
2.4 NBP对各组大鼠血管再生相关因子(VEGF和β-FGF)的作用 MI组大鼠心肌VEGF、FGF mRNA水平低于Sham组,NBP-L组和NBP-H组VEGF和β-FGF mRNA水平高于Sham组和MI组,NBP-H组VEGF和-FGF mRNA水平高于NBP-L组,差异有统计学意义(P<0.05),见表4。
2.5 NBP对各组大鼠Notch信号通路中Notch 1基因的影响 MI组大鼠心肌组织中Notch 1基因表达明显低于Sham组,NBP-L组和NBP-H组大鼠心肌中Notch 1基因表达高于Sham组和MI组,NBP-H组大鼠心肌中Notch 1基因表达高于NBP-L组(P<0.05),见表5。
表2 各组大鼠心脏功能指标比较
Table 2 Comparison of cardiac function indexes in rats of different groups![]()
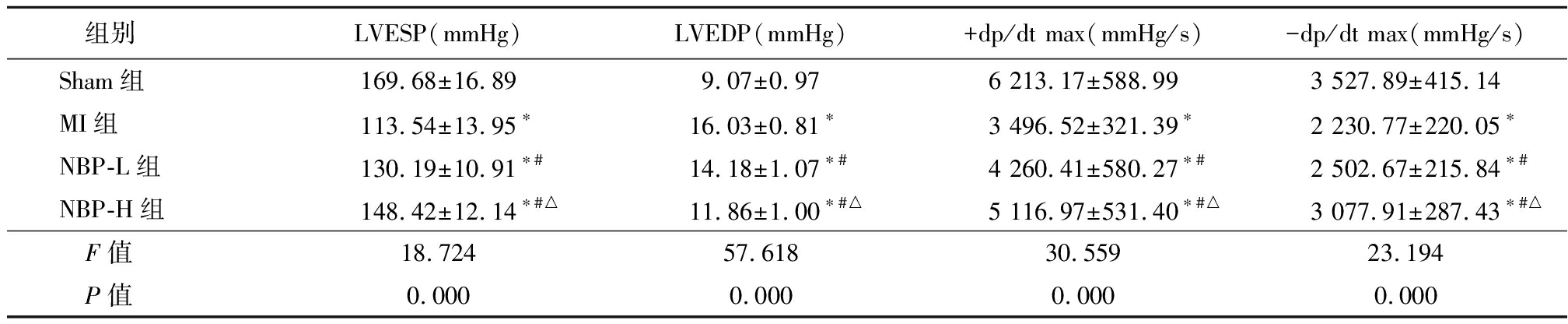
组别LVESP(mmHg)LVEDP(mmHg)+dp/dt max(mmHg/s)-dp/dt max(mmHg/s)Sham组169.68±16.899.07±0.976 213.17±588.993 527.89±415.14MI组113.54±13.95∗16.03±0.81∗3 496.52±321.39∗2 230.77±220.05∗NBP-L组130.19±10.91∗#14.18±1.07∗#4 260.41±580.27∗#2 502.67±215.84∗#NBP-H组148.42±12.14∗#△11.86±1.00∗#△5 116.97±531.40∗#△3 077.91±287.43∗#△F值18.72457.61830.55923.194P值0.0000.0000.0000.000
*P值<0.05与Sham组比较 #P值<0.05与MI组比较 △P值<0.05 与NBP-L组比较(SNK-q检验);1 mmHg=0.133 kPa
表3 各组心肌梗死大鼠梗死边缘区
新生毛细血管密度比较
Table 3 Comparison of the density of new capillaries at the edge of myocardial infarction in rats of different groups![]()
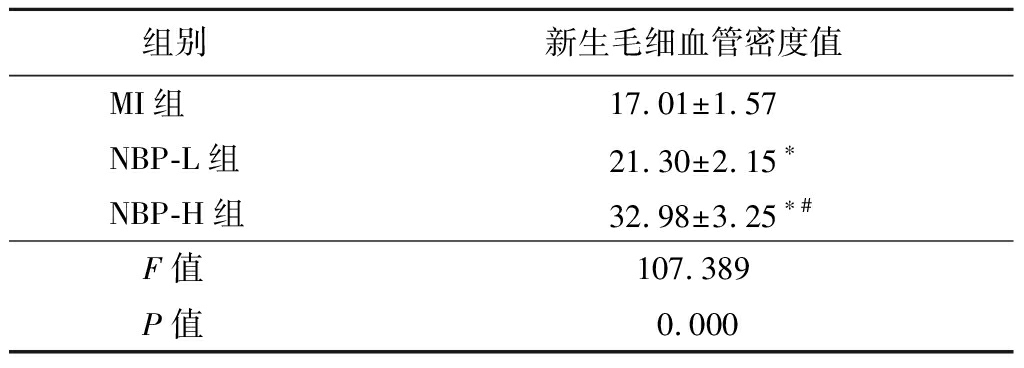
组别新生毛细血管密度值MI组17.01±1.57NBP-L组21.30±2.15∗NBP-H组32.98±3.25∗#F值107.389 P值0.000
*P值<0.05与MI组比较 #P值<0.05与NBP-L组比较(SNK-q检验)
表4 各组大鼠VEGF mRNA和β-FGF mRNA比较
Table 4 Comparison of the mRNA levels of VEGF and β-FGF in myocardial infarction rats of different groups![]()

组别VEGF mRNAβ-FGF mRNASham组1.01±0.191.01±0.17MI组0.64±0.08∗0.71±0.11∗NBP-L组1.40±0.22∗#1.27±0.20∗#NBP-H组2.12±0.39∗#△2.01±0.29∗#△F值40.72543.956P值0.0000.000
*P值<0.05与Sham组比较 #P值<0.05与MI组比较 △P值<0.05 与NBP-L组比较(SNK-q检验)
表5 各组大鼠Notch信号通路中Notch 1 mRNA比较
Table 5 Comparison of Notch 1 mRNA in myocardial infarction rats of different groups![]()
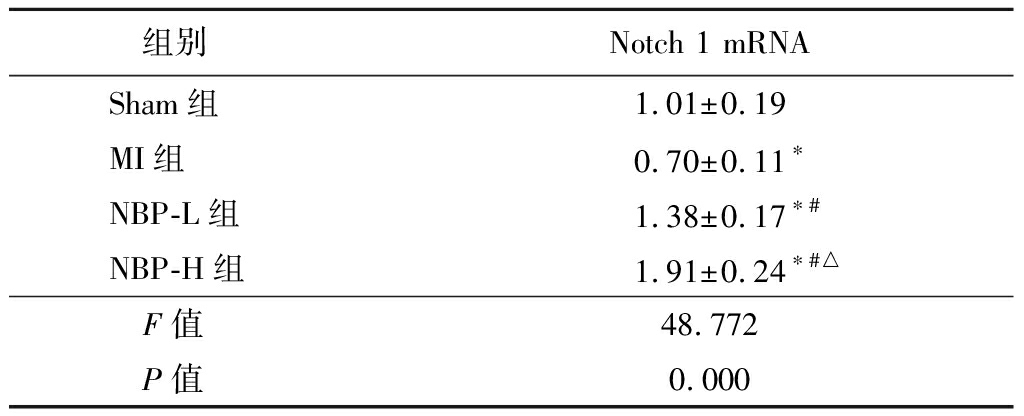
组别Notch 1 mRNASham组1.01±0.19MI组0.70±0.11∗NBP-L组1.38±0.17∗#NBP-H组1.91±0.24∗#△F值48.772P值0.000
*P值<0.05与Sham组比较 #P值<0.05与MI组比较 △P值<0.05与NBP-L组比较(SNK-q检验)
3 讨 论
缺血性心脏病已经成为严重威胁人类健康的主要疾病之一,如何改善心肌缺血区血流量成为治疗心肌梗死的关键和研究的热点。近年来研究发现,血管再生可以增加缺血心肌的血流灌注,挽救顿抑心肌,改善心脏功能[7-8]。因此,探索新的以血管再生为治疗靶点的心肌梗死药物具有极其重要的价值。NBP是一种新型的抗脑缺血的药物,国内指南中已批准用于治疗脑梗死[9]。研究发现,NBP可改善大鼠脑缺血再灌注后微血管形态和密度,促进血管再生对脑血管缺血再灌注损伤具有一定的保护作用[10-12]。另外, NBP能改善大鼠心肌梗死模型心脏血流动力学功能和减少心脏梗死面积,对大鼠心肌具有保护作用[13]。然而,关于NBP是否通过调控血管再生对心肌梗死起保护作用的研究较少。
本研究结果显示,MI组、NBP-L组和NBP-H组大鼠心肌梗死面积百分率大于Sham组,NBP-L组和NBP-H组大鼠心肌梗死面积百分率小于MI组,NBP-H组大鼠心肌梗死面积百分率小于NBP-L组(P<0.05)。NBP能够降低大鼠心肌梗死面积,改善大鼠心肌梗死后心脏功能,表明NBP对心肌梗死大鼠具有保护作用。微血管密度是反映血管再生的可靠的指标。本研究采用免疫组织化学方法检测梗死灶边缘区的微血管密度,结果表明NBP-L组和NBP-H组大鼠心肌组织中微血管密度要高于MI组。VEGF和β-FGF是目前动物和临床实验研究得较为深入的促进血管再生的活性因子[14-15]。本研究采用实时荧光定量PCR检测了心肌组织中VEGF mRNA和β-FGF mRNA的表达,结果发现MI组大鼠心肌VEGF、FGF mRNA水平低于Sham组,NBP-L组和NBP-H组VEGF和β-FGF mRNA水平高于Sham组和MI组,NBP-H组VEGF和β-FGF mRNA水平高于NBP-L组(P<0.05)。表明NBP能够促进血管再生相关因子VEGF和β-FGF的表达。所以,NBP可以促进心肌梗死大鼠VEGF和β-FGF因子在缺血心肌中的表达,进而促进缺血心肌血管再生,增加缺血心肌的血液供应,对心肌梗死的大鼠心肌组织产生保护功能。
Notch信号通路主要对细胞的增殖、分化和凋亡进行调节,其中的一类受体Notch 1在心肌的发育、存活和分化中发挥着关键作用[16]。Notch 1通路通过促进心肌再生、诱导血管新生等来保护心肌[17]。敲除Notch 1可引起冠状动脉畸形和心肌异常[18]。然而,尚未见到有关Notch 1通路是否在NBP介导的心肌梗死大鼠血管再生中发挥作用的报道。因此,本研究通过实时荧光定量PCR法检测了缺血心肌组织的Notch 1基因的表达,结果发现,MI组大鼠心肌组织中Notch 1基因表达明显低于Sham组,NBP-L组和NBP-H组大鼠心肌中Notch 1基因表达高于Sham组和MI组,NBP-H组大鼠心肌中Notch 1基因表达高于NBP-L组(P<0.05)。表明NBP能够激发Notch 1通路,促进血管再生,对心肌梗死后大鼠的心肌产生保护作用。
综上所述,NBP可通过激活Notch 1通路促进心肌梗死后大鼠血管再生能力,对心肌梗死大鼠产生保护作用,为心肌梗死的治疗提供了新的理论基础,有利于研发心肌梗死的新干预靶点和治疗药物。
[1] Wang S,Ma F,Huang L,et al. Dl-3-n-butylphthalide(NBP):a promising therapeutic agent for ischemic stroke[J]. CNS Neurol Disord Drug Targets,2018,17(5):338-347.
[2] Li J,Liu Y,Zhang X,et al. Dl-3-n-butylphthalide alleviates the blood-brain barrier permeability of focal cerebral ischemia reperfusion in mice[J]. Neuroscience,2019,413:99-107.
[3] 田小超,何伟亮,刘斯文,等.丁苯酞对实验性大鼠脑心缺血的保护作用[J].脑与神经疾病杂志,2016,24(6):358-361.
[4] Zhou XL,Fang YH,Wan L,et al. Notch signaling inhibits cardiac fibroblast to myofibroblast transformation by antagonizing TGF-β1/Smad3 signaling[J]. J Cell Physiol,2019,234(6):8834-8845.
[5] 汪雄,白婧,薛强,等.肿瘤坏死因子α抑制剂通过激活Notch 1信号通路减轻创伤小鼠心肌再灌注损伤[J].中华心血管病杂志,2016,44(2):156-160.
[6] Fang HC,Wu BQ,Hao YL,et al. KRT1 gene silencing ameliorates myocardial ischemia-reperfusion injury via the activation of the Notch signaling pathway in mouse models[J]. J Cell Physiol,2019,234(4):3634-3646.
[7] Zhou NQ,Liu N,Li P,et al. Tert-butylhydroquinone promotes angiogenesis and improves heart functions in rats after myocardial infarction[J]. Clin Exp Hypertens,2017,39(5):402-408.
[8] Zhu JZ,Bao XY,Zheng Q,et al. Buyang huanwu decoction exerts cardioprotective effects through targeting angiogenesis via caveolin-1/VEGF signaling pathway in mice with acute myocardial infarction[J]. Oxid Med Cell Longev,2019,2019:4275984.
[9] 中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组.中国急性缺血性脑卒中诊治指南2018[J].中华神经科杂志,2018,51(9):666-682.
[10] Zhao H,Yun W,Zhang Q,et al. Mobilization of circulating endothelial progenitor cells by dl-3-n-butylphthalide in acute ischemic stroke patients[J]. J Stroke Cerebrovasc Dis,2016,25(4):752-760.
[11] Zhou PT,Wang LP,Qu MJ,et al. Dl-3-N-butylphthalide promotes angiogenesis and upregulates sonic hedgehog expression after cerebral ischemia in rats[J]. CNS Neurosci Ther,2019,25(6):748-758.
[12] Xiong Z,Lu W,Zhu L,et al. Dl-3-n-butylphthalide treatment enhances hemodynamics and ameliorates memory deficits in rats with chronic cerebral hypoperfusion[J]. Front Aging Neurosci,2017,9:238.
[13] Wang YG,Li Y,Wang CY,et al. L-3-n-Butylphthalide protects rats′ cardiomyocytes from ischaemia/reperfusion-induced apoptosis by affecting the mitochondrial apoptosis pathway[J]. Acta Physiol(Oxf),2014,210(3):524-533.
[14] Erturk I,Saglam K,Elasan S,et al. Evaluation of the effects of different treatment modalities on angiogenesis in heart failure patients with reduced/mid-range ejection fraction via VEGF and sVEGFR-1[J]. Saudi Med J,2018,39(10):1028-1034.
[15] Henning RJ. Therapeutic angiogenesis:angiogenic growth factors for ischemic heart disease[J]. Future Cardiol,2016,12(5):585-599.
[16] Yu Z,Zou Y,Fan J,et al. Notch1 is associated with the differentiation of human bone marrow-derived mesenchymal stem cells to cardiomyocytes[J]. Mol Med Rep,2016,14(6):5065-5071.
[17] Zhao Q,Huang J,Wang D,et al. Endothelium-specific CYP2J2 overexpression improves cardiac dysfunction by promoting angiogenesis via Jagged1/Notch 1 signaling[J]. J Mol Cell Cardiol,2018,123:118-127.
[18] LaFoya B,Munroe JA,Mia MM,et al. Notch:a multi-functional integrating system of microenvironmental signals[J]. Dev Biol,2016,418(2):227-241.