再生障碍性贫血(aplastic anemia,AA)是一种以全血细胞减少和骨髓发育不良为特征的骨髓衰竭综合征,T淋巴细胞异常活化是其主要发病机制。近年发现,遗传易感性在AA发病中占有重要地位,特别是端粒长度缩短和端粒酶基因突变[1]。免疫抑制治疗虽已明显提高AA缓解率,但临床上仍有1/3的患者治疗无效,其中部分应用雄激素有效,这些患者可能存在端粒异常。端粒是位于真核细胞线性染色体末端的TTAGGG高度重复序列,长5~20 kb,主要功能是维持染色体完整和稳定[2]。端粒随细胞分裂而逐渐缩短,当缩短到一定程度就会诱导细胞凋亡,故被称为细胞的“有丝分裂钟”。AA患者端粒缩短,缩短程度与病情严重程度相关,也与复发风险、克隆演变及低生存率相关[3],AA可能被视为一种获得性端粒疾病。早在20世纪50~60年代,雄激素便用于AA的治疗,且疗效可靠,但其作用机制一直不十分明确。Calado等[4]研究显示,雄激素可能通过增加端粒酶基因表达及端粒酶活性使端粒延长。本研究旨在探讨雄激素对AA患者端粒长度的影响以及端粒在AA发病机制中的作用。
1 资料与方法
1.1 一般资料 选取2015年1月—2016年6月河北省石家庄平安医院血液科收治的成人初诊非重型AA患者30例,均符合《血液病诊断及疗效标准》中AA诊断标准[5]。按随机数字表法将患者分为环孢素A(cyclosporin A,CsA)组和CsA+雄激素组各15例。CsA组男性8例,女性7例,年龄25~69岁,平均(40.5±11.3)岁;CsA+雄激素组男性7例,女性8例,年龄24~67岁,平均(41.6±15.2)岁。另选取同期体检健康成人15例为对照组,男性8例,女性7例,年龄25~68岁,平均(42.3±12.5)岁。3组性别、年龄差异均无统计学意义(P>0.05),具有可比性。
1.2 治疗方案 CsA+雄激素组:环孢素胶囊(强盛)3~5 mg·kg-1·d-1,分2次口服;定期监测血药浓度,使CsA浓度维持在150~250 μg/L;司坦唑醇片(康力龙)0.1~0.3 mg·kg-1·d-1,分3次口服。 CsA组:单用环孢素胶囊,剂量与浓度同CsA+雄激素组。治疗期间定期复查血常规、肝肾功能及腹部彩色超声。对有感染者应用抗生素治疗,严重贫血或出血者酌情输注红细胞或血小板治疗。
1.3 结局指标 主要疗效终点:基线及治疗后3,6,9,12个月外周血白细胞端粒长度。次要疗效终点:基线及治疗后3,6,9,12个月血常规(白细胞计数、血红蛋白、血小板数目)。血液学改善定义为:与基线相比,血红蛋白水平增加≥1.5 g/L或不再需要输血或输血次数减少>50%,血小板计数增加≥20×109/L或中性粒细胞计数增加≥0.5×109/L。主要安全终点:司坦唑醇不良反应(女性男性化、粉刺、肝毒性)。
1.4 端粒长度检测 应用仪器及试剂:微型离心机(mini-6K);定量PCR仪Cobas z 480(Roche)(51052);移液枪(eppendorf);酶标仪(美国biotek);-80 ℃冰箱(Haier);核酸提取仪(MagCore);核酸提取试剂盒(MagCore Genomic DNA Whole Blood Kit);SYBR Select Master Mix(applied biosysrems by Thermo Fisher Scientific);Taq酶(TAKARA);ddH2O(TAKARA)。
抽取外周血2 mL,EDTA抗凝。应用核酸提取仪以及核酸提取试剂盒按照说明书步骤提取样本基因组DNA,并进行纯度及浓度测定。纯度:OD260/280在1.6~1.9之间,并将DNA调整终浓度至20 ng/μL,留样本备用。所有DNA样本放入-80 ℃冰箱保存备检。
采用实时荧光定量PCR测定相对端粒长度。分别检测样品端粒(Tel)与内参 36B4 基因 PCR 扩增的 Ct 值(荧光起始的循环数)。引物Tel:Forward,5′-CGGTTTGTTTGGGTTTGGGTTT-GGGTTTGGGTTTGGGTT-3′;Reverse,5′-GGC-TTGCCTTACCCTTACCCTTACCCTTACCCTT-ACCCT3′。引物36B4:Forward,5′-CAGCAAGT-GGGAAGGTGTAATCC-3′;Reverse,5′-CCCA-TTCTATCATCAACGGGTACAA-3′。PCR反应:按以下反应体系进行,2×Vazyme LAmp Master Mix 2 μL,ddH2O 3.7 μL,上下游引物各0.15 μL,DNA模板1 μL。端粒Tel基因的反应条件为:95 ℃ 10 min(95℃ 5 s,63 ℃ 5 s,72 ℃ 20 s共40循环),72 ℃ 10 min,18 ℃ 10 min。内参36B4基因的反应条件为:95 ℃ 10 min(95 ℃ 10 s,58 ℃ 10 s,72 ℃ 40 s共40循环),72 ℃ 10 min,18 ℃ 10 min。数据处理:应用荧光定量 PCR仪配套软件,依据标准品的Ct值绘制标准曲线。每次PCR反应均进行1个不加模板DNA,1个不加引物(阴性对照)的反应体系,标准曲线相关系数>0.98。
分别确定样品端粒及内参36B4基因PCR扩增的Ct值,在定量PCR中端粒(T)重复拷贝的比率与单拷贝36B4基因(S)的比率即T/S是确定的,T/S比率与端粒长度成正比例关系,端粒长度可以根据T/S测定。△Ct = CtTel-Ct36B4,相对T/S比率= 2-(△Ct1-△Ct2)=2-△△Ct,△Ct1为每个样品T/S比率,△Ct2为参考DNA的T/S比率,根据此公式可计算出每个样本的相对T/S值,该值与样品DNA的相对端粒长度对应。
1.5 统计学方法 应用SPSS 11.5统计软件分析数据。计量资料比较分别采用两独立样本的t检验和重复测量的方差分析;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 端粒长度相对T/S比率比较 AA患者基线端粒长度相对T/S比率为0.765±0.271,低于对照组的0.978±0.344(t=2.270,P=0.028)。治疗后,CsA组端粒长度相对T/S比率波动降低,CsA+雄激素组端粒长度相对T/S比率逐渐升高,CsA+雄激素组端粒长度相对T/S比率高于CsA组,其组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05),见表1。
表1 CsA组与CsA+雄激素组端粒长度相对 T/S 比率比较
Table 1 Comparision of the relative T/S ratio of telomere length between CsA group and CsA+androgen group![]()
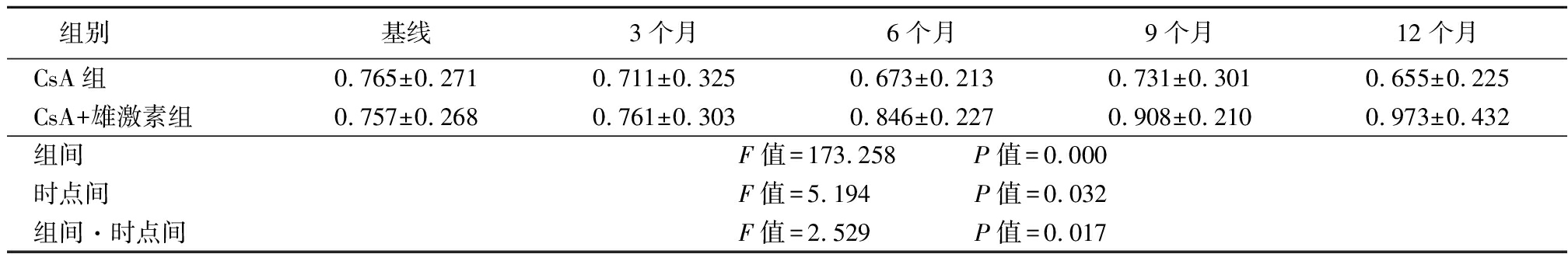
组别基线3个月6个月9个月12个月CsA组0.765±0.2710.711±0.3250.673±0.2130.731±0.3010.655±0.225CsA+雄激素组0.757±0.2680.761±0.3030.846±0.2270.908±0.2100.973±0.432组间F值=173.258 P值=0.000时点间F值=5.194 P值=0.032组间·时点间F值=2.529 P值=0.017
2.2 2组血液学改善率比较 治疗后12个月时CsA+雄激素组血液学改善率高于CsA组(P<0.05),而治疗后3,6,9个月时2组血液学改善率差异无统计学意义(P>0.05),见表2。
表2 CsA组与CsA+雄激素组血液学改善率比较
Table 2 Comparision of the ratio of hematological
improvement between CsA group and CsA+androgen group (n=15,例数,%)
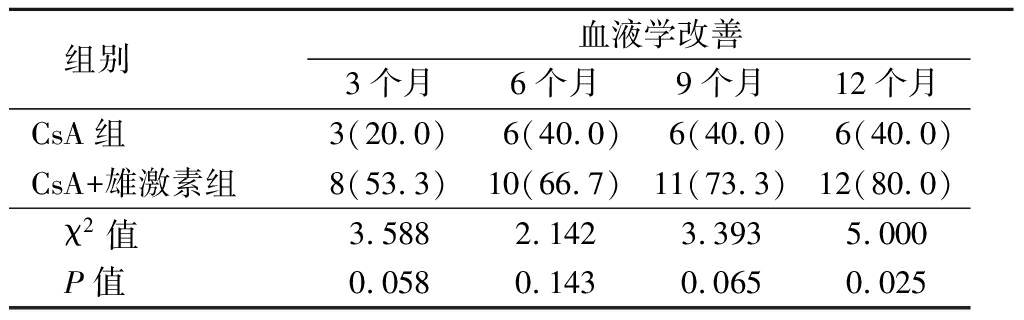
组别血液学改善3个月6个月9个月12个月CsA组3(20.0)6(40.0)6(40.0)6(40.0)CsA+雄激素组8(53.3)10(66.7)11(73.3)12(80.0) χ2值3.5882.1423.3935.000 P值0.0580.1430.0650.025
3 讨 论
端粒是位于线性染色体末端富含G的高度串联重复序列,端粒相关蛋白Shelterin复合体(TRF1、TRF2、TIN2、RAP1、POT1、TPP1)覆盖在端粒上保护其不受破坏。端粒DNA包括双链和3′单链,3′单链可插入双链部分形成特有的T-环,端粒由于富含G碱基,还可形成G聚体结构[6]。端粒的作用是维持染色体完整和稳定。端粒长度随细胞分裂逐渐缩短,当细胞分裂超过Hayflick极限时,染色体极不稳定,导致细胞衰老或凋亡。端粒长度的维持主要依靠端粒酶。端粒酶是一种核糖蛋白,主要包括端粒酶反转录酶(telomerase reverse transcriptase,TERT)、端粒酶核糖核酸(telomerase RNA,TERC)和端粒酶相关蛋白(telomerase protein,TP)3个部分。端粒酶以TERC为模板,TERT为催化亚单位,以逆转录方式来延长细胞分裂时丢失的端粒。DNA修复蛋白Ku蛋白可以招募端粒酶参与端粒DNA修复,防止染色体异常融合[7]。Ku蛋白、减数分裂重组蛋白11、多聚酶1等DNA修复蛋白与Shelterin复合体一起调控端粒长度及结构。慢性炎症[8]、超重[9]、吸烟、饮酒等均能使端粒缩短。系统性红斑狼疮[10]、冠心病[11]等多种疾病均存在端粒缩短。端粒酶与恶性肿瘤的发生发展密切相关,TERT基因多态性是增加肿瘤易感性的危险因素[12],TERT表达水平增高对肿瘤的诊断具有重要意义[13]。
正常的端粒长度和端粒酶活性对于维持干细胞自我更新和增殖分化能力具有重要意义。端粒缺陷可影响骨髓间充质干细胞[14]、造血干细胞等的活性,是干细胞储备凋亡性损耗的核心。端粒(缺陷)综合征可以表现为骨髓衰竭、肺纤维化和肝硬化等,其中由端粒相关基因突变导致的先天性角化不良是最具代表性的端粒(缺陷)综合征之一。AA是最常见的获得性骨髓衰竭性疾病,细胞免疫异常是其主要发病机制,端粒异常在AA发病中也发挥重要作用。约1/3的获得性AA患者端粒长度短于同年龄正常人,这部分患者复发风险大,且转化为骨髓增生异常综合征或白血病的概率大,总生存率低[3]。免疫抑制治疗是治疗AA的主要方法,免疫抑制治疗无效的患者部分应用雄激素治疗有效。雄激素治疗AA疗效确切,但机制一直不很明确。Calado等[4]发现雄激素在体内通过芳香化酶转化为雌激素,通过雌激素受体α途径与端粒酶TERT上的雌激素受体成分结合,上调外周血或骨髓淋巴细胞和CD34+细胞TERT基因表达及端粒酶活性,使造血细胞恢复增殖。同年龄成年女性较同年龄男性的端粒长度长,或是因为性激素分泌的差异所致。雄激素可以使端粒功能缺陷的小鼠模型端粒延长、血液学改善。Townsley等[15]应用雄激素治疗AA、骨髓增生异常综合征患者27例,24个月时83%患者出现血液学反应,92%患者外周血白细胞端粒长度平均延长386 bp。这些均提示端粒缩短的AA患者选择雄激素治疗可能更为有效。
本研究结果显示,AA患者基线端粒长度相对T/S比率明显低于对照组。端粒长度检测方法主要有Southern印记杂交、定量聚合酶链反应、原位杂交荧光定量、流式-荧光原位杂交等。总结既往关于骨髓衰竭综合征患者端粒长度的文献,检测标本多为外周血白细胞或粒细胞,标本选取的不同,直接影响实验结果,不同细胞端粒长度不同,且检测方法及实验室条件不同结果亦有误差,这一点在科研中具有重要意义。关于外周血中不同白细胞亚群端粒长度的情况,国内还没有相关研究;采用Flow-FISH方法检测发现,AA患者外周血粒细胞端粒长度短于同龄正常人,但淋巴细胞端粒长度没有明显变化。虽然各种检测方法不同,结果也不尽相同,但可以确定AA发病机制与端粒长度有关系。
本研究结果显示,CsA组治疗后端粒长度相对T/S比率波动降低,CsA+雄激素组端粒长度相对T/S比率逐渐升高,表明随着雄激素的应用,端粒不但损耗减慢甚至得以延长;CsA+雄激素组端粒长度相对T/S比率高于CsA组,其组间、时点间、组间·时点间交互作用差异有统计学意义,表明CsA治疗AA并不改善端粒长度,CsA的作用位点可能不在端粒,故单纯CsA治疗后端粒延长不明显,而雄激素可以显著延长端粒长度。
本研究结果显示,雄激素与CsA联合应用使AA患者血液学改善率高于单用CsA,血液学改善与雄激素延长端粒相一致,表明雄激素在治疗AA伴端粒功能障碍方面是有效的,可以获得有临床意义的血液学改善。雄激素应用于AA治疗无严重的不良反应,端粒长度可以作为AA患者治疗选择的指标之一。本研究结果对于类似中国这样的发展中国家在临床中广泛应用雄激素治疗血液疾病可能有更广泛的意义,将来雄激素治疗有望进一步应用于治疗、预防与短端粒和复制障碍有关的其他疾病。
[1] 张慧敏,张晓娟,陶朝欣,等.端粒异常与获得性骨髓衰竭综合征的研究进展[J].临床内科杂志,2018,35(4):282-283.
[2] Boddu PC,Kadia TM. Updates on the pathophysiology and treatment of aplastic anemia:a comprehensive review[J]. Expert Rev Hematol,2017,10(5):433-448.
[3] Scheinberg P,Cooper JN,Sloand EM,et al. Association of telomere length of peripheral blood leukocytes with hematopoietic relapse,malignant transformation,and survival in severe aplastic anemia[J]. JAMA,2010,304(12):1358-1364.
[4] Calado RT,Clé DV. Treatment of inherited bone marrow failure syndromes beyond transplantation[J]. Hematology Am Soc Hematol Educ Program,2017,2017(1):96-101.
[5] 沈悌,赵永强.《血液病诊断及疗效标准》[M].4版.北京:科学出版社,2018:18-20.
[6] 王琼,王美,辛化伟.先天性端粒(缺陷)综合征的发病机制与治疗研究进展[J/CD].转化医学电子杂志,2018,5(6):1-8.
[7] Baek KH,Yu HV,Kim E,et al.Calcium influx-mediated translocation of m-calpain induces Ku80 cleavage and enhances the Ku80-related DNA repair pathway[J]. Oncotarget,2016,7(21):30831-30844.
[8] Zhang J,Rane G,Dai X,et al. Ageing and the telomere connection:an intimate relationship with inflammation[J]. Ageing Res Rev,2016,25:55-69.
[9] Freitas-Simoes TM,Ros E,Sala-Vila A. Nutrients,foods,dietary patterns and telomere length:update of epidemiological studies and randomized trials[J]. Metabolism,2016,65(4):406-415.
[10] Lee YH,Jung JH,Seo YH,et al. Association between shortened telomere length and systemic lupus erythematosus:a meta-analysis[J]. Lupus,2017,26(3):282-288.
[11] 吕涛,刘立鹏,李伟杰,等.外周血白细胞端粒长度与急性心肌梗死严重程度和心血管危险因素的关系[J].中国心血管杂志,2018,23(1):36-41.
[12] 秦通,韩振伟,滕志海,等. 亚洲人群肿瘤发病与人类端粒酶逆转录酶rs2736100位点相关性的Meta分析[J].河北医科大学学报,2018,39(11):1304-1310.
[13] 赵文波,樊爱军,楼正青,等.子宫内膜癌端粒酶催化亚单位表达与DNA含量的相关性研究[J].河北医科大学学报,2013,34(6):674-677.
[14] 林源,陶天遵,陶树清,等.衰老骨髓间充质干细胞中端粒短缩与成骨能力下降相关性研究[J].中国骨质疏松杂志,2018,24(10):1317-1323.
[15] Townsley DM,Dumitriu B,Liu D,et al. Danazol treatment for telomere diseases[J]. N Engl J Med,2016,374(20):1922-1931.