幽门螺杆菌由Marshall和Warren于1983年首次鉴定出来[1],是慢性胃炎、消化系统肿瘤发生的高危因素[2]。近年来,治疗性抗体免疫制剂的应用已成为根除幽门螺杆菌感染的有效工具[3-4]。准确检测特异性抗体的含量,对评估免疫制剂质量及免疫治疗效果具有重要意义。双向免疫扩散法是对抗原或抗体进行定性鉴定、效价测定以及纯度、特异性分析的传统方法,这种方法耗时较长,操作复杂,难以实现高通量自动化。酶联免疫吸附测定(enzyme linked immunosorbent assay, ELISA) 是基于抗原抗体固相化的酶标记技术,具有快速、灵敏、简便、易于标准化等优点,目前已广泛用于临床。本研究通过双相免疫扩散法与ELISA检测体系检测抗体羊奶中抗Hp特异性抗体含量,并比较二者检测效果,旨在为免疫制剂抗体的检测提供一种简便、准确、可靠的检测方法。笔者前期研究发现,抗Hp特异性抗体牛奶能够有效清除胃内幽门螺杆菌,具有成本低、产量大、对胃肠道无刺激性及不会产生耐药等优点[5],但考虑到部分人群对牛奶耐受性差,易引起过敏[6],本研究选用α-S1酪蛋白、β-乳球蛋白含量较低的抗体羊奶作为研究对象,初步观察其临床治疗效果,以期为后期临床试验提供有效数据。
1 材料与方法
1.1 实验材料与试剂 幽门螺杆菌菌株选用国际标准菌株H. pylori ATCC26695及SS1,均由石家庄市疾病预防控制中心提供。幽门螺杆菌培养基为哥伦比血亚琼脂培养基(购自北京索莱宝科技有限公司)。弗氏佐剂:取羊毛脂1.5 g,液体石蜡8.5 mL,肠结核菌素0.35 mL(75 mg/mL),置研钵内充分研磨均匀,高压灭菌即可。蛋白提取试剂盒、牛血清白蛋白购自美国西格玛-奥尔德里奇公司;BCA蛋白定量试剂盒购自美国赛默飞世尔科技公司。
1.2 实验方法
1.2.1 菌株的保存与培养 菌株保存于冻存液置-80 ℃冰箱,将冻存的幽门螺杆菌标准菌株ATCC26695及SS1分别于37 ℃水浴箱解冻,混匀后各吸取100 μL菌液接种于哥伦比亚血琼脂培养基上,置于37 ℃、10%CO2、85%N2、5%O2、95%湿度条件下培养48~72 h,复苏成功后传代增菌备用。
1.2.2 含Hp特异性抗体羊奶的免疫制备 用幽门螺杆菌标准菌株制备ATCC26695菌悬液及ATCC26695、SS1混合菌悬液,浓度为3×109 CFU/mL,加入等体积的弗氏佐剂经过超声波粉粹,分别在待免疫奶羊两前肢腋窝和两后腿内侧鼠蹊部淋巴结处进行注射免疫,每个部位注射0.5 mL,每15 d注射1次,连续注射6次,免疫35 d后收集羊奶,经脱脂及巴氏消毒灭菌后储存于-20 ℃备用。
1.2.3 双相免疫扩散法检测抗体 制备琼脂凝胶板,用打孔器按孔径3 mm,孔距15 mm 打孔,中心1个孔,四周6个孔。取新鲜抗体羊奶经8 h 55 ℃水浴灭菌,将离心过滤去除油脂后的羊奶用生理盐水制成1∶1稀释待检液。将ATCC26695及ATCC26695、SS1混合菌液免疫所得抗体羊奶待检液分别加入凝胶板的中央孔,周围1~6孔加入相应的菌液;另取两琼脂板中央孔分别加入ATCC26695及ATCC26695、SS1混合菌液免疫所得抗体羊奶待检液,周围1~6孔均加入生理盐水作为阴性对照。加样后将琼脂板放入湿盒内置 37 ℃温箱中,48 h后取出观察结果。
1.2.4 ELISA检测体系的初步建立 制备包被板:收集培养的幽门螺杆菌于离心管,4 ℃、5 000 g离心力离心10 min,PBS洗涤3次,使用蛋白提取试剂盒提取蛋白,用BCA蛋白定量试剂盒测定蛋白浓度,用PBS调整浓度为1 mg/mL备用。微孔板用2.5%戊二醛预处理后,每孔加入100 μL上述蛋白液,4 ℃包被 16 h, 150 μL 2.5%牛血清白蛋白封闭液 37 ℃封闭 2 h。样本检测:使用PBS将抗体羊奶稀释为1∶200、1∶400、1∶800的待检液,每孔100 μL加入上述微孔板,37 ℃孵育1 h,洗涤;使用含0.1% BSA的PBS稀释HRP标记二抗(1∶8 000),每孔100 μL加入微孔板,室温孵育30 min后,洗涤;显色后,于450 nm波长测定各孔吸光度值。同时设空白对照孔和普通牛奶对照孔,每一样本均设复孔。
1.2.5 临床试验 收集河北医科大学第四医院消化科经三联疗法2个疗程治疗失败的幽门螺杆菌感染者30例,按照随机抽样法分为试验组和对照组,2组各15例,采用双盲安慰剂对照试验,试验组每天晚餐后1~1.5 h口服抗体羊奶200 mL+1 mL NaHCO3(1 mol/L),对照组口服普通羊奶200 mL+1 mL NaHCO3(1 mol/L),连续饮用30 d,分别记录受试者服用前、后14C尿素呼气试验结果。临床试验注册号:ChiCTR-PRC-14005207。
本研究经医院伦理委员会批准;受试者均知情同意。
1.3 统计学方法 应用SPSS 20.0统计软件分析数据。计量资料比较分别采用F检验、LSD-t检验和配对t检验;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 双相免疫扩散试验结果 ATCC26695免疫所得抗体羊奶免疫双扩试验结果,为1个靠近外周孔的沉淀环,表明ATCC26695菌株与羊抗体奶中相应抗体发生沉淀反应; ATCC26695、SS1混合免疫所得抗体羊奶免疫双扩试验结果,为1个靠近外周孔的沉淀环和另外2个靠近中心孔的沉淀环。对照试验无任何沉淀线产生。
2.2 ELISA试验检测结果 ATCC26695抗体羊奶组和ATCC26695、SS1抗体羊奶组中抗Hp特异性抗体含量高于对照组,差异均有统计学意义(P<0.05),且随着稀释倍数增大,抗体含量逐渐降低;2种抗体羊奶间抗体含量差异无统计学意义(P>0.05),二者抗体效价均可达到1∶800。见表1。
表1 不同稀释度下2种抗体羊奶中特异性抗体含量及与对照组比较
Table 1 Specific antibody content in goat milk with two kinds of antibodies
at different dilutions and comparison with control group![]()
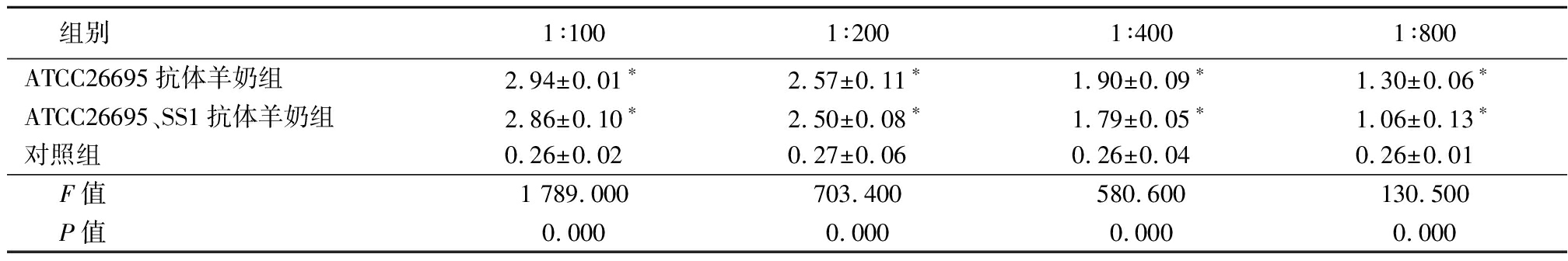
组别1∶1001∶2001∶4001∶800ATCC26695抗体羊奶组2.94±0.01∗2.57±0.11∗1.90±0.09∗1.30±0.06∗ATCC26695、SS1抗体羊奶组2.86±0.10∗2.50±0.08∗1.79±0.05∗1.06±0.13∗对照组0.26±0.020.27±0.060.26±0.040.26±0.01F值1 789.000703.400580.600130.500P值0.0000.0000.0000.000
*P值<0.05与对照组比较(LSD-t检验)
2.3 临床试验效果评价 由于ELISA结果显示ATCC26695抗体羊奶和ATCC26695、SS1抗体羊奶中抗Hp特异性抗体含量没有差异,又因ATCC26695免疫奶羊出现意外,收集奶量不足,故临床试验选用ATCC26695、SS1抗体羊奶进行。结果显示,试验组15例在服用抗体羊奶后有10例14C尿素呼气试验数值明显下降,有效率为66.6%,安慰剂对照组在临床试验前后14C尿素呼气试验数值均无变化,见表2。
在有效人群中,与服用抗体羊奶前相比,服用抗体羊奶后可显著降低14C尿素呼气试验数值,二者相比差异有统计学意义(P<0.05),见表3。
表2 2组临床试验效率比较
Table 2 Efficiency comparison of two groups of
clinical trials (n=15)
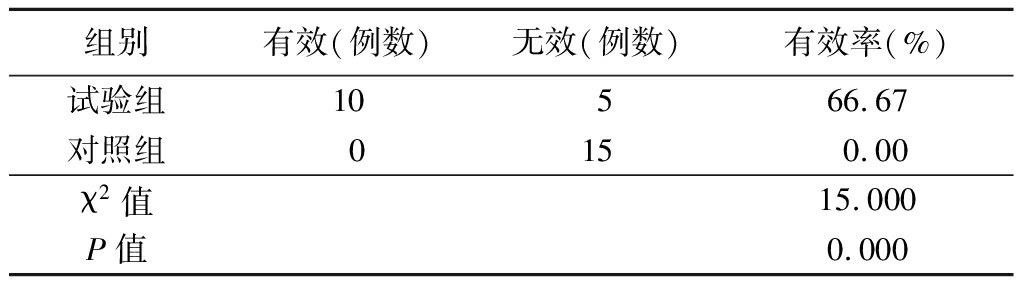
组别有效(例数)无效(例数)有效率(%)试验组10566.67对照组0150.00χ2值15.000P值0.000
表3 受试者服用抗体羊奶前后14C尿素呼气试验数值比较
Table 3 Comparison of 14C urea breath test before
and after taking goat milk![]()
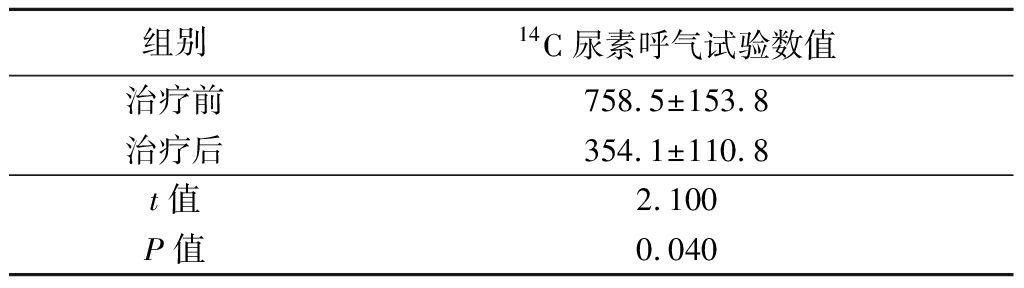
组别14C尿素呼气试验数值治疗前758.5±153.8治疗后354.1±110.8t值2.100P值0.040
3 讨 论
目前,我国人群幽门螺杆菌感染率约为50%[7],根除幽门螺杆菌对预防胃癌的重要性多次在相关共识中强调[8-9]。有研究表明,根除幽门螺杆菌可减少 50%的胃癌发病率,肯定了在癌前病变及癌症早期阶段根除幽门螺杆菌的意义[10]。近年来,幽门螺杆菌感染的治疗已取得了重大进展,但随着临床上根除治疗的广泛应用,使得其耐药率也不断增加[11-13],同时也给患者带来了一定的经济负担。本研究应用含有抗Hp特异性抗体免疫乳治疗幽门螺杆菌感染不仅解决了细菌的耐药问题,同时提供了丰富的营养,是较为经济、安全的手段。
本研究免疫双扩试验结果显示,2种凝胶中均有沉淀环产生,说明抗体羊奶中含有抗Hp特异性抗体;ELISA检测结果显示抗体羊奶中抗Hp特异性抗体含量较高,效价可达1∶800,说明本研究成功构建了检测含Hp特异性抗体的ELISA检测方法,并获得了高浓度的含抗Hp特异性抗体羊奶,为后续系统性方法学评价奠定了基础。比较2种检测方法:免疫双扩试验是一种定性试验,耗时长,可重复性差,肉眼观察结果有一定偏差,且抗体奶中抗体需达到一定量才能检出,而ELISA方法可更为精确的定量检测抗体含量,简便、快速且易于标准化,随时观察抗体奶中抗体含量的变化,所获得的结果更为可靠,可作为抗体羊奶应用的动态观察指标。2种抗体奶检测试验可作为参考指标互相作证。
虽然本研究经ATCC26695和ATCC26695、SS1免疫所得2种羊奶抗体含量差异无统计学意义,但由于不同幽门螺杆菌菌株的基因多态性具有明显的地域分布差异[14-15],且免疫菌株与感染的胃内菌株可能存在差异,故有待于进一步筛选当地流行菌株进行下一步研究。有研究表明,pH值在7.0~8.0时,特异性抗体能与幽门螺杆菌达到最大程度结合[16],因此,本研究受试者在服用抗体羊奶的同时服用NaHCO3以中和胃酸,避免抗体的破坏。
本研究初步结果显示,在试验组15例受试者中有10例14C尿素呼气试验数值发生了明显的降低,有效率达到66.6%,而安慰剂对照组无明显变化。说明通过被动免疫给予受试者抗体羊奶治疗后,可有效降低感染者胃中的幽门螺杆菌含量,结合以往研究,推测其机制可能有2种途径:一是通过羊奶中的有效抗体直接与幽门螺杆菌形成抗原抗体复合物,激活补体系统溶解菌体;二是通过羊奶中的多克隆抗体与幽门螺杆菌多种表面物质结合,改变其生存环境及黏附作用,从而使其失活。此方法经济、营养、患者依从性好、无不良反应且不会出现耐药性等问题,但由于免疫奶羊后产奶量下降,收集奶量不足,致使临床试验例数较少,后期仍需进行大规模的研究。
[1] Marshall BJ,Warren JR. Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration[J]. Lancet,1984,16(1):1311-1315.
[2] 陈莫耶,孙明军.幽门螺杆菌感染与消化系统肿瘤相关性研究进展[J].临床军医杂志,2018,46(1):115-118.
[3] Espinosa RD,Caballero HD,Gomez FR,et al. Immunization with a synthetic Helicobacter pylori peptide induces secretory IgA antibodies and protects mice against infection[J]. Can J Infect Dis Med Microbiol,2019,2019:8595487.
[4] Takeshita H,Watanabe E,Norose Y,et al. Neutralizing antibodies for Helicobacter pylori urease inhibit bacterial colonization in the murine stomach in vivo[J]. Biomed Res,2019,40(2):87-95.
[5] 赵连梅,魏思思,武一鹏,等.含幽门螺杆菌特异性抗体牛奶清除幽门螺杆菌效果的临床随机试验[J].中国免疫学杂志,2017,33(2):274-277.
[6] Gil F,Mendizabal M,Amezqueta A,et al. A new score to predict allergic march in patients with IgE-mediated cow milk allergy [J]. Allergy Asthma Proc,2019,40(3):187-192.
[7] Changxi CH,Mao Y,Du J,et al. Helicobacter pylori infection associated with an increased risk of colorectal adenomatous polyps in the Chinese population[J]. BMC Gastroenterol,2019,19(1):14.
[8] S nchez DJ,García-Iglesias P,Titó L,et al. Update on the management of Helicobacter pylori infection. Position paper from the catalan society of digestology[J]. Gastroenterol Hepatol,2018,41(4):272-280.
nchez DJ,García-Iglesias P,Titó L,et al. Update on the management of Helicobacter pylori infection. Position paper from the catalan society of digestology[J]. Gastroenterol Hepatol,2018,41(4):272-280.
[9] Liu WZ,Xie Y,Lu H,et al. Fifth Chinese National Consensus Report on the management of Helicobacter pylori infection[J]. Helicobacter,2018;23(2):e12475.
[10] Choi IJ, Kook MC, Kim YI, et al. Helicobacter pylori therapy for the prevention of metachronous gastric cancer[J]. N Engl J Med,2018,378(12):1085-1095.
[11] 魏思思,赵连梅,单保恩.幽门螺杆菌的治疗现状和研究进展[J].河北医科大学学报,2017,38(7):861-865.
[12] 周雄杰,吕志刚,柳家红.幽门螺杆菌感染患者影响因素及耐药性分析[J].中华医院感染学杂志,2018,28(16):2490-2493.
[13] Kageyama C,Sato M,Sakae H. Increase in antibiotic resistant Helicobacter pylori in a University Hospital in Japan[J]. Infect Drug Resist,2019,12(12):597-602.
[14] Yadegar A,Mohabati Mobarez A,Zali MR. Genetic diversity and amino acid sequence polymorphism in Helicobacter pylori CagL hypervariable motif and its association with virulence markers and gastroduodenal diseases[J]. Cancer Med,2019,8(4):1619-1632.
[15] Marques V,Cunha B,Couto A. Characterization of gastric cells infection by diverse Helicobacter pylori strains through Fourier-transform infrared spectroscopy[J]. Spectrochim Acta A Mol Biomol Spectrosc,2019,210:193-202.
[16] Early EM,Hardy H,Forde T,et al. Bactericidal effect of a whey protein concentrate with anti-Helicobacter pylori activity[J]. J Appl Microbiol,2001,90(5): 741-748.