重症肺炎(severe pneumonia,SP)的病原菌分布因地区、科室及季节的不同而有差异,金黄色葡萄球菌是一种危险的人类病原体,可导致多种疾病[1]。抗生素耐药性是对人类的主要威胁[2]。耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)具有广谱耐药性,其耐药机制复杂,具有极高的病死率[3]。通过临床总结和分析MRSA感染SP患者预后的危险因素可以帮助尽早采取措施提高治疗效果[4]。最近的临床研究结果认为,SP患者免疫力低下是影响预后和归转的因素之一[5],但是关于MRSA感染SP患者的预后与外周血免疫细胞亚群的研究极少。本研究探讨MRSA感染SP患者预后的影响因素及其外周血免疫细胞亚群变化,旨在为更好治疗MRSA感染SP患者提供依据,报告如下。
1 资料与方法
1.1 一般资料 选择2015年1月—2018年12月我院收治的MRSA感染SP患者62例为研究组,男性34例,女性28例,年龄33~75岁,平均(51.58±3.89)岁,根据研究组治疗后的死亡情况分为存活组37例和死亡组25例。选择同期非感染MRSA的普通SP患者60例为对照组,男性34例,女性26例,年龄36~73岁,平均(51.03±3.96)岁。同期体检的健康者60例为健康组,男性33例,女性27例,年龄35~75岁,平均(52.13±3.86)岁。3组性别、年龄差异均无统计学意义(P>0.05),具有可比性。
本研究经医院伦理委员会批准通过;所有受试者均知情同意。
1.2 纳入标准和排除标准 纳入标准:①年龄20~75岁;②经X线片检查和实验室检查符合肺炎的诊断标准[6];③符合美国胸科协会及感染协会关于重症肺炎的诊断标准[7];④确诊为感染MRSA。排除标准:①合并免疫系统疾病或血液学疾病;②合并恶性肿瘤;③合并HIV感染;④哺乳期或妊娠期妇女。
1.3 MRSA鉴定 采集患者痰液进行病原体培养和检测,菌种鉴定应用全自动细菌鉴定系统(phoenix-100,BD公司,美国),所有检测均按照美国CLSI标准进行。
1.4 资料收集 通过问卷调查的方法收集所有受试者的基本资料、住院情况、机械通气情况及治疗情况。吸烟和酗酒是指根据美国精神障碍诊断与统计手册中诊断为烟草依赖或酒精依赖[8]。
1.5 外周血T淋巴细胞亚群比较 抽取外周静脉血,应用流式细胞术检测每份样本中外周血T淋巴细胞CD3+、CD4+、CD8+、CD19+及CD16+CD56+细胞百分比,CD4+ /CD8+比值,试剂盒购买于武汉华美公司。
1.6 统计学方法 应用SPSS 19.0统计软件分析数据。计量资料比较分别采用两独立样本的t检验、F检验和SNK-q检验;计数资料比较采用χ2检验; 危险因素确定采用多元Logistic回归分析。P<0.05为差异均有统计学意义。
2 结 果
2.1 3组外周血T淋巴细胞亚群比较 对照组和研究组CD3+、CD4+、CD4+/CD8+明显低于健康组,CD19+和CD16+CD56+明显高于健康组,研究组CD3+、CD4+、CD4+/CD8+明显低于对照组,CD19+和CD16+CD56+明显高于对照组,差异均有统计学意义(P<0.05);3组CD8+差异无统计学意义(P>0.05)。见表1。
表1 3组外周血T淋巴细胞亚群比较![]()
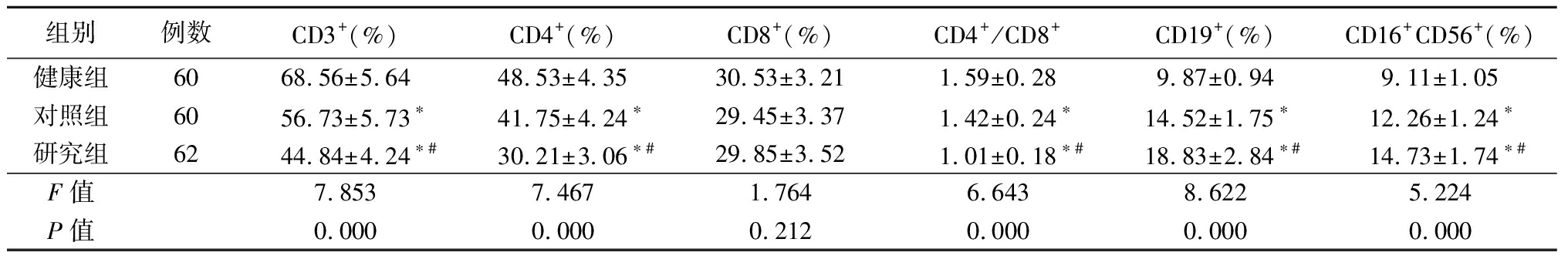
组别例数CD3+(%)CD4+(%)CD8+(%)CD4+/CD8+CD19+ (%)CD16+CD56+ (%)健康组6068.56±5.6448.53±4.3530.53±3.211.59±0.289.87±0.949.11±1.05对照组6056.73±5.73∗41.75±4.24∗29.45±3.371.42±0.24∗14.52±1.75∗12.26±1.24∗研究组6244.84±4.24∗#30.21±3.06∗#29.85±3.521.01±0.18∗#18.83±2.84∗#14.73±1.74∗#F值7.8537.4671.7646.6438.6225.224P值0.0000.0000.2120.0000.0000.000
*P值<0.05与健康组比较 #P值<0.05与对照组比较(SNK-q检验)
2.2 存活组与死亡组基本资料比较 本研究62例MRSA感染SP患者中死亡25例,病死率为40.32%。死亡组年龄明显大于存活组,机械通气、入住ICU比例明显高于存活组,差异均有统计学意义(P<0.05);2组性别、吸烟、酗酒、并发肿瘤或心血管疾病、既往MRSA史差异均无统计学意义(P>0.05)。见表2。
2.3 存活组与死亡组临床症状和实验室指标比较 死亡组意识障碍、多脏器功能衰竭、呼吸衰竭、白细胞减少比例明显高于存活组,CD3+、CD4+、CD4+/CD8+明显低于存活组,CD19+、CD16+CD56+明显高于存活组,差异均有统计学意义(P<0.05);2组气促、高热、咳嗽、胸痛、咯血、胃肠道症状、胸腔积液、气胸、低蛋白血症、酸中毒、血小板减少比例差异均无统计学意义(P>0.05)。见表3。
表2 存活组与死亡组基本资料比较 (例数,%)
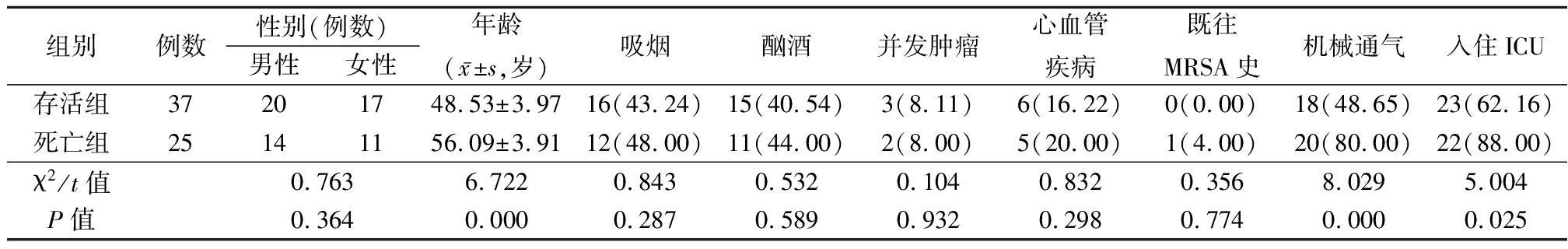
组别例数性别(例数)男性女性年龄(x-±s,岁)吸烟酗酒并发肿瘤心血管疾病既往MRSA史机械通气入住ICU存活组37201748.53±3.9716(43.24)15(40.54)3(8.11)6(16.22)0(0.00)18(48.65)23(62.16)死亡组25141156.09±3.9112(48.00)11(44.00)2(8.00)5(20.00)1(4.00)20(80.00)22(88.00)χ2/t值0.7636.7220.8430.5320.1040.8320.3568.0295.004P值0.3640.0000.2870.5890.9320.2980.7740.0000.025
表3 存活组与死亡组临床症状和实验室指标比较 (例数,%)
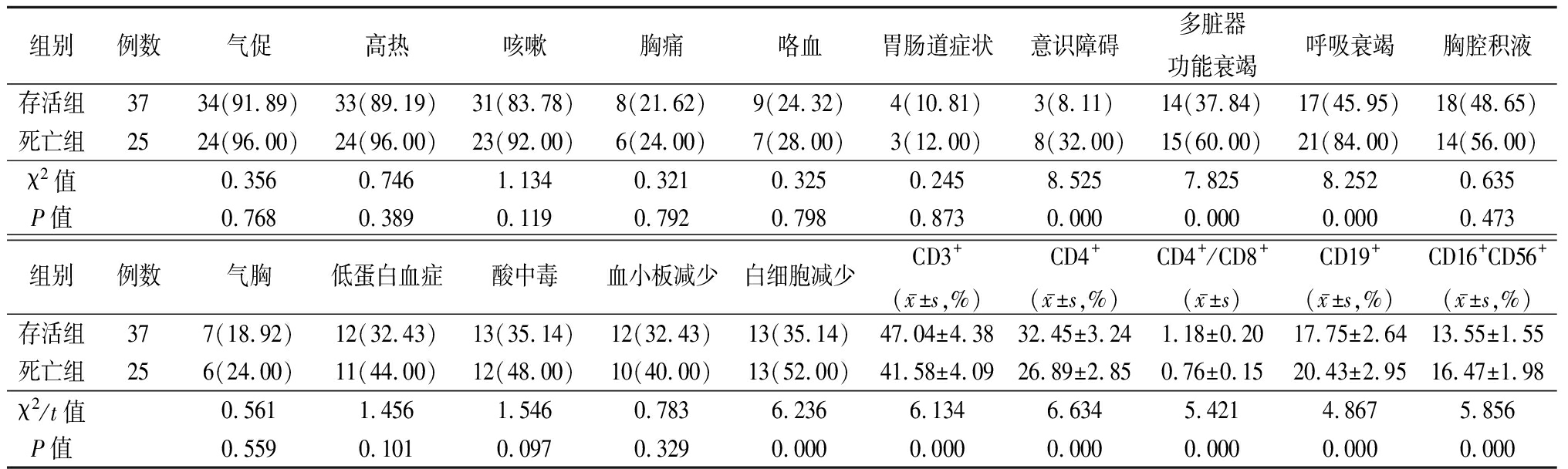
组别例数气促高热咳嗽胸痛咯血胃肠道症状意识障碍多脏器功能衰竭呼吸衰竭胸腔积液存活组3734(91.89)33(89.19)31(83.78)8(21.62)9(24.32)4(10.81)3(8.11)14(37.84)17(45.95)18(48.65)死亡组2524(96.00)24(96.00)23(92.00)6(24.00)7(28.00)3(12.00)8(32.00)15(60.00)21(84.00)14(56.00)χ2值0.3560.7461.1340.3210.3250.2458.5257.8258.2520.635P值0.7680.3890.1190.7920.7980.8730.0000.0000.0000.473组别例数气胸低蛋白血症酸中毒血小板减少白细胞减少CD3+(x-±s,%)CD4+(x-±s,%)CD4+/CD8+(x-±s)CD19+(x-±s,%)CD16+CD56+(x-±s,%)存活组377(18.92)12(32.43)13(35.14)12(32.43)13(35.14)47.04±4.3832.45±3.241.18±0.2017.75±2.6413.55±1.55死亡组256(24.00)11(44.00)12(48.00)10(40.00)13(52.00)41.58±4.0926.89±2.850.76±0.1520.43±2.9516.47±1.98χ2/t值0.5611.4561.5460.7836.2366.1346.6345.4214.8675.856P值0.5590.1010.0970.3290.0000.0000.0000.0000.0000.000
2.4 MRSA感染SP患者预后不佳的Logistic回归分析 以MRSA感染SP患者预后(预后佳=0,预后不良=1)为因变量,以机械通气(否=0,是=1)、入住ICR(否=0,是=1)、意识障碍(否=0,是=1)、多脏器功能衰竭(否=0,是=1)、CD3+(>43.56%=0,≤43.56%=1)、CD4+/CD8+(>0.91=0,≤0.91=1)、CD16+CD56+(<14.42%=0,≥14.42%=1)为自变量进行Logistic回归分析,结果显示机械通气、入住ICU、意识障碍、多脏器功能衰竭、CD3+、CD4+/CD8+和CD16+CD56+是MRSA感染SP患者预后不佳的危险因素(P<0.05),见表4。
表4 MRSA感染SP患者预后不佳的Logistic回归分析
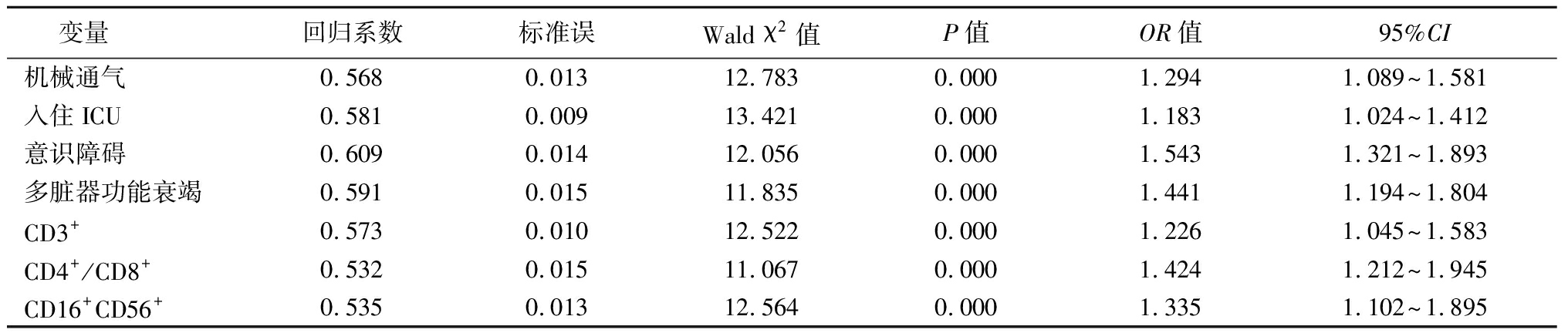
变量回归系数标准误Wald χ2值P值OR值95%CI机械通气0.5680.01312.7830.0001.2941.089~1.581入住ICU0.5810.00913.4210.0001.1831.024~1.412意识障碍0.6090.01412.0560.0001.5431.321~1.893多脏器功能衰竭0.5910.01511.8350.0001.4411.194~1.804CD3+0.5730.01012.5220.0001.2261.045~1.583CD4+/CD8+0.5320.01511.0670.0001.4241.212~1.945CD16+CD56+0.5350.01312.5640.0001.3351.102~1.895
3 讨 论
20世纪60年代MRSA出现并在全球传播,已经成为细菌感染及引起患者死亡的主要原因。金黄色葡萄球菌分离株中的甲氧西林耐药率可高达75%[9]。MRSA菌株为显性克隆,适应生存能力较强,并且在医院环境内或之外传播。近年来金黄色葡萄球菌的耐药性呈现升高趋势,并且金黄色葡萄球菌在院外环境生存和传播导致MRSA感染社区获得性肺炎患者的比例逐渐升高[10]。本研究62例感染MRSA患者中死亡25例,病死率为40.32%,这与国内最新研究MRSA病死率为20%~60%相一致[11],MRSA病死率仍然处于较高水平。因此,提高患者的存活率极为重要,总结感染MRSA的SP患者预后不良的高危因素对临床降低病死率、提高预后具有重要意义。
本研究死亡组与存活组性别差异无统计学意义,但是死亡组年龄高于存活组。既往研究显示高龄患者具有较高的病死率[12],这可能是由于高龄患者免疫力较低的原因。本研究死亡组合并机械通气和入住ICU比例高于存活组。机械通气是一种入侵行操作,可能提高患者感染的风险,并且细菌更容易在导管表面滋生,呼吸机相关肺炎也是一种较为常见的严重感染,这均提示了机械通气可能引起患者的不良预后[13]。多数SP患者需要入住ICU治疗,而入住ICU已经被认为是一种明确影响预后的不良因素,此类患者症状较重,往往伴有多脏器功能衰竭等,直接影响了治疗效果;此外,ICU是多种病原菌生长和传播的所在,入住ICU也是感染耐碳青霉烯类抗生素的肺炎克雷伯菌的高危因素[14]。本研究Logistic回归分析结果显示,机械通气、入住ICU是MRSA感染SP患者预后不佳的危险因素。
本研究死亡组与存活组各种临床症状发生情况差异无统计学意义,这与潘文森等[15]的研究结果一致;死亡组发生意识障碍、多脏器功能衰竭、呼吸衰竭比例更高,因为发生意识障碍或多脏器功能衰竭的患者往往需要入住ICU并进行机械通气;Logistic回归分析结果显示机械通气和入住ICU是影响MRSA感染SP患者预后不佳的危险因素。低蛋白血症和酸中毒是SP患者的常见症状,呼吸能力降低会引起体内二氧化碳水平升高导致酸中毒。本研究死亡组与存活组低蛋白血症和酸中毒差异无统计学意义,这也与Fu等[16]的研究结果相一致;Logistic回归分析结果显示意识障碍、多脏器功能衰竭是引起MRSA感染SP患者预后不佳的危险因素。
机体的免疫水平具有抵抗病原菌、调节炎性反应和抗炎反应的功能,人体的免疫系统包括体液免疫和细胞免疫,其中T细胞是实现细胞免疫的主要参与细胞, T辅助细胞(CD4+)和T抑制细胞(CD8+)是主要亚群,CD4+/CD8+比例反映机体的细胞免疫功能[5]。SP患者免疫水平明显降低,外周血中CD3+、CD4+和CD4+/CD8+均明显降低,而经过治疗后患者的T细胞亚群水平有所改善[17]。CD19+和CD16+CD56+分别表示B淋巴细胞和自然杀伤细胞的水平,SP患者CD19+和CD16+CD56+水平均明显升高[18-19]。本研究结果显示,对照组和研究组CD3+、CD4+和CD4+/CD8+均明显低于健康组,CD19+和CD16+CD56+明显高于健康组,研究组CD3+、CD4+和CD4+/CD8+均明显低于对照组,CD19+和CD16+CD56+明显高于对照组。与过往研究结果一致[19]。说明MRSA感染患者具有更低的免疫水平。本研究死亡组CD3+、CD4+和CD4+/CD8+明显低于存活组;CD19+和CD16+CD56+明显高于存活组;Logistic回归分析结果显示,低水平的CD3+、CD4+、CD4+/CD8+以及高水平的CD19+和CD16+CD56+是MRSA感染SP患者预后不佳的危险因素。赵丹等[20]的研究结果也显示,外周血免疫细胞亚群变化可能是SP患者预后不佳的危险因素。
综上所述,机械通气、入住ICU、意识障碍、多脏器功能衰竭、CD3+、CD4+和CD4+/CD8+是MRSA感染SP患者预后不佳的的危险因素,分析患者的基本资料、临床症状及免疫系统,可为临床更好评估患者预后提供依据。
[1] 丁林,季伟,张新星.2012-2015年苏州大学附属儿童医院重症肺炎483例病原学分析[J].中国实用儿科杂志,2018,33(6):449-452.
[2] 王爱皎.老年重症肺炎患者的临床特点、病原菌耐药性及死亡相关因素[J].中国医刊,2017,52(3):84-87.
[3] 李玲,叶小华,陈思东.中国内地医院肿瘤患者MRSA流行状况的Meta分析[J].海南医学,2017,28(14):2383-2386.
[4] 杨晓娟,吴军伟,曹官铭.慢性阻塞性肺疾病合并MRSA感染68例临床分析[J].西南国防医药,2018,28(4):367-368.
[5] 周丽,徐洪山,赵丹,等.免疫治疗对重症肺炎患者免疫功能指标及炎症因子的影响[J].检验医学与临床,2017,14(18):2658-2661.
[6] 焦洋,黄怡.《2014 NICE临床指南:成人社区和医院获得性肺炎诊断和管理》解读[J].中国实用内科杂志,2015,35(5):411-413.
[7] 陈云峰.关于“中国成人社区获得性肺炎诊断和治疗指南(2016年版)”中重症肺炎诊断标准的商榷[J].中华结核和呼吸杂志,2017,40(8):639.
[8] 曹瑞想,张宁.美国精神障碍诊断与统计手册第5版的变化要点[J].临床精神医学杂志,2013,23(4):289-290.
[9] Carballo N,De Antonio-Cuscó M,Echeverría-Esnal D,et al. Community-acquired pneumonia caused by methicillin-resistant Staphylococcus aureus in critically-ill patients:systematic review[J]. Farm Hosp,2017,41(2):187-203.
[10] Cho SY,Chung DR. Infection prevention strategy in hospitals in the era of community-associated methicillin-resistant staphylococcus aureus in the asia-pacific region: a review[J]. Clin Infect Dis,2017,64(Suppl 2):S82-90.
[11] 郑金鑫,王红燕,徐芹珍,等.2008-2015年深圳某医院金黄色葡萄球菌血流感染的临床特征和预后分析[J].中国感染与化疗杂志,2017,17(3):238-244.
[12] Jwa H,Beom JW,Lee JH. Predictive factors of methicillin-resistant staphylococcus aureus infection in elderly patients with community-onset pneumonia[J]. Tuberc Respir Dis(Seoul),2017,80(2):201-209.
[13] 朱明华,毕艳华,刘华,等.呼吸机管路内细菌污染与呼吸机相关性肺炎的相关性研究[J].中华医院感染学杂志,2017,27(10):2233-2236.
[14] 窦琳,林竹,路玲,等.重症监护室获得性耐甲氧西林金黄色葡萄球菌感染临床监测的多中心研究[J].中华急诊医学杂志,2017,26(3):302-304.
[15] 潘文森,张丽丽,于婧,等.多重耐药鲍曼不动杆菌感染重症肺炎患者预后相关因素分析[J].河北医科大学学报,2016,37(8):869-873.
[16] Fu Y,Li Y,Xu L,et al. Immunology repertoire study of pulmonary sarcoidosis T cells in CD4+,CD8+ PBMC and tissue[J]. Oncotarget,2017,8(52):89515-89526.
[17] 龙思琪,马莉,陈敏,等.婴幼儿重症和非重症肺炎淋巴细胞亚群的差异分析[J].中国免疫学杂志,2016,32(3):401-404.
[18] Zhou G,Wang D,Liu D,et al. Expression of B and T lymphocyte attenuator in patients with severe community-acquired pneumonia and the effect of steroid therapy in a mouse model[J]. Clin Lab,2016,62(12):2367-2377.
[19] Man G,Wang K,Yang M,et al. Transcriptome analysis of bronchoalveolar lavage fluid from children withmycoplasma pneumoniaepneumonia reveals natural killer and T cell-proliferation responses[J]. Front Immunol,2018,9:1403.
[20] 赵丹,宁睿,王春艳,等.不同预后的重症肺炎患者住院期间血清和肺泡灌洗液TLR4水平、外周血免疫细胞计数比较[J].山东医药,2017,57(15):96-98.