超重的2型糖尿病(type 2 diabetes mellitus,T2DM)患者住院期间的药物治疗往往可以达到较好的血糖和体重控制效果,但这种效果在患者出院后往往难以保持。这种现象的原因之一在于目前没有完善的适合于我国超重的T2DM患者的膳食模式建议,目前国内在这个领域进行的研究并不多。DNA甲基化在T2DM和超重的发生过程中扮演着重要角色,是糖尿病发生的早期事件之一。有研究显示脂肪细胞特异性分泌的瘦素(leptin)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)与超重引起的T2DM关系密切[1-2]。近20年的研究表明我国的膳食结构发生了重大改变,粗粮摄入量明显降低,而动物性食品和脂肪摄入量明显增多,导致超重和T2DM发生率增加。本研究通过低碳水化合物膳食治疗超重的T2DM,旨在观察其对机体leptin基因和TNF-α基因甲基化的影响。
1 资料与方法
1.1 一般资料 选择2015年1月—2017年6月我院收治的超重的T2DM患者120例,采用随机数字法分为观察组和对照组各60例。观察组男性37例,女性23例,年龄18~68岁,平均(45.31±10.35)岁;对照组男性35例,女性25例,年龄18~68岁,平均(45.62±9.76)岁。2组性别、年龄差异均无统计学意义(P>0.05), 具有可比性。
1.2 纳入标准和排除标准 纳入标准:①符合T2DM诊断标准,其体重指数(body mass index,BMI)超过24;②糖化血红蛋白(hemoglobin A1c,HbA1c)超过7.5%;③糖尿病病史不超过10年;④近2周未使用胰岛素治疗;⑤本研究经医院医学伦理委员会批准通过,患者均知情同意。排除标准:①近3个月体重、血糖和血脂波动大于20%;②用药发生较大改变,如换用胰岛素、比格列酮等容易引起水钠潴留及增重药物;③严重肝肾疾病、心脏病,以及垂体、甲状腺和精神相关疾病,消化道溃疡或其他影响胃肠道吸收的疾病;④癌症患者;⑤近6个月使用过抗抑郁药、雌激素或甾类激素类药物;⑥处于妊娠期或哺乳期。
1.3 方法
1.3.1 膳食干预 2组在接受干预期间应保持其用药与干预前一致,即用药种类及剂量不发生改变。观察组给予低碳水化合物膳食,对照组给予日常膳食。低碳水化合物干预膳食将根据受试者身高、体重及活动强度,按照标准能量计算公式为每一位受试者出具个体化的推荐膳食能量摄入量,其中可消化的碳水化合物的总摄入量低于100 g/d,不包括膳食纤维。食谱设计原则为使用碳水化合物利用率低的食物替代利用率高的食物,使用富含蛋白质的食品保障总能量摄入。见表1。
表1 干预膳食模式说明
Table 1 Description of intervention meal patterns

干预膳食 模式说明 低碳水化合物膳食日常膳食总能量正常正常碳水化合物<100 g/d250~350 g/d碳水化合物供能比10%~20%55%~65%蛋白质供能比30%~35%10%~15%脂肪供能比50%~60%20%~30%
1.3.2 糖尿病痛苦量表(Diabetes Distress Scale,DDS)和成人糖尿病特异性生存质量量表(Audit of Diabetes-dependent Quality of Life,ADQoL) DDS主要包括负担、医生、相关性痛苦、人际关系等4个子量表,17个条目,分数越高表明痛苦越大。ADQoL包括13个条目,采用7分制,每个条目得分与重要性相乘,累计相加,分数越高表明生活质量越高。
1.3.3 RT-PCR 治疗前和治疗后6个月应用Trizol法提取总RNA,采用逆转录试剂盒合成cDNA leptin 引物设计:正向引物5′-TGCGGATTCTTGTGGCTTTGG-3′,反向引物5′-GACTGACTGCGTGTGTGAAATGT-3′。leptin甲基化:正向引物5′-TTTTTGGAGGGATATT-AAGGATTTTT-3′,反 向 引 物:5′-CAAAACT-ATCATAATCCAAAACTAAACCAT-3′。TNF-α引物设计:正向引物5′-FGTGACAAGCCTG-TAGCCCAT-3′,反向引物5′-TATCTCTCAGCT-CCACCCCA-3′。TNF-α甲基化:正向引物5′-ATTTTTAAATTTATATTTAA-3′,反向引物5′-ATTATTTTTATATATTTTTA-3′。β-actin 正向引物5′-TGAAGATCAAGATCATTGCTCCTC-3′,反向引物5′-AACTAAGTCATAGTCCGC-CTAGAAG -3′。利用qRT-PCR试剂进行扩增,用荧光定量PCR进行结构分析。
1.3.4 标本的留取和检测 入组第1天和6个月后,取空腹静脉血约10 mL,以2 500 r/min离心,离心半径6 cm,离心约10 min,分离出上清液放置在-80 ℃的冰箱中保存。应用电化学发光仪(瑞士罗氏公司)以及leptin和TNF-α检测试剂盒(瑞士罗氏公司),采用双抗体夹心化学发光法检测leptin和TNF-α水平,用生物素化单克隆leptin和TNF-α特异性抗体与血清混合,形成抗原抗体复合物,然后加入链霉素磁珠微粒进行二次孵育,通过生物素和链霉素亲和素作用结合,以电磁效应将磁珠吸附在电极表面,通过电极的电压促进复合物化学发光,测定发光强度,用Elecsys软件自动计算出leptin和TNF-α含量。
1.3.5 观察指标 观察2组治疗前后空腹血糖(fasting blood glucose,FBS)、空腹胰岛素(fasting insulin,FINS)、稳态模式评估法(homeostasis model assessment,HOMA-IR)、HbA1c,总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、BMI、腰围、DDS、ADQoL、leptin和TNF-α甲基化及血清水平的变化。
1.4 统计学方法 应用SPSS 12.0统计软件分析数据。计量资料比较分别采用两独立样本的t检验和配对t检验;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 2组治疗前后FBS、FINS、HOMA-IR和HbA1c水平变化 治疗前2组FBP、FINS、HOMA-IR和HbA1c水平差异均无统计学意义(P>0.05);治疗后2组FBP、FINS、HOMA-IR和HbA1c水平均较治疗前明显降低(P<0.05),观察组降低幅度更大, 治疗后观察组FBP、FINS、HOMA-IR和HbA1c水平均低于对照组(P<0.05)。见表2。
2.2 2组治疗前后血脂水平变化 治疗前2组TC、TG、HDL-C和LDL-C水平差异均无统计学意义(P>0.05);治疗后观察组TC、TG水平均较治疗前明显降低(P<0.05),HDL-C水平较治疗前明显升高,治疗后观察组TC、TG均明显低于对照组,HDL-C明显高于对照组(P<0.05),2组治疗前后LDL-C水平差异无统计学意义(P>0.05)。见表3。
表2 2组治疗前后FBP、FINS、HOMA-IR和HbA1c水平变化
Table 2 Changes of FBP,FINS,HOMA-IR and HbA1c levels before and after treatment between two groups ![]()
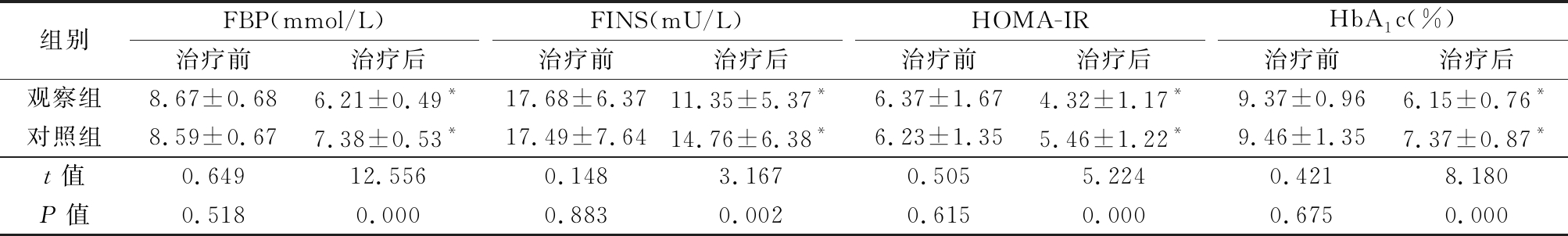
组别FBP(mmol/L)治疗前治疗后FINS(mU/L)治疗前治疗后HOMA-IR治疗前治疗后HbA1c(%)治疗前治疗后观察组8.67±0.686.21±0.49*17.68±6.3711.35±5.37*6.37±1.674.32±1.17*9.37±0.966.15±0.76*对照组8.59±0.677.38±0.53*17.49±7.6414.76±6.38*6.23±1.355.46±1.22*9.46±1.357.37±0.87*t值0.64912.5560.1483.1670.5055.2240.4218.180P值0.5180.0000.8830.0020.6150.0000.6750.000
*P值<0.05与治疗前比较(配对t检验)
表3 2组治疗前后血脂水平变化
Table 3 Changes of blood lipid levels before and after treatment between two groups![]()
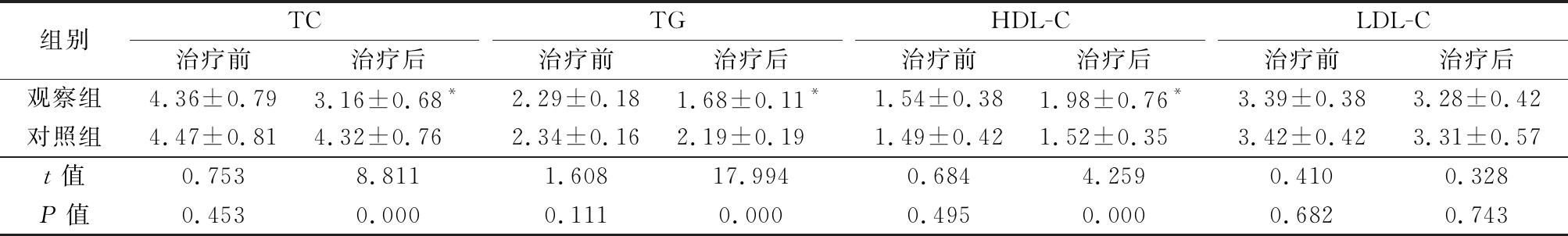
组别TC治疗前治疗后TG治疗前治疗后HDL-C治疗前治疗后LDL-C治疗前治疗后观察组4.36±0.793.16±0.68*2.29±0.181.68±0.11*1.54±0.381.98±0.76*3.39±0.383.28±0.42对照组4.47±0.814.32±0.76 2.34±0.162.19±0.191.49±0.421.52±0.353.42±0.423.31±0.57t值0.7538.8111.60817.9940.6844.2590.4100.328P值0.4530.0000.1110.0000.4950.0000.6820.743
*P值<0.05与治疗前比较(配对t检验)
2.3 2组治疗前后BMI、腰围、DDS评分和ADQoL评分变化 治疗前2组BMI、腰围、DDS评分和ADQoL评分差异均无统计学意义(P>0.05);治疗后观察组BMI、腰围和DDS评分较治疗前明显降低(P<0.05),ADQoL评分较治疗前明显升高(P<0.05),治疗后观察组BMI、腰围和DDS评分均低于对照组(P<0.05),ADQoL评分高于对照组(P<0.05)。见表4。
表4 2组治疗前后BMI,腰围,DDS评分和ADQoL评分变化
Table 4 Changes in BMI,waist circumference, DDS score and ADQoL score before and after treatment between two groups![]()
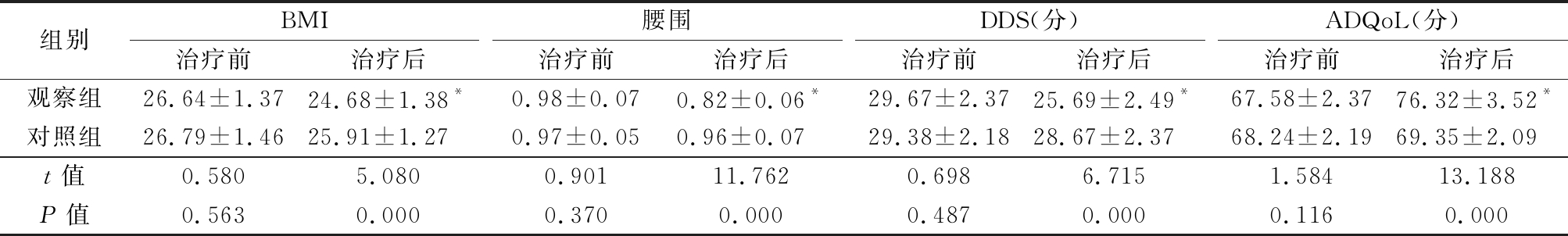
组别BMI治疗前治疗后腰围治疗前治疗后DDS(分)治疗前治疗后ADQoL(分)治疗前治疗后观察组26.64±1.3724.68±1.38*0.98±0.070.82±0.06*29.67±2.3725.69±2.49*67.58±2.3776.32±3.52*对照组26.79±1.4625.91±1.270.97±0.050.96±0.0729.38±2.1828.67±2.3768.24±2.1969.35±2.09t值0.5805.0800.90111.7620.6986.7151.58413.188P值0.5630.0000.3700.0000.4870.0000.1160.000
*P值<0.05 与治疗前比较(配对t检验)
2.4 2组治疗前后leptin和TNF-α甲基化及水平变化 治疗前2组leptin和TNF-α甲基化率及水平差异均无统计学意义(P>0.05);治疗后2组leptin和TNF-α甲基化率均较治疗前明显升高(P<0.05),血清leptin和TNF-α水平均较治疗前明显降低(P<0.05),而观察组升高或降低幅度更大,治疗后观察组leptin和TNF-α甲基化率均高于对照组(P<0.05), leptin和TNF-α水平低于对照组(P<0.05)。见表5。
表5 2组治疗前后leptin和TNF-α甲基化及水平变化
Table 5 Changes of leptin and TNF-α methylation and levels before and after treatment between two groups![]()
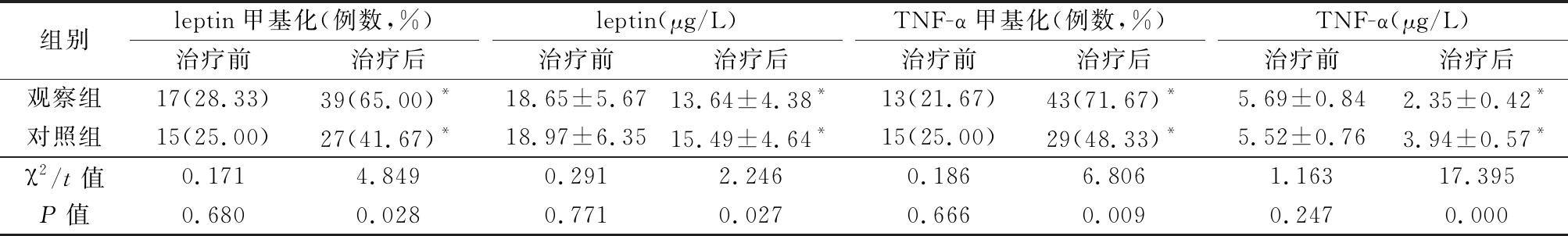
组别leptin甲基化(例数,%)治疗前治疗后leptin(μg/L)治疗前治疗后TNF-α甲基化(例数,%)治疗前治疗后TNF-α(μg/L)治疗前治疗后观察组17(28.33)39(65.00)*18.65±5.6713.64±4.38*13(21.67)43(71.67)*5.69±0.842.35±0.42*对照组15(25.00)27(41.67)*18.97±6.3515.49±4.64*15(25.00)29(48.33)*5.52±0.763.94±0.57*χ2/t值0.1714.8490.2912.2460.1866.8061.16317.395P值0.6800.0280.7710.0270.6660.0090.2470.000
*P值<0.05与治疗前比较(χ2检验或配对t检验)
3 讨 论
随着人类社会的发展,碳水化合物食品在膳食中的比例陡然上升[3-5]。在国外进行的针对T2DM患者的膳食干预中,超过半数的研究采用低碳水化合物膳食[6-7],但在我国相关的研究尚少。低碳水化合物膳食是限制含可消化类碳水化合物高的食品(如面包、面条)或用含蛋白和脂类百分比高的食品(如肉类、禽类、贝类、蛋类、奶酪、坚果、植物籽实类)以及其他低碳水化合物的食品(如大多数拌色拉的蔬菜)进行代替的一种膳食,以降低受试者膳食中碳水化合物的含量[8]。在国外进行的针对T2DM患者的膳食干预荟萃分析中,低碳水化合物膳食对于欧美T2DM人群的体重控制、血糖控制以及血脂控制均有较为良好的效果。考虑到膳食干预的特殊性,大部分研究持续时间为6个月至1年。在低碳水化合物膳食具体的模式中各项研究不尽相同,低碳水化合物膳食干预可以细分成两类[9-11]:一类是阿特金斯饮食法(即干预第一阶段:为期2周,每日碳水化合物<20 g,其中不包括膳食纤维;第二阶段,逐渐增加碳水化合物摄入,最终尽量保持在50 g/d);另一类则是限定碳水化合物的日摄入量或者供能比(质量与供能比根据人群疾病及膳食情况拟定)。因过低的碳水化合物有可能导致T2DM患者的低血糖反应,故在实际应用于T2DM患者的低碳水化合物的膳食干预中,多采用第二类限定碳水化合物的日摄入量或供能比并保证碳水化合物的摄入量的安全范围下限[12]。已有研究显示低碳水化合物膳食干预对欧美国家的超重的T2DM患者的体重、血糖和血脂控制有积极作用,在许多研究中经过膳食干预的患者的体重、血糖(如FBP、HbA1c等)及血脂(如TG、TC、HDL-C、LDL-C等)代谢指标均得到改善[13]。但在我国相关的膳食干预研究还比较少。因此,在本研究中拟采用的膳食干预方案为限定碳水化合物摄入量的低碳水化合物膳食。考虑到我国居民的饮食习惯(碳水化合物所占供能比较高,脂类摄入较蛋白质类食物摄入多)的特点,本研究将碳水化合物的摄入限定值定为100 g/d,在膳食模式设计上适当提高了脂类的供能比,但增加的脂类将尽量以来源于植物的脂类为主,并且发现其对机体血糖控制明显优于普通膳食,对缓解胰岛素抵抗、控制血脂均有重要的临床价值,并且在控制BMI,腰围、DDS评分和ADQoL评分方面,明显优于普通膳食。
遗传的基因表达或细胞表现型变化的研究领域正在日益受到关注。已有研究显示膳食因素的改变会通过表观遗传途径改变基因启动子区域甲基化水平,进而影响基因表达水平对个体性状产生影响[14-15]。已有研究显示不同膳食模式的干预会改变人体脂肪组织DNA甲基化的水平[16]。在限制能量的膳食干预研究中发现不同个体对于膳食的减重效果存在较大的个体差异[17]。现有研究表明基因甲基化参与了炎症反应、氧化应激状态和胰岛素抵抗过程,参与肥胖和糖尿病的发生[18]。本研究结果显示,低碳水化合物膳食对机体leptin和TNF-α甲基化率较对照组更加明显,而血清leptin和TNF-α水平较对照组明显降低。高血糖和T2DM导致leptin基因和TNF-α基因甲基化,从而影响脂质和糖代谢紊乱,引起脂肪-胰岛素内分泌轴紊乱。本研究通过低碳水化合物膳食干预升高leptin基因甲基化率和降低leptin水平,从而改善机体脂质和糖代谢,减轻脂毒性,降低糖尿病及其并发症的发生率。TNF-α在糖尿病和肥胖发生发展过程中起到重要作用,脂肪堆积使脂肪组织释放大量的TNF-α,导致胰岛素信号通路受阻,引起T2DM和超重的发生。本研究通过增加机体TNF-α甲基化率和降低机体TNF-α水平,改变机体的胰岛素抵抗,从而降低糖尿病引起的痛苦和提高糖尿病患者的生存质量。
总之,低碳水化合物膳食干预对超重的T2DM疗效显著,可缓解机体糖和脂质代谢紊乱,这可能与影响leptin基因和TNF-α基因甲基化有关。
[1] 吴乃君,魏剑芬,金秀平,等.2型糖尿病患者血清同型半胱氨酸、脂联素、瘦素水平的变化及意义[J].河北医科大学学报,2014,35(4):388-391.
[2] 时美红,丁加伟.血清Apelin、Chemerin及Fetuin-A联合检测用于糖尿病肾病早期诊断的敏感度与特异度分析[J].河北医科大学学报,2018,39(4):454-458.
[3] Richards MP. A brief review of the archaeological evidence for Palaeolithic and Neolithic subsistence[J]. Eur J Clin Nutr,2002,56(12):16 p following 1262.
[4] Cordain L,Miller JB,Eaton SB,et al. Plant-animal subsistence ratios and macronutrient energy estimations in worldwide hunter-gatherer diets[J]. Am J Clin Nutr,2000,71(3):682-692.
[5] Schwingshackl L,Chaimani A,Hoffmann G,et al. A network meta-analysis on the comparative efficacy of different dietary approaches on glycaemic control in patients with type 2 diabetes mellitus[J]. Eur J Epidemiol,2018,33(2):157-170.
[6] Tieu J,Shepherd E,Middleton P,et al. Dietary advice interventions in pregnancy for preventing gestational diabetes mellitus[J]. Cochrane Database Syst Rev,2017,1:D006674.
[7] Centenaro A,Pedrollo EF,Nicoletto BB,et al. Different dietary patterns and new-onset diabetes mellitus after kidney transplantation:a cross-sectional study[J]. J Ren Nutr,2018,28(2):110-117.
[8] Saslow LR,Daubenmier JJ,Moskowitz JT,et al. Twelve-month outcomes of a randomized trial of a moderate-carbohydrate versus very low-carbohydrate diet in overweight adults with type 2 diabetes mellitus or prediabetes[J]. Nutr Diabetes,2017,7(12):304.
[9] Meng Y,Bai H,Wang S,et al. Efficacy of low carbohydrate diet for type 2 diabetes mellitus management:a systematic review and meta-analysis of randomized controlled trials[J]. Diabetes Res Clin Pract,2017,131:124-131.
[10] Bao W,Li S,Chavarro JE,et al. Low carbohydrate-diet scores and long-term risk of type 2 diabetes among women with a history of gestational diabetes mellitus:a prospective cohort study[J]. Diabetes Care,2016,39(1):43-49.
[11] Sato J,Kanazawa A,Hatae C,et al. One year follow-up after a randomized controlled trial of a 130 g/day low-carbohydrate diet in patients with type 2 diabetes mellitus and poor glycemic control[J]. PLoS One,2017,12(12):e0188892.
[12] Moreno-Castilla C,Hernandez M,Bergua M,et al. Low-carbohydrate diet for the treatment of gestational diabetes mellitus:a randomized controlled trial[J]. Diabetes Care,2013,36(8):2233-2238.
[13] Guldbrand H,Lindström T,Dizdar B,et al. Randomization to a low-carbohydrate diet advice improves health related quality of life compared with a low-fat diet at similar weight-loss in Type 2 diabetes mellitus[J]. Diabetes Res Clin Pract,2014,106(2):221-227.
[14] Yu Y,Mingjiao W,Yang X,et al. Association between DNA methylation of SORL1 5-flanking region and mild cognitive impairment in type 2 diabetes mellitus[J]. Ann Endocrinol(Paris),2016,77(6):625-632.
[15] Grdoviĉ N,Rajiĉ J,Petroviĉ SM,et al. Association of CXCL12 gene promoter methylation with periodontitis in patients with diabetes mellitus type 2[J]. Arch Oral Biol,2016,72:124-133.
[16] Alam F,Islam MA,Gan SH,et al. DNA methylation: an epigenetic insight into type 2 diabetes mellitus[J]. Curr Pharm Des,2016,22(28):4398-4419.
[17] Enquobahrie DA,Moore A,Muhie S,et al. Early pregnancy maternal blood dna methylation in repeat pregnancies and change in gestational diabetes mellitus status-a pilot study[J]. Reprod Sci,2015,22(7):904-910.
[18] Song AQ,Sun LR,Zhao YX,et al. Effect of insulin and metformin on methylation and glycolipid metabolism of peroxisome proliferator-activated receptor gamma coactivator-1A of rat offspring with gestational diabetes mellitus[J]. Asian Pac J Trop Med,2016,9(1):91-95.