卵巢癌是女性生殖系统常见的恶性肿瘤之一,是妇科恶性肿瘤最常见的死亡原因[1]。瘤体减灭术和以铂类为基础的联合化疗是目前卵巢癌的标准治疗方法[2-3]。手术和化疗的联合能使60%~80%肿瘤达到完全缓解,但仍有约60%的患者会出现复发,而复发的主要原因是铂类耐药,致使卵巢癌患者的总生存率仍然很低[4]。因此,寻找有效的抑制卵巢癌细胞耐药的方法具有重要意义。越来越多的证据显示,miRNA在包括乳腺癌在内的恶性肿瘤的肿瘤增殖、侵袭、转移及耐药中发挥着重要作用[5-7]。有研究表明,miR-141-3p与多种肿瘤的耐药及卵巢癌预后相关[5]。然而,miR-141-3p在卵巢癌顺铂耐药中的作用尚不明确。本研究探讨miR-141-3p在卵巢癌细胞对顺铂耐药中的作用及机制,旨在为进一步克服耐药寻找新思路。
1 材料与方法
1.1 细胞培养 A2780细胞株及DDP耐药A2780/DDP细胞株由本实验室长期保存。A2780/DDP为本实验室通过浓度梯度诱导的顺铂耐药A2780细胞株,使用前应用CCK8方法检测其耐药性,其DDP的IC50高于A2789细胞DDP的IC50至少10倍以上,如果耐药性下降,需重新诱导。2种细胞株均采用包含10%胎牛血清的RIPM 1640培养基培养,培养基中均加入1%的青霉素链霉素,并且进行支原体检测为阴性。细胞培养条件:温度为37 ℃,CO2浓度为5%。
1.2 仪器及试剂 实时荧光定量PCR仪ABI 7500 Fast(美国ABI公司);ECL化学发光仪(Vilber Lourmat 公司);NanoDrop核酸定量仪(Thermo公司);鼠抗β-actin多克隆抗体(Proteintech公司);兔抗PCNA单克隆抗体(Santa Cruz公司);RIPM 1640培养基(BI公司);Lipofectamine 2000细胞转染试剂(Invitrogen公司);胎牛血清(BI公司);CCK-8细胞增殖/毒性检测试剂盒(上海贝博生物)。
1.3 引物、模拟物、抑制物 has-miR-141-3p引物(miR-141-3p-F:GGC CTA ACA CTG TCT GGT AAA GA TG)、U6 引物(U6-F:GTG CTC GCT TCG GCA GCA CAT ATA C;U6-R:AAA TAT GGA ACG CTT CAC GAA TTT GC)由上海生工生物技术有限公司合成。has-miR-141-3p模拟物、has-miR-141-3p抑制物及相应阴性对照均购自上海吉玛公司。
1.4 方法
1.4.1 CCK-8法检测细胞增殖抑制率 将A2780细胞接种到96孔板中,每孔含有2×104 个细胞,用无血清RPMI 1640培养基稀释DDP,向每孔中加入不同浓度DDP,最终浓度为0,4,8,16,32,64,128 μmol/L,并用无血清RPMI 1640培养基最终定容至100 μL。空白组对照组加入100 μL含有2×104 个A2780细胞 RPMI 1640培养基悬液。首先用“1.4.2”项的方法对A2780细胞进行转染,转染6 h后换为无血清RPI1640培养基,加入不同浓度的DDP,每组设5个复孔,48 h后每孔加入10 μL CCK-8试剂,孵育2~3 h,Thermo酶标仪测定各孔在450 nm处的光密度(optical density,OD)值,然后计算细胞的增殖抑制率[细胞增殖抑制率(%)=1-(实验组OD450值-空白组OD450值)/(对照组OD450值-空白组OD450值)],每个实验重复3次。
1.4.2 miRNA模拟物及抑制物转染 A2780细胞株及DDP耐药A2780/DDP细胞株接种到6孔板中培养24 h,待细胞生长密度为60%~80%时使用Lipofectamine 2000对细胞转染。转染6 h后,弃去6孔板中的培养基,更换为新的无血清RPMI 1640培养基,继续放入37 ℃、5% CO2培养箱中培养24 h,随后收集细胞,提取RNA或蛋白质进行下一步试验。
1.4.3 miRNA提取和RT-qPCR 采用OMEGA miRNA Kit试剂盒,按照说明书提取细胞中miRNA。核酸定量仪检测RNA纯度和浓度,-20 ℃保存。按照Gene Copoeia公司All-in-OneTM miRNA First-Strand cDNA Synthesis Kit操作说明,取1~3 μg RNA建立20 μg逆转录体系合成cDNA。之后,采用Gene Copoeia公司miRNA qPCR Kit试剂盒和ABI 7500 Fast Real-time PCR扩增仪进行扩增。以β-actin为内参,采用△Ct(Ct目的-Ct内参)法进行相对定量分析,以2-△△Ct作为目的RNA的相对表达量。
1.4.4 Western blot分析 用预冷的1×PBS收集转染后的A2780细胞,RIPA裂解液进行裂解,并加入一定量的蛋白酶抑制剂抑制蛋白分解。4 ℃,8 000 r/min离心10 min收集上清,BCA法检测所收集蛋白质的浓度,取等质量的蛋白提取液,加入与5×loading buffer进行混合,煮沸5 min使蛋白变性。10% SDS-PAGE凝胶分离,之后半干转膜将蛋白印记至PVDF膜,放置在含1%BSA室温封闭2 h后, PCNA一抗孵育4 ℃过夜。次日,将 PVDF膜用TTBS洗膜5~6次洗去一抗,并将PVDF膜置入用适当TTBS稀释的化学发光二抗中,室温反应1 h,取出PVDF膜用TTBS适当洗脱。ELC化学发光法检测抗体特异结合条带。Quantity One图像分析软件对结果图像进行相对定量分析。
1.5 统计学方法 应用SPSS 13.0统计软件处理数据。计量资料比较采用两独立样本的t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 A2780细胞及A2780/DDP细胞中miR-141-3p的表达比较 与DDP敏感的A2780细胞相比,miR-141-3p在DDP耐药的A2780/DDP细胞株中表达显著增高,差异有统计学意义(P<0.05),见表1。
表1 A2780细胞及A2780/DDP细胞中miR-141-3p的表达比较
Table 1 Comparison of expression levels of miR-141-3p between A2780 and A2780/DDP![]()
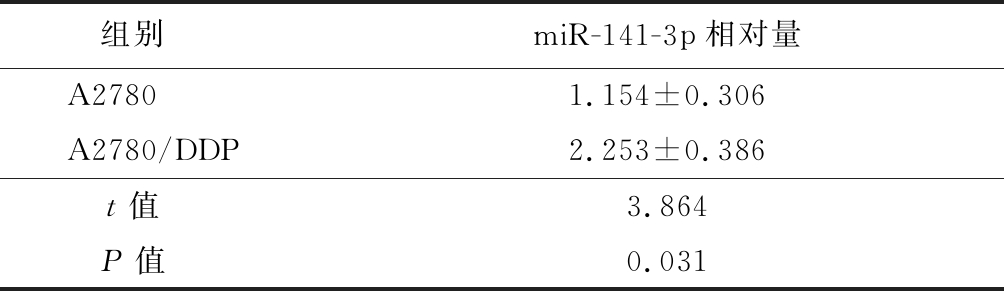
组别miR-141-3p相对量A27801.154±0.306A2780/DDP2.253±0.386t值3.864P值0.031
2.2 过表达miR-141-3p后A2780细胞对DDP的敏感性及耐药性比较 过表达miR-141-3p显著降低A2780细胞对DDP的敏感性,细胞向DDP耐药趋势发展。与转染对照模拟物相比,A2780细胞转染miR-141-3p模拟物可明显增加miR-141-3p表达(P<0.05),证明过表达成功;用不同浓度DDP处理上述2组细胞48 h,CCK-8方法检测细胞增殖率并计算转染组及对照组细胞对DDP的IC50,与对照组相比较,当DDP浓度度≥10 μmol/L后,过表达组细胞增值率开始高于阴性对照组,且过表达组IC50较阴性对照组有所增加(P<0.05);用 20 μmol/L DDP处理过表达组及对照组细胞,Western blot检测与增殖相关的蛋白PCNA的表达, A2780过表达miR-141-3p后明显增加PCNA蛋白表达(P<0.05)。以上结果表明A2780过表达miR-141-3p后,细胞对DDP的敏感性明显下降,A2780细胞向DDP耐药趋势发展。 见表2。
表2 A2780细胞转染miR-141-3p、对照模拟物后DDP的IC50及PCNA蛋白表达比较
Table 2 Comparison of IC50 of DDP and PCNA protein expression in A2780 cells transfected with miR-141-3p and control mimic![]()
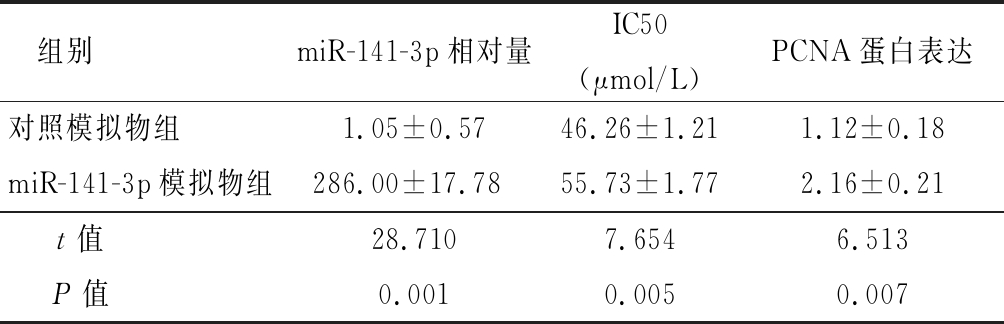
组别miR-141-3p相对量IC50(μmol/L)PCNA蛋白表达对照模拟物组1.05±0.5746.26±1.211.12±0.18miR-141-3p模拟物组286.00±17.7855.73±1.772.16±0.21t值28.7107.6546.513P值0.0010.0050.007
2.3 敲低miR-141-3p后A2780细胞对DDP的敏感性及耐药性比较 下调miR-141-3p表达可增加A2780/DDP细胞对DDP敏感性,逆转DDP耐药趋势。合成miR-141-3p抑制物并转染A2780/DDP细胞,用RT-qPCR验证敲低效率。与转染阴性对照相比,A2780/DDP细胞转染miR-141-3p抑制物可明显下调A2780/DDP细胞中miR-141-3p表达,差异有统计学意义(P<0.05);与对照组相比,当DDP浓度≥20 μmol/L后,敲低组细胞增殖率开始低于阴性对照组,敲低组细胞对DDP的IC50显著低于阴性对照组(P<0.05);用20 μmol/L DDP处理敲低组及对照组细胞,Western blot法检测与增殖相关的蛋白PCNA的表达发现,A2780/DDP敲低miR-141-3p后明显下调PCNA蛋白表达(P<0.05)。以上结果表明A2780/DDP敲低miR-141-3p后,细胞对DDP的敏感性增加,A2780/DDP 的DDP耐药趋势有所逆转。见表3。
表3 A2780细胞转染miR-141-3p、对照抑制物后DDP的IC50及PCNA蛋白表达比较
Table 3 Comparison of IC50 of DDP and PCNA protein expression in A2780 cells transfected with miR-141-3p and control inhibitor ![]()
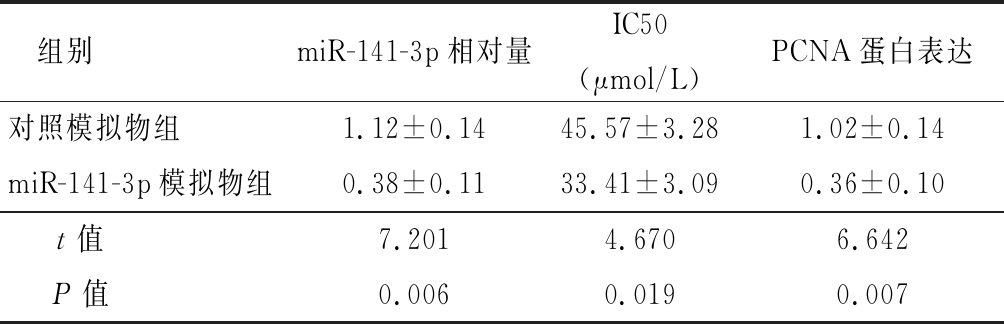
组别miR-141-3p相对量IC50(μmol/L)PCNA蛋白表达对照模拟物组1.12±0.1445.57±3.281.02±0.14miR-141-3p模拟物组0.38±0.1133.41±3.090.36±0.10t值7.2014.6706.642P值0.0060.0190.007
3 讨 论
卵巢癌是最致命的妇科恶性肿瘤,通常被称为“沉默杀手”,起病隐匿,大多数患者就诊时癌症已处于晚期并可能伴有广泛转移[6]。目前,以铂类为基础的联合化疗方案仍然是卵巢癌患者不可避免的治疗手段之一[7]。除了联合用药,目前也在开发研究不同的给药方式,以提高铂类药物的作用效果。Ramezani等[8]利用生物合成银纳米粒子包裹铂类药物处理卵巢癌细胞后,发现该给药方式通过活化p53途径提高细胞对顺铂的敏感性。卵巢癌细胞出现的耐药行为是造成临床化疗失败的主要原因[9]。铂类耐药相关的分子机制仍不清楚,可能与药物外排增加、凋亡蛋白减少、增殖相关蛋白增加、异常通路激活及基因的表达调控密切相关。本研究中前期使用的A2780/DDP细胞为本实验室通过浓度梯度诱导的顺铂耐药细胞株,对照细胞为未经过顺铂处理过的细胞。
miRNA通过与靶基因的3′端非编码序列结合,抑制基因的转录或促进mRNA的降解等发挥作用。大量研究表明,miRNA在卵巢癌的基因表达调控、细胞分化及疾病进展等过程中发挥重要作用[7]。Wei等[10]研究发现,miR-219-5p在上皮性卵巢癌中的肿瘤抑制作用,其通过下调Twist/Wnt/β-连环蛋白信号通路抑制细胞增殖、迁移和侵袭。miR-126-3p通过靶向作用于PLXNB2基因,体外减少卵巢癌细胞增殖并抑制其迁移,同时过表达miR-126-3p和敲低PLXNB2对细胞生长活力,细胞集落和细胞侵袭具有协同作用[11]。Li等[12]在研究多囊卵巢综合征(polycystic ovary syndrome,PCOS)时,发现大鼠PCOS模型的卵巢中miRNA-141-3p表达显著减少,miRNA-141-3p靶向DAPK1并抑制大鼠卵巢颗粒细胞的凋亡。然而,miR-141-3p在卵巢癌中的作用尚不明确。本研究采用RT-qPCR法检测miR-141-3p在卵巢癌A2780及A2780/DDP细胞中的表达,发现通过DDP梯度诱导成为顺铂耐药细胞株后,miR-141-3p的表达显著提高,预示着miR-141-3p可能与顺铂耐药有关;在A2780细胞中过表达miR-141-3p后,与对照组RNA相比,过表达miR-141-3p的A2780细胞对DDP的敏感性显著降低,细胞对DDP更耐受,表明高表达miR-141-3p促使细胞向耐药细胞趋势发展。然而,miR-141-3p是如何调节A2780的耐药性及其作用机制仍然有待研究。
越来越多的证据证实,miRNA在肿瘤耐药中也发挥着关键的调控作用。而癌症干细胞(cancer stem cells,CSC)在卵巢癌细胞转移和耐药性的发展中起重要作用。Srivastava等[13]在研究卵巢癌干细胞时发现,miR-328-3p在卵巢CSC中显著上调,高表达的miR-328通过直接靶向DNA损伤结合蛋白2维持CSC特性,通过抑制miR-328-3p损害CSC功能并防止卵巢癌转移。在上皮性卵巢癌缺氧肿瘤微环境的背景下,源自巨噬细胞的外来体miRNA如何促进耐药性的发展仍然知之甚少。Zhu等[14]研究发现,来自巨噬细胞的外泌体miR-223在体内和体外通过靶向PTEN-PI3K/AKT途径促进上皮性卵巢癌细胞的耐药性。miR-141-3p是miR-200家族的重要成员,由于其靶向调控的基因差异,在多种肿瘤细胞耐药性发挥重要调控作用。Liu等[15]在研究miR-200家族耐药性时发现,miR-200b和miR-200c介导的DNMT调节在细胞对顺铂的反应中起关键作用。Song等[16]通过基因芯片研究乳腺癌耐药性时发现,miR-141-3p在耐药细胞系中表达下调,CDK8可通过TGF-β调节SMAD2/SMAD3的磷酸化水平,miR-141-3p可通过抑制CDK8恢复乳腺癌细胞对曲妥珠单抗的敏感性。然而,miR-141-3p如何影响卵巢癌对顺铂的耐药性尚不清楚。本研究发现顺铂耐药A2780/DDP细胞中miR-141-3p的表达显著高于正常的A2780,而且过表达miR-141-3p显著降低A2780细胞对DDP的敏感性,细胞向DDP耐药趋势发展;而过表达miR-141-3p组IC50较阴性对照组显著增加;A2780过表达miR-141-3p后明显增加PCNA蛋白表达,预示着过表达miR-141-3p促进细胞增殖,抑制凋亡。本研究进一步发现,下调miR-141-3p表达可增加A2780/DDP细胞对DDP敏感性,逆转DDP耐药趋势;但当DDP浓度≥20 μmol/L后,敲低组细胞增殖率开始低于阴性对照组,细胞对DDP的IC50显著低于阴性对照组,且显著下调PCNA蛋白表达。然而,miR-141-3p在A2780细胞中对顺铂的耐药性及其作用机制仍不清楚,下一步笔者将深入研究miR-141-3p如何参与细胞对顺铂的耐药性。
本研究首次证明miR-141-3p高表达促进卵巢癌细胞的耐药,miR-141-3p可能成为临床预测卵巢癌DDP耐药的生物学标记及克服耐药的新靶点。
[1] Peng Y,Lin J,Guan J,et al. Ovarian collision tumors: imaging findings,pathological characteristics,diagnosis,and differential diagnosis[J]. Abdom Radiol(NY),2018,43(8):2156-2168.
[2] 刘继红,朱笕青.卵巢恶性肿瘤诊断与治疗指南(第四版)[J]. 中国实用妇科与产科杂志,2018,34(7):739-749.
[3] Zangeneh F,Vazirizadeh A,Mirshamsi MR,et al. Induction of apoptosis by extract of persian gulf marine mollusk,turbo coronatus through the ros-mediated mitochondrial targeting on human epithelial ovarian cancer cells[J]. Iran J Pharm Res,2019,18(1):263-274.
[4] Izvcka N,Sterzynska K,Januchowski R,et al. Semaphorin 3A (SEMA3A),protocadherin 9 (PCdh9),and S100 calcium binding protein A3 (S100A3) as potential biomarkers of carcinogenesis and chemoresistance of different neoplasms,including ovarian cancer-review of literature [J]. Ginekol Pol,2019,90(4):223-227.
[5] Wang X,Kong D,Wang C,et al. Circulating microRNAs as novel potential diagnostic biomarkers for ovarian cancer: a systematic review and updated meta-analysis[J]. J Ovarian Res,2019,12(1):24.
[6] Sokolova E,Kutova O,Grishina A,et al. Penetration efficiency of antitumor agents in ovarian cancer spheroids: the case of recombinant targeted toxin darpin-lope and the chemotherapy drug,doxorubicin[J]. Pharmaceutics,2019,11(5).pii:E219.
[7] Wang X,Ivan M,Hawkins SM. The role of MicroRNA molecules and MicroRNA-regulating machinery in the pathogenesis and progression of epithelial ovarian cancer [J]. Gynecol Oncol,2017,147(2):481-487.
[8] Ramezani T,Nabiuni M,Baharara J,et al. Sensitization of resistance ovarian cancer cells to cisplatin by biogenic synthesized silver nanoparticles through p53 activation[J]. Iran J Pharm Res,2019,18(1):222-231.
[9] Mukherjee A,Huynh V,Gaines K,et al. Targeting the high mobility group box 3 protein sensitizes chemoresistant ovarian cancer cells to cisplatin[J]. Cancer Res,2019,79(13):3185-3191.
[10] Wei C,Zhang X,He S,et al. MicroRNA-219-5p inhibits the proliferation,migration,and invasion of epithelial ovarian cancer cells by targeting the Twist/Wnt/β-catenin signaling pathway[J]. Gene,2017,637:25-32.
[11] Guixian X,Yan C. MiR-126-3p inhibits ovarian cancer proliferation and invasion via targeting PLXNB2[J]. Reprod Biol,2018,18(3):218-224.
[12] Li D,Xu D,Xu Y,et al. MicroRNA-141-3p targets DAPK1 and inhibits poptosis in rat ovarian granulosa cells [J]. Cell Biochem Funct,2017,35(4):197-201.
[13] Srivastava AK,Banerjee A,Cui T,et al. Inhibition of miR-328-3p impairs cancer stem cell function and prevents metastasis in ovarian cancer [J]. Cancer Res,2019,79(9):2314-2326.
[14] Zhu X,Shen H,Yin X,et al. Macrophages derived exosomes deliver miR-223 to epithelial ovarian cancer cells to elicit a chemoresistant phenotype[J]. J Exp Clin Cancer Res,2019,38(1):81.
[15] Liu J,Zhang X,Huang Y,et al. miR-200b and miR-200c co-contribute to the cisplatin sensitivity of ovarian cancer cells by targeting DNA methyltransferases[J]. Oncol Lett,2019,17(2):1453-1460.
[16] Song W,Wu S,Wu Q,et al. The microRNA-141-3p/CDK8 pathway regulates the chemosensitivity of breast cancer cells to trastuzumab[J]. J Cell Biochem,2019,120(8):14095-14106.