血管瘤是常见的婴幼儿良性肿瘤,发病率为1%~10%[1]。腮腺区是婴幼儿毛细血管瘤常见的发病区域,若治疗不及时或不当,随着瘤体增大患儿可出现消退困难及溃疡等问题,造成美容缺陷,间接影响婴幼儿心理健康[2]。目前关于腮腺区血管瘤的发病机制尚未明确,血管内皮生长因子(vascular endothelial growth factor,VEGF)是极为重要的促血管生成因子,已证实其与毛细血管瘤的发病密切相关[3]。环氧化酶2(cyclooxygenase 2,COX-2)、结缔组织生长因子(connective tissue growth factor,CTGF)是目前发现较新的细胞因子,已证实它们有很强的促进血管内皮细胞转化增殖的能力,与许多肿瘤的发生、浸润及转移有关[4-5],但其在毛细血管瘤组织中的表达情况及其与该疾病的关系国内外尚未见有关报道。腮腺区血管瘤的常见治疗方法包括口服、药物注射、外敷及激光治疗等,阿替洛尔是临床常用的治疗婴幼儿血管瘤的药物,大量研究已证实其治疗婴幼儿血管瘤的有效性及安全性[6]。1%聚多卡醇注射液是国际公认的、使用最广泛的血管硬化液,其在欧美国家已应用多年,但在2015年才进入中国市场。本研究采用聚多卡醇联合阿替洛尔治疗婴幼儿腮腺区血管瘤,旨在探讨其疗效及对COX-2、CTGF、VEGF的影响。
1 资料与方法
1.1 一般资料 选取2016年9月—2018年9月河北省人民医院收治的腮腺区血管瘤患儿76例作为研究对象,年龄2周~12个月,平均(3.4±0.5)个月;男性30例,女性46例;体质量范围为3.4~12 kg,平均(6.4±0.5) kg。临床表现:腮腺部位表现为鲜红色斑块或肿块,可触及基底肿块,大小为0.5 cm×0.5 cm~1.5 cm×2.0 cm。患儿皮肤温度正常,检查无明显疼痛感及触痛感,瘤体部位试压后鲜红色消退,减压后恢复,无合并血管震颤、动脉搏动感。纳入标准[7]:①根据患儿病史、彩色超声及MRI、临床表现及体征等确诊为腮腺区血管瘤;②初次治疗,既往无其他任何治疗;③无对聚多卡醇及阿替洛尔过敏的患儿;④患儿家属均知情同意。排除标准:①血管畸形者;②合并肺炎、哮喘、心功能衰竭、窦性心动过缓等重要脏器疾病及器质性疾病者。采用随机数字表法将所有患儿分为对照组和观察组各38例。对照组男性16例,女性22例;年龄2周~11个月,平均(3.3±0.4)个月;平均体质量为(6.3±0.4) kg。观察组男性14例,女性24例;年龄3周~12个月,平均(3.6±0.6)个月;平均体质量为(6.5±0.3) kg。2组患儿一般资料比较差异无统计学意义(P>0.05),具有可比性。
本研究经医院医学伦理委员会审核批准通过。
1.2 方法 对照组患儿口服阿替洛尔(江苏黄河药业股份有限公司,国药准字H32024192 ),第1天用药剂量为1 mg·kg-1·d-1,2次/d,服用2天后增至1.5 mg·kg-1·d-1,2次/d,均为早晚8点顿服。住院观察约7 d,无异常者可办理出院并继续口服阿替洛尔,按照患儿体质量每增长1 kg,药物剂量增加1 mg/d,反之则减少的原则进行剂量调整。服药期间规律进行各项常规检查,同时采用彩色超声观测患儿病灶部位颜色、大小、质地变化情况,颜色逐渐变暗、病灶直径变小可继续按规定剂量服药,反之及时入院治疗。所有患儿至少服药6个月,而后根据病灶情况延长3~6个月的治疗,直到病灶直径无增长。若治疗期间出现心率失常、支气管炎及肺炎等情况应及时停止服药,待恢复病情后继续服药。观察组患儿在对照组基础上给予局部注射1%聚多卡醇(德国Hameln pharmaceuticals GmbH,批准文号:H20140116),根据血管瘤的大小及部位确定用药剂量,通常为0.1~0.2 mL,密切观察瘤体颜色变化注射硬化剂,通常以瘤体变苍白为宜。注射后3~7 d会出现注射部位局部红肿状况,无需处理。2周后进行复诊,进行瘤体颜色、大小及质地评估,决定是否进行下一个疗程的治疗。注射结束后对针孔部位用消毒棉球或面前进行按压止血,以避免药液外渗。若出现瘤体破溃,则采用无菌棉签止血、碘伏消毒、涂百多邦软膏,且保持伤口干燥。若出现结痂,则待痂皮自然脱落,观察瘤体瘤体颜色、大小及质地再行注射治疗。
1.3 观察指标 ①比较2组临床疗效;②比较2组患儿治疗前及治疗6个月后血清COX-2、CTGF阳性率及VEGF水平;③比较2组患儿治疗前及治疗6个月后免疫功能指标[免疫球蛋白A(immunoglobulin A,IgA)、免疫球蛋白G(immunoglobulin G,IgG)及免疫球蛋白M(immunoglobulin M,IgM)]水平;④比较2组患儿治疗期间不良反应发生情况:低热、腹泻、心动过缓及瘤体溃疡。
1.4 检测方法及疗效标准 检测方法:分别于治疗前及治疗6个月后空腹采集患者10 mL肘静脉血,室温静置半小时后采用1 500 r/min离心10 min取上层血清送检。采用全自动生化分析仪检测2组患儿血清VEGF水平,试剂盒购自上海联硕生物科技有限公司。采用免疫组织化学SP染色法检测2组患儿COX-2、CTGF表达,获取患儿腮腺区血管瘤组织标本制备厚度为4 μm的切片,操作步骤严格按照SABC免疫组化试剂盒(北京百奥莱博科技有限公司)说明书进行。根据细胞胞浆中出现的棕黄色颗粒判断为阳性。参考Achauer文献标准[8]评估患儿临床疗效:①显效,患儿瘤体缩小面积超过75%,皮肤色泽有轻度色素沉着或接近正常,无功能障碍;②有效,患儿瘤体缩小面积范围为51%~75%;好转,患儿腮腺区血管瘤瘤体缩小范围为26%~50%;④无效,患儿瘤体缩小范围低于25%,或增大。总有效率=显效率+有效率+好转率。
1.5 统计学方法 应用SPSS22.0统计学软件分析数据。计量资料比较采用独立样本的t检验和配对t检验。计数资料采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 2组临床疗效比较 2组患儿平均服用阿替洛尔6个月,观察组患儿平均注射1%聚多卡醇3个疗程。76例患儿均完成治疗,随访12个月无失访。观察组和观察组总有效率显著高于对照组,差异有统计学意义(P<0.05)。见表1。
表1 2组临床疗效比较
Table 1 Comparison of clinical efficacy between two groups (n=38,例数,%)
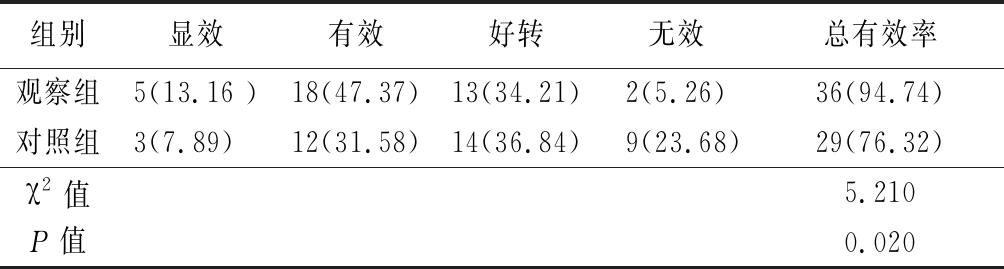
组别显效有效好转无效总有效率观察组5(13.16 )18(47.37)13(34.21)2(5.26)36(94.74)对照组3(7.89) 12(31.58)14(36.84)9(23.68)29(76.32)χ2值5.210P值0.020
2.2 2组治疗前后患儿COX-2、CTGF阳性率、VEGF比较 治疗前2组患儿COX-2阳性率、CTGF阳性率及VEGF水平差异无统计学意义(P>0.05);治疗后,2组COX-2阳性率、CTGF阳性率、VEGF水平低于治疗前,观察组COX-2阳性率、CTGF阳性率及VEGF水平显著低于对照组(P<0.05)。见表2。
表2 2组治疗前后患儿COX-2、CTGF阳性率、VEGF水平的比较
Table 2 Comparison of COX2, CTGF and VEGF expression in children before and after treatment (n=38)
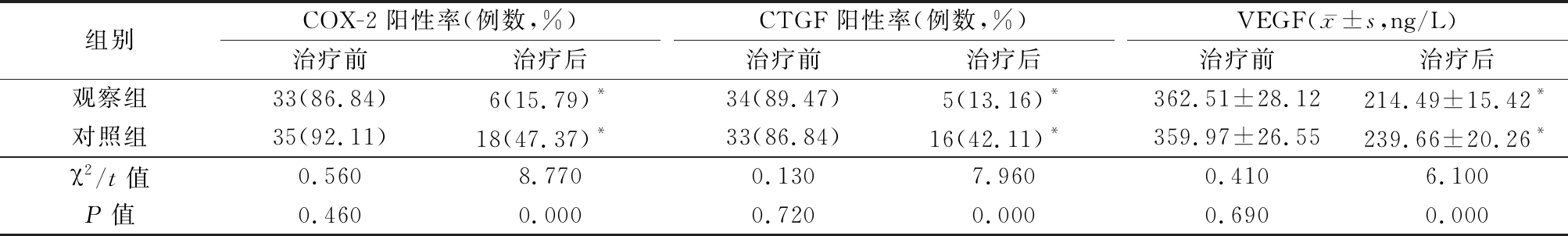
组别COX-2阳性率(例数,%)治疗前治疗后CTGF阳性率(例数,%)治疗前治疗后VEGF(x-±s,ng/L)治疗前治疗后观察组33(86.84)6(15.79)*34(89.47)5(13.16)*362.51±28.12214.49±15.42*对照组35(92.11)18(47.37)*33(86.84)16(42.11)*359.97±26.55239.66±20.26*χ2/t值0.5608.7700.1307.9600.4106.100P值0.4600.0000.7200.0000.6900.000
*P值<0.05与治疗前比较(χ2检验或配对t检验)
2.3 2组治疗前后患儿免疫功能比较 治疗前,2组患儿IgA、IgG及IgM比较差异无统计学意义(P>0.05),治疗后,2组IgA、IgG、IgM水平显著高于治疗前,观察组IgA、IgG及IgM水平均显著高于对照组(P<0.05),见表3。
2.4 2组不良反应发生情况比较 治疗期间,观察组不良反应发生率明低于对照组(P<0.05)。见表4。
表3 2组治疗前后患儿免疫功能比较
Table 3 Comparison of immune function before and after treatment between the two groups![]()
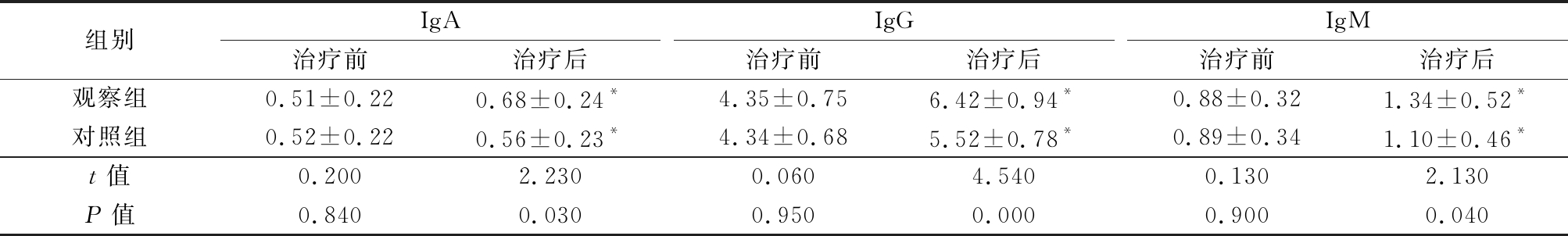
组别IgA治疗前治疗后IgG治疗前治疗后IgM治疗前治疗后观察组0.51±0.220.68±0.24*4.35±0.756.42±0.94*0.88±0.321.34±0.52*对照组0.52±0.220.56±0.23*4.34±0.685.52±0.78*0.89±0.341.10±0.46*t值0.2002.2300.0604.5400.1302.130P值0.8400.0300.9500.0000.9000.040
*P值<0.05与治疗前比较(配对t检验)
表4 2组不良反应发生率比较
Table 4 Comparison of adverse reactions between the two groups (n=38,例数,%)
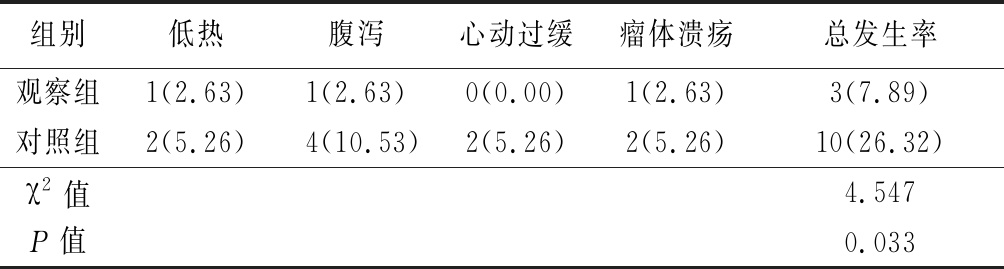
组别低热腹泻心动过缓瘤体溃疡总发生率观察组1(2.63)1(2.63)0(0.00)1(2.63)3(7.89)对照组2(5.26)4(10.53)2(5.26)2(5.26)10(26.32)χ2值4.547P值0.033
3 讨 论
皮肤血管瘤是一种主要特征为毛细血管内皮细胞过度增生的良性肿瘤,分为增生期、稳定期和消退期。临床经验表明,婴幼儿血管瘤可自行消退,但部分患儿若不采取积极治疗瘤体可快速增长引发出血、溃烂及瘤体感染等,严重者可威胁生命[9]。婴幼儿腮腺区血管瘤若瘤体巨大,延伸至颈部,对患儿颈部动脉和静脉、气管造成压迫,从而引起呼吸困难,应早期、积极治疗。传统治疗血管瘤的方法主要有放射治疗、手术切除、β受体阻滞剂及糖皮质激素等,但各存在局限性,手术难以彻底切除腮腺区的血管瘤,且术中容易造成面神经损伤而引起面瘫,手术导致局部组织破坏变形及切口瘢痕形成造成美容缺陷[10]。糖皮质激素是治疗婴幼儿血管瘤的一线治疗方案,相关研究报道其仅对1/3左右的婴幼儿具有确切的疗效[11]。β受体阻滞剂如普萘洛尔,通过以下机制发挥治疗血管瘤的作用:诱导毛细血管收缩、抑制血管生成、诱导血管内皮细胞凋亡等。但普萘洛尔存在低血压、低血糖、支气管痉挛、胃肠道不适及心动过缓等不良反应,因此寻找耐受性更好,不良反应更轻的药物刻不容缓[12]。
阿替洛尔是一种选择性β受体阻滞剂,其对β2受体不具备阻断作用,从而支气管不良反应得以降低,低血糖出现的风险更低,对糖酵解、糖元合成及脂代谢等能量代谢的影响较小[13]。此外,阿替洛尔不通过血脑屏障,相较于普萘洛尔对睡眠的影响更轻。吴晓初等[14]观察组采用阿替洛尔治疗婴儿血管瘤,与对照组采用普萘洛尔治疗,结果显示观察组患儿总有效率(75.6%)显著高于对照组(70%)。聚多卡醇注射液于2010年3月30日被美国食品药品管理局批准用于小型静脉异常或静脉曲张的治疗,其作用机制为损伤血管内皮细胞、形成血栓、阻塞血管以达到止血的目的[15],具有血管内注射时无痛,过敏反应少见,不产生溶血现象,因而发生色素沉着的概率较小等优点。刘珍银等[16]采用1%聚多卡醇局部注射142例婴幼儿血管瘤,结果显示47.9%患儿达到Ⅳ级疗效,未见严重并发症。以上研究证实阿替洛尔和聚多卡醇治疗婴幼儿血管瘤的优越性。本研究联合二者治疗婴幼儿腮腺区血管瘤,结果显示,观察组总有效率显著高于对照组。提示阿替洛尔联合聚多卡醇治疗婴幼儿腮腺区血管瘤具有良好的效果。
COX-2是一种诱导型酶,其仅在促分裂剂如细胞因子、白细胞介素1、内毒素、癌基因及肿瘤促进剂等刺激下,于某些细胞内迅速产生,且密切参与肿瘤血管形成的过程。目前部分研究一般认为COX-2在乳腺癌、食管癌、胃癌、胰腺癌、前列腺癌、非小细胞肺癌等肿瘤组织呈高表达[17]。此外大量基础性研究证实COX-2参与肿瘤的发生发展、淋巴管和肿瘤血管的新生[18]。周凯等[19]研究证实COX-2在婴幼儿血管瘤组织呈高表达,与婴幼儿血管瘤的发生发展密切相关。CTGF是一种含半胱氨酸的分泌肽,具有促进细胞增殖及迁移、血管生成的作用。目前研究表明[20],CTGF表达水平在不同组织中具有较大差异,乳腺组织高水平CTGF表达能够促进乳腺癌恶性胶质瘤的骨转移。而高水平CTGF对鳞状细胞癌的肿瘤细胞生长具有抑制作用。VEGF是一种特异性生长因子,具有促进内皮细胞有丝分裂的作用,且不作用于其他细胞。VEGF在缺血缺氧、肿瘤等情况下呈高表达,低表达VEGF会导致血管退化、血管腔闭合。本研究结果显示,治疗后观察组COX-2、CTGF阳性率及VEGF水平显著低于对照组,提示阿替洛尔联合聚多卡醇可有效抑制腮腺区血管患儿COX-2、CTGF及VEGF表达。IgA、IgG及IgM水平是反映机体免疫功能的常用指标。本研究结果显示,治疗后观察组IgA、IgG及IgM水平均显著高于对照组,提示阿替洛尔联合聚多卡醇可有效提高腮腺区血管患儿免疫功能。另外,治疗期间观察组不良反应发生率显著低于对照组,提示阿替洛尔联合聚多卡醇治疗婴幼儿腮腺区血管瘤安全性可靠。
综上所述,阿替洛尔联合聚多卡醇治疗婴幼儿腮腺区血管瘤具有良好的效果,且安全性高,具有抑制COX-2、CTGF及VEGF表达的作用。
[1] 李燕,张瑞丽.异甘草素对小儿血管瘤内皮细胞生物学特性及PI3K/AKT信号通路的影响[J].郑州大学学报(医学版),2019,54(1):24-28.
[2] 张文显,杨伊帆,薛磊,等.脉冲染料激光治疗新生儿期婴幼儿血管瘤的效果观察[J].河北医科大学学报,2017,38(7):786-788.
[3] 罗亚楠,黄远红,冯雷,等.VEGF和DLL4在婴幼儿血管瘤组织中的表达及相关性[J].中国皮肤性病学杂志,2016,30(3):225-227.
[4] 成志勇,付建珠,徐倩,等.PTEN、VEGF、COX-2与JAK2V617F突变阳性骨髓增殖性肿瘤血管新生[J].中国病理生理杂志,2016,32(5):938-942.
[5] 胡博杰,何燕华,崔伟娜,等.结缔组织生长因子重组干扰载体慢病毒颗粒的构建及其对视网膜血管内皮细胞内源性结缔组织生长因子表达的抑制作用[J].中华眼底病杂志,2018,34(6):580.
[6] 王冠杰,赵娅娟,李东繁,等.阿替洛尔与普萘洛尔治疗婴儿血管瘤的疗效比较[J].安徽医药,2016,20(3):570-571.
[7] 张源方,孙斌,雷红召,等.尿素联合普萘洛尔治疗婴幼儿腮腺区血管瘤疗效观察[J].中华实用诊断与治疗杂志,2016,30(2):190-192.
[8] 唐玉娟,陈少全,张再重,等.外涂普萘洛尔凝胶对浅表型增殖期婴幼儿血管瘤患者血浆VEGF、bFGF和MMP-9的影响[J].中华整形外科杂志,2015,31(4):268-273.
[9] Menapace D,Mitkov M,Towbin R,et al. The changing face of complicated infantile hemangioma treatment[J]. Pediatr Radiol,2016,46(11):1494-1506.
[10] Harter N,Mancini AJ. Diagnosis and management of infantile hemangiomas in the neonate[J]. Pediatr Clin North Am,2019,66(2):437-459.
[11] Shao RZ,Zhao DH, Li J. Treatment of infantile hemangioma by intralesional injection of propranolol combined with compound betamethasone.[J]. Eur Rev Med Pharmacol Sci,2016,20(4):751.
[12] 赵志国,赵扬,林枫,等.口服普萘洛尔治疗婴幼儿血管瘤的疗效评价[J].口腔医学,2016,36(1):50-53.
[13] 孙龙龙,孙斌,马玉春,等.普萘洛尔与阿替洛尔治疗增殖期婴幼儿血管瘤的临床疗效及安全性对比[J].现代生物医学进展,2018,16(1):108-112.
[14] 吴晓初,吉毅,王琦,等.普萘洛尔与阿替洛尔治疗婴儿血管瘤的比较研究[J].中华皮肤科杂志,2016,49(10):683.
[15] Moritz RKC,Reichschupke S,Altmeyer P,et al. Polidocanol foam sclerotherapy of persisting postoperative seromas after varicose vein surgery:a series of six cases[J]. Phlebology,2013,28(7):341-346.
[16] 刘珍银,夏杰军,徐文婵.1%聚多卡醇局部注射治疗普通婴幼儿血管瘤疗效观察[J].现代医院,2017,28(3):390-392.
[17] Gulyas M,Mattsson JSM,Lindgren A,et al. COX-2 expression and effects of celecoxib in addition to standard chemotherapy in advanced non-small cell lung cancer[J]. Acta Oncologica,2018,57(2):244-250.
[18] Simonsson M,Bjõrner S,Markkula A,et al. The prognostic impact of COX-2 expression in breast cancer depends on oral contraceptive history,preoperative NSAID use,and tumor size[J]. Int J Cancer,2017,140(1):163-175.
[19] 周凯,徐建中,杨向东,等.环氧化酶-2在婴幼儿血管瘤中的表达[J].中华全科医学,2014,12(7):1032-1034.
[20] 彭浩,宋立伟,周正,等.乳腺癌患者血清CTGF、Six1水平观察[J].山东医药,2016,56(23):27-30.