慢性牙周炎是牙周致病菌及其产物感染牙周组织引起牙槽骨破坏所致的慢性炎症疾病,发病率高达65%以上[1]。该病病程长,病原微生物介导的宿主炎症反应和免疫反应是致其进展的重要原因,因此,临床治疗以抗生素控制炎症反应为主。随着牙周病学研究的深入,局部用药逐渐替代了口服广谱抗生素治疗[2],避免了长期口服抗生素引起的不良反应。盐酸米诺环素是四环素类药物,是牙周炎局部用药制剂,活性强、易渗透、疗效长;康复新液是具有养阴生肌、通力活血的中成药,二者均具有杀菌效果,联用能缓解炎症反应、改善症状,提高疗效[3]。程序性细胞死亡1(programmed death-1,PD-1)/程序性细胞死亡配体1(programmed death-ligand 1,PD-L1)是B7-CD28 家族成员,通过抑制免疫T细胞的活化增殖和细胞因子分泌来负性调控免疫应答,是一对负性协同刺激分子,与感染密切相关[4]。据报道,PD-1/PD-L1信号通路可能是牙周炎治疗的新靶点。本研究观察米诺环素联合康复新液对慢性牙周炎疗效及血清PD-1、PD-L1表达的影响,效果良好。现报告如下。
1 资料与方法
1.1 一般资料 选择2016年9月—2017年12月西南医科大学附属口腔医院牙周黏膜科收治的牙周炎患者192例,随机分为观察组和对照组各96例,观察组男性49例,女性47例,年龄35~65岁,平均(50.2±4.3)岁,病程(1.5±0.9)年,采用米诺环素联合康复新液治疗;对照组男性51例,女性45例,年龄35~65岁,平均(50.9±4.8)岁,病程(1.4±0.9)年,采用米诺环素治疗。2组性别、年龄、病程等基线资料差异无统计学意义(P>0.05),具有可比性。
本研究获得医院伦理委员会审批批准。
1.2 纳入标准和排除标准 纳入标准: ①符合《口腔科疾病临床诊断与治疗方案》[5]中慢性牙周炎诊断标准;②知情同意;③近1个月未服用抗生素;④近1年未进行牙周系统治疗;⑤近年未进行牙齿矫正。 排除标准:①合并高血压、糖尿病者;②合并精神性疾病者;③非炎症诱导牙周炎;④对药物过敏者;⑤合并其他慢性炎症;⑥未成年、哺乳期妇女等特殊人群。
1.3 方法 所有患者入院后进行常规治疗,包括牙龈上洁治术和牙龈下刮治术,术后采用3%双氧水冲洗牙周局部,并在牙周袋中注入盐酸米诺软膏(规格:0.5 g/支,批号:C1420057334,厂家:日本新时代株式会社),1次/周。观察组在此基础上含漱10 mL康复新液(规格:100 mL,批号:C1430098125,厂家:湖南科伦制药有限公司)5 min, 4次/d,每次含漱时间为每日早晨8:00~9:00、12:00~13:00、16:00~17:00、20:00~21:00, 疗程均为4周。术后对患者进行健康教育,包括疾病发病原因、处理方法、术后注意事项等。疗程结束后,检测症状相关指标(菌斑指数、牙周探诊深度和牙龈出血指数);治疗前后,取空腹肘静脉血,供炎症因子、血清PD-1、PD-L1水平检测使用。
1.4 评价指标 ①疗效评价:依据文献标准[6]评估疗效,分为痊愈(牙齿无松动、临床症状消失)、显效(牙齿松动由Ⅱ度转Ⅰ度、红肿消失、无炎性分泌物、临床症状减轻)、好转(牙齿松动好转、红肿减轻、炎性分泌物减少、临床症状改善)和无效(症状无改善或加重),计算总有效率=(痊愈+显效+好转)/总例数100%。 ②症状相关指标:治疗疗程结束后次日,测定菌斑指数、牙周探诊深度和牙龈出血指数。③炎症因子:治疗前后取空腹肘静脉血,3 500 r/min离心10 min,取上层血清,采用酶联免疫吸附测定法检测超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)、白细胞介素8(interleukin-8,IL-8)、白细胞介素10(interleukin-10,IL-10)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、干扰素γ(interferon-γ,IFN-γ)水平,试剂盒购自于晶美生物工程有限公司,具体操作参照说明书进行。④血清PD-1、PD-L1水平:治疗前后取空腹肘静脉血,置于肝素抗凝管中。分别取取100 μL全血至3支试管中,向各试管中分别加入10 μL抗体PE-Cy5-CD4、FITC-CD8和PE-PD-1, PE-Cy5-CD4、FITC-CD8和PE-PD-L1,PE-Cy5-IgGl、FITC-IgGl和PE-IgGl,室温避光孵育半小时。加入2 mL细胞裂解液,磷酸盐缓冲液离心洗涤2次,流式细胞仪检测CD4+、CD8+T淋巴细胞上PD-1、PD-L1的荧光强度。⑤记录治疗期间不良反应。
1.5 统计学方法 应用SPSS 19.0统计软件处理数据。计量资料比较采用两独立样本的t检验和配对t检验,计数资料比较采用χ2检验,等级资料比较采用秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 2组临床疗效和总有效率比较 观察组临床疗效和总有效率均高于对照组,差异有统计学意义(P<0.05),见表1。
2.2 2组临床症状相关指标比较 观察组菌斑指数、牙周探诊深度、牙龈出血指数均低于对照组,差异有统计学意义(P<0.05)。见表2。
表1 2组临床疗效和总有效率比较
Table 1 Comparison of clinical efficacy and total effective rate between two groups (n=96,例数,%)
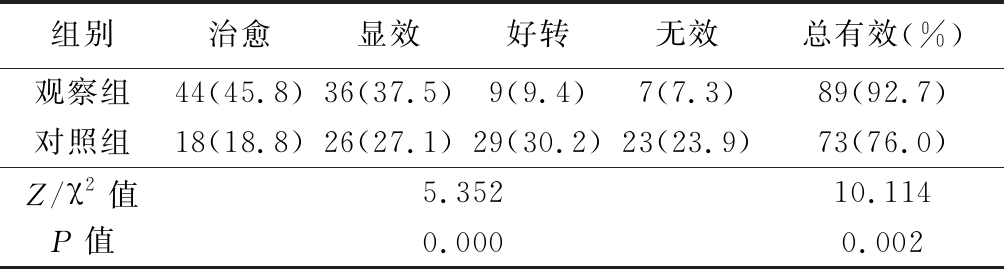
组别治愈显效好转无效总有效(%)观察组44(45.8)36(37.5)9(9.4)7(7.3)89(92.7)对照组18(18.8)26(27.1)29(30.2)23(23.9)73(76.0)Z/χ2值 5.35210.114P值 0.0000.002
表2 2组治疗后临床症状指标比较
Table 2 Comparison of clinical symptoms after treatment between two group ![]()
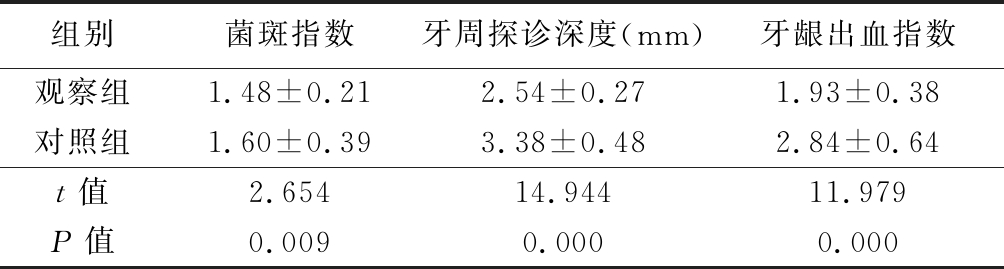
组别菌斑指数牙周探诊深度(mm)牙龈出血指数观察组1.48±0.212.54±0.271.93±0.38对照组1.60±0.393.38±0.482.84±0.64t值2.65414.94411.979P值0.0090.0000.000
2.3 2组治疗前后血清炎性因子比较 治疗前2组血清因子IFN-γ、TNF-α、IL-8、hs-CRP和IL-10差异均无统计学意义(P>0.05),治疗后2组血清因子IFN-γ、TNF-α、IL-8和hs-CRP均较治疗前明显降低(P<0.05),IL-10均较治疗前明显升高(P<0.05),观察组降低和升高幅度较大,治疗后观察组血清因子IFN-γ、TNF-α、IL-8和hs-CRP低于对照组,IL-10高于对照组,差异均有统计学意义(P<0.05)。见表3。
表3 2组治疗前后血清炎性因子水平比较
Table 3 Compared of serum inflammatory factors before and after treatment between two groups![]()
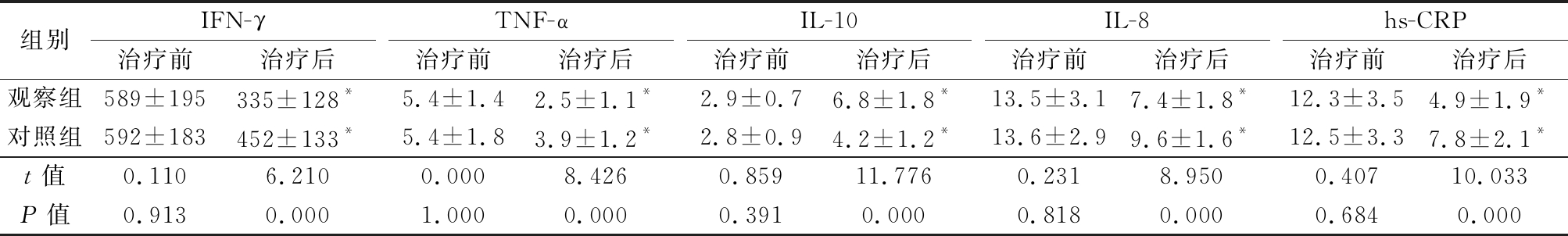
组别IFN-γ治疗前治疗后TNF-α治疗前治疗后IL-10治疗前治疗后IL-8治疗前治疗后hs-CRP治疗前治疗后观察组589±195335±128*5.4±1.42.5±1.1*2.9±0.76.8±1.8*13.5±3.17.4±1.8*12.3±3.54.9±1.9*对照组592±183452±133*5.4±1.83.9±1.2*2.8±0.94.2±1.2*13.6±2.99.6±1.6*12.5±3.37.8±2.1*t值0.1106.2100.0008.4260.85911.7760.2318.9500.40710.033P值0.9130.0001.0000.0000.3910.0000.8180.0000.6840.000
*P值<0.05与治疗前比较(配对t检验)
2.4 2组治疗前后PD-1、PD-L1水平比较 治疗前2组PD-1(CD4+)、PD-1(CD8+)、PD-L1(CD4+)和PD-L1(CD8+)差异均无统计学意义(P>0.05),治疗后2组PD-1(CD4+)、PD-1(CD8+)、PD-L1(CD4+)和PD-L1(CD8+)均较治疗前有明显降低(P<0.05),观察组降低幅度更大,治疗后观察组PD-1(CD4+)、PD-1(CD8+)、PD-L1(CD4+)和PD-L1(CD8+)均低于对照组,差异有统计学意义(P<0.05)。见表4。
2.5 2组不良反应发生率比较 治疗中观察组出现局部发痒肿胀3例(3.1%),对照组出现4例(4.2%),2组不良反应发生率差异无统计学意义(χ2=0.148,P=0.700)。
表4 2组治疗前后血清PD-1、PD-L1水平比较
Table 4 Comparison of serum PD-1 and PD-L1 levels before and after treatment between two groups![]()
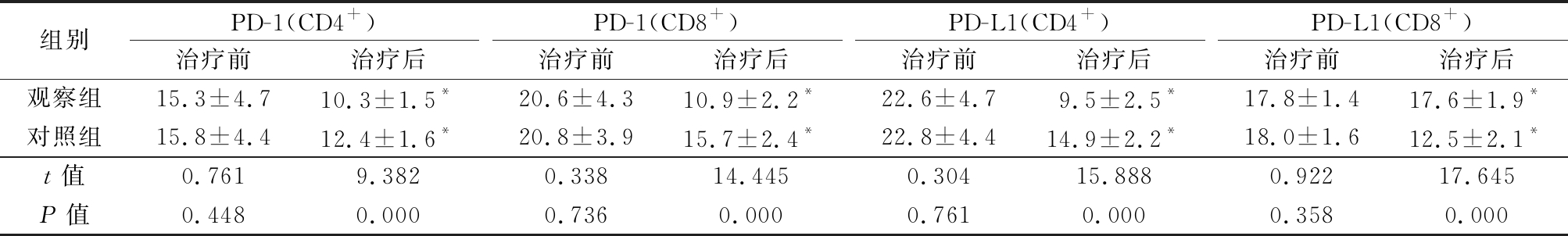
组别PD-1(CD4+)治疗前治疗后PD-1(CD8+)治疗前治疗后PD-L1(CD4+)治疗前治疗后PD-L1(CD8+)治疗前治疗后观察组15.3±4.710.3±1.5*20.6±4.310.9±2.2*22.6±4.79.5±2.5*17.8±1.417.6±1.9*对照组15.8±4.412.4±1.6*20.8±3.915.7±2.4*22.8±4.414.9±2.2*18.0±1.612.5±2.1*t值0.7619.3820.33814.4450.30415.8880.92217.645P值0.4480.0000.7360.0000.7610.0000.3580.000
*P值<0.05与治疗前比较(配对t检验)
3 讨 论
慢性牙周炎是临床表现为牙周袋形成、牙槽骨吸收或松动以及附着丧失的慢性感染性疾病,是由牙周细菌作用下炎症细胞浸润及炎症介质释放所致。在炎症发展中,机体免疫应答清除病原菌能力下降,牙周菌斑不能有效清除,持续存在的牙周菌斑会进一步加重牙周组织炎症反应及牙槽骨的破坏和吸收[7]。共刺激信号是免疫应答的重要环节,共刺激信号分子PD1/PD-L1在牙周炎扮演着重要角色。牙周细菌通过PD1/PD-L1信号通路抑制T淋巴细胞表达,削弱机体抗感染免疫反应,限制免疫介导的机体组织损伤并促发持续感染,导致疾病进展[8]。因此,阻断PD1/PD-L1信号通路对于牙周炎治疗至关重要。本研究观察米诺环素联合康复新液对慢性牙周炎血清PD-1、PD-L1表达的影响。
盐酸米诺环素软膏是消除局部炎症的临床常用药物,主要成分为盐酸二甲胺四环素,具有有效抑制和杀伤放线菌、螺旋菌、部分厌氧菌及革兰氏菌及胶原酶活性,防止组织再生破坏的效果[9]。局部使用盐酸米诺环素,载体降解后在牙周袋内形成保护膜,药物脂溶性扩散至体液中,发挥杀菌作用,而且牙周袋内药物浓度高,持续时间长,避免了全身不良反应。临床研究显示,单纯使用米诺环素能控制炎症发展,缓解症状,但不能促进牙周组织重新再生,需联合其他药物治疗[10]。康复新液是从干燥虫中提取的重要制剂,富含多元醇、黏糖氨酸、黏氨酸等多种氨基酸,具有抗炎、增强免疫力、提高血清溶菌酶活性和巨噬细胞吞噬能力的效果,还能促进肉芽组织再生、血管再生,促进创面愈合,缓解疼痛[11]。本研究观察发现,观察组治疗总有效率高于对照组(P<0.05),菌斑指数、牙周探诊深度、牙龈出血指数低于对照组(P<0.05),表明米诺环素联合康复新液可提高慢性牙周炎患者治疗效果,且不增加不良反应,安全性良好,与前人[12]研究一致。
慢性牙周炎患者牙周组织持续的炎症反应由共刺激信号、炎症因子及黏附分子诱导。PD1/PD-L1为免疫反应负性调节分子,二者结合,募集蛋白酪氨酸磷酸酶2(Scr homology 2 domain-containing protein tyrosine phosphatase-2,SHP-2)或SHP-1/2与胞内段的酪氨酸抑制基序和酪氨酸转换基序结合[13],从而抑制T细胞增殖活化和细胞因子的分泌。PD1主要表达在活化的巨噬细胞、B淋巴细胞和T淋巴细胞表面,PDL1为PD1的受体之一,在外周造血细胞和非造血细胞广泛表达。PDL1在慢性牙周炎中扮演保护性配体角色,通过减少TNF-α表达、刺激IL-22分泌来抑制炎症反应[14]。Merelli等[15]认为PD1/PD-L1是牙周炎治疗的新途径。本研究中,两组患者治疗后CD4+、CD8+T淋巴细胞上PD-1、PD-L1表达较治疗前下降(P<0.05),组间差异具有统计学意义(P<0.05),表明米诺环素联合康复新液可下调慢性牙周炎患者血清PD-1、PD-L1表达,提高疗效。朱德星等[16]认为,牙周基础治疗可下调血清PD-1、PD-L1表达,与牙周基础治疗后的临床转归有关。笔者认为,血清PD-1、PD-L1表达下调与炎症反应受到抑制有关。本研究发现观察组治疗后促炎因子IFN-γ、TNF-α、IL-8、hs-CRP降低(P<0.05),抑炎因子IL-10升高(P<0.05),一方面Th1细胞分泌细胞因子TNF-α、IL-8、hs-CRP等减少下调PD-1、PD-L1表达,另一方面,IFN-γ降低可显著下调单核细胞PD-L1表达,并负反馈抑制Th1细胞效应功能,机体免疫Th1/Th2平衡向Th2抑制炎症因子方向发展,免疫功能逐渐趋于正常。
总之,米诺环素联合康复新液可有效降低慢性牙周炎患者血清CD4+、CD8+T淋巴细胞上PD-1和PD-L1表达,缓解炎症反应,改善临床症状,提高治疗效果。但本研究样本量有限,有待于扩大化试验证实。
[1] 刘俊红,梁敏英,任丽洁,等.830例中老年人牙周健康状况调查分析[J].河北医科大学学报,2014,35(9):1098-1100.
[2] 喻爱霞.牙周炎患者应用牙周组织再生术联合正畸治疗的临床效果评价[J].河北医科大学学报,2017,38(3):306-310.
[3] 张丽媛.康复新液与盐酸米诺环素联合治疗慢性牙周炎疗效分析[J].中国现代药物应用,2017,11(1):116-117.
[4] Zhang J,Wang CM,Zhang P,et al. Expression of programmed death 1 ligand 1 on periodontal tissue cells as a possible protective feedback mechanism against periodontal tissue destruction[J]. Mol Med Rep,2016,13(3):2423-2430.
[5] 冯崇锦.口腔科疾病临床诊断与治疗方案[M].北京:科学技术文献出版社,2010:257-238.
[6] Liu X,Tan GR,Yu M,et al. The effect of tumour necrosis factor-α on periodontal ligament stem cell differentiation and the related signaling pathways[J]. Curr Stem Cell Res Ther,2016,11(7):593-602.
[7] Cekici A,Kantarci A,Hasturk H,et al. Inflammatory and immune pathways in the pathogenesis of periodontal disease[J]. Periodontology,2014,64(1):57-80.
[8] Zhu D,Liu F,Dai F,et al. Expression of programmed death-1 and programmed death ligand-1 in the peripheral T-lymphocytes from patients with chronic periodontitis[J]. Zhonghua Kou Qiang Yi Xue Za Zhi,2014,49(4):216-219.
[9] Tabenski L,Moder D,Cieplik F,et al. Antimicrobial photodynamic therapy vs. local minocycline in addition to non-surgical therapy of deep periodontal pockets:a controlled randomized clinical trial[J]. Clin Oral Investig,2017,21(7):2253-2264.
[10] 钟卓光.盐酸米诺环素软膏诊治慢性牙周炎的临床效果研究[J].中外医学研究,2014,12(34):52-53.
[11] 封帅,穆宏.康复新液治疗慢性牙周炎临床疗效观察[J].亚太传统医药,2014,10(2):97-98.
[12] 尹敏,黄林江,宣桂红.盐酸米诺环素软膏配合康复新液漱口对慢性牙周炎患者龈沟液IL-8和TNF-α水平的影响研究[J].中国生化药物杂志,2016,36(5):166-168.
[13] Taylor A,Harker JA,Chanthong K,et al. Glycogen synthase kinase 3 inactivation drives T-bet-mediated downregulation of co-receptor PD-1 to enhance CD8+ cytolytic T cell responses[J]. Immunity,2016,44(2):274-286.
[14] Lou J,Zhou Y,Huang J,et al. Relationship between PD-L1 expression and clinical characteristics in patients with breast invasive ductal carcinoma[J]. Open Med (Wars),2017,12:288-292.
[15] Merelli B,Massi D,Cattaneo L,et al. Targeting the PD1/PD-L1 axis in melanoma:biological rationale,clinical challenges and opportunities[J]. Crit Rev Oncol Hematol,2014,89(1):140-165.
[16] 朱德星,刘汾,戴芳,等.慢性牙周炎患者外周血T淋巴细胞表面程序性死亡分子1及其配体的表达[J].中华口腔医学杂志,2014,49(4):216-219.